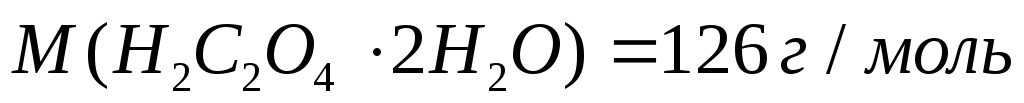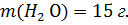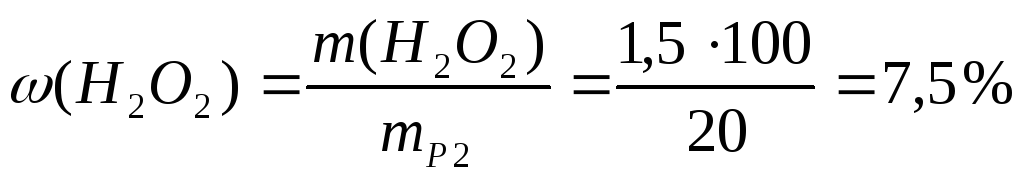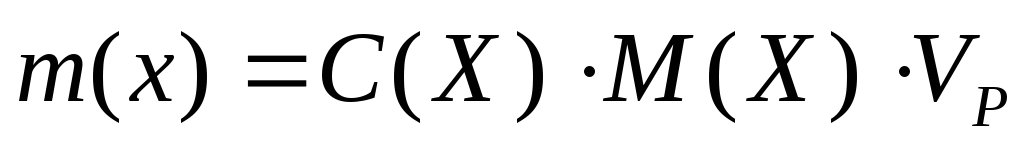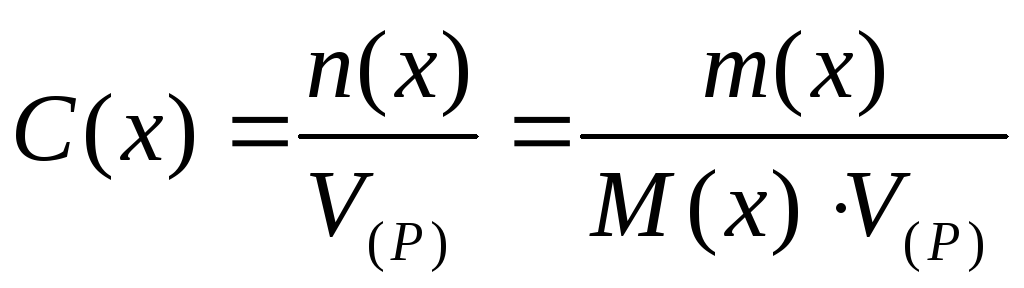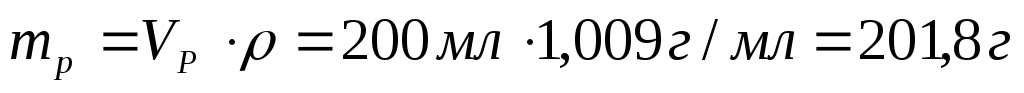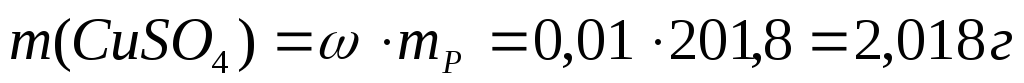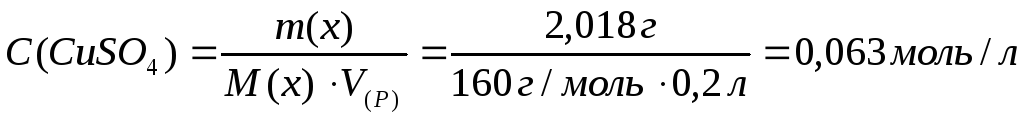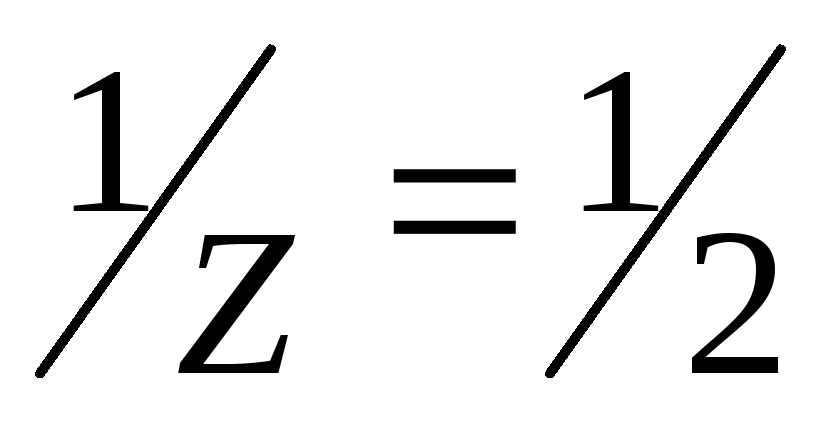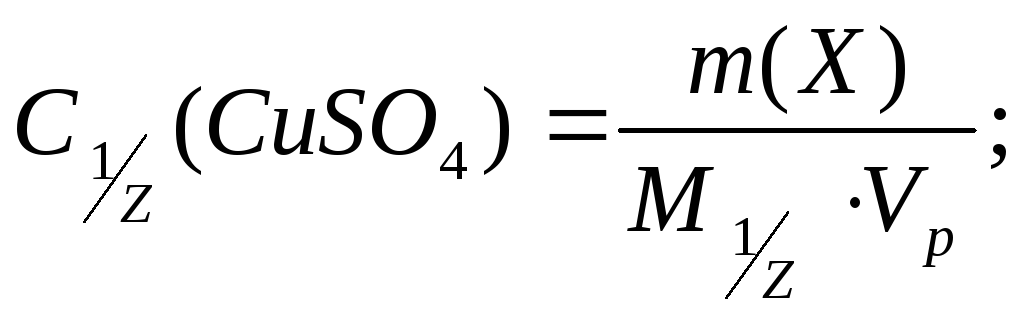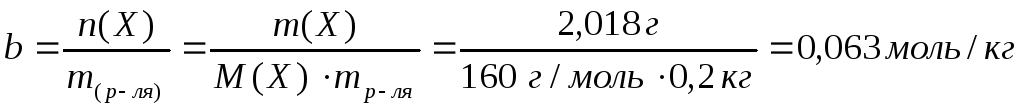- Алгоритм решения задач на приготовление раствора из кристаллогидрата
- Фурацилин – эффективный противомикробный препарат
- Действие препарата
- Применение в стоматологии фурацилина:
- Таблетки
- Паста
- Раствор
- Противопоказания применения фурацилина
- Разрешен ли фурацилин в период беременности и кормлении грудью?
- Обучающие задачи с решениями
Алгоритм решения задач на приготовление раствора из кристаллогидрата



Определить массу кристаллогидрата Na2CO3∙ 10H2O и воды, которые необходимо взять для приготовления раствора массой 540 г. с массовой долей карбоната натрия 15%.
1. Запишите условие задачи с помощью общепринятых обозначений.
1. Определите массу карбоната натрия Na2CO3, содержащегося в 540 г. раствора
m (Na2CO3) = 15% ∙ 540 г. /100% = 81 г.
2. Сделайте пересчет рассчитанной массы на кристаллогидрат. Для этого рассчитайте молярные массы Na2CO3 и Na2CO3∙ 10H2O
Отсюда по формуле m = n∙ M найдите массы Na2CO3 и Na2CO3∙ 10H2O, приняв количество вещества n равным 1 моль
3. Вычислите массу кристаллогидрата, составив отношение:
х = 286∙ 81/ 106 = 219 г. – масса Na2CO3∙ 10H2O, необходимая для приготовления раствора.
4. Вычислите массу воды:
m(Н2О) = 540 – 219 = 321 г.
5. Запишите ответ:
Ответ: для приготовления раствора потребуется 219 г. Na2CO3∙ 10H2O и 321 г. воды
Задачи для самостоятельного решения:
1. Раствор Люголя, применяющийся в ЛОР-практике для смазывания слизистой оболочки полости рта и горла, содержит 17 мл воды, 1 г йода и 2 г йодида калия. Рассчитайте массовые доли йода и иодида калия в растворе Люголя.
2. Для смазывания десен приготовлен раствор из 5 мл 30%-ного раствора Н2О2 и 15 мл дистиллированной воды. Рассчитайте массовую долю Н2О2 в полученном растворе. (Плотность раствора принять равной 1 г/мл)
3. В медицинской практике применяют водные растворы перманганата калия разной концентрации. Рассчитайте массу KМnO4 и объем воды, необходимые для приготовления 100г. 3%-ного раствора перманганата калия.
4. Какие массы соли и воды необходимо взять для приготовления 500 г 0,9% -ного раствора NaCl? Такой раствор называется физиологическим и широко используется в медицинской практике.
5. В медицине применяется 5%-ный спиртовой раствор йода для обработки ран, ссадин, операционного поля. Какой объем 5%-ного спиртового раствора йода можно приготовить из 10 г кристаллического йода? Плотность раствора 0,950 г/мл.
6. При ожогах щелочами пораженный участок кожи в течение 10-15 минут обмывают водой, а затем нейтрализуют раствором с массовой долей уксусной кислоты 2%. Какая масса уксусной эссенции с массовой долей кислоты 60% необходима для приготовления 2%-ного раствора массой 600 г?
7. При ожоге кожи кислотой, для нейтрализации применяют 3%-ный раствор гидрокарбоната натрия. Сколько граммов раствора, содержащего 25 % этой соли и воды понадобится для приготовления 100 г 3%-ного раствора.
8. При некоторых аллергических заболеваниях взрослым назначают раствор с массовой долей хлорида кальция CaCl2 10%, детям – с массовой долей CaCl2 – 5%. Рассчитайте массу 10 %-ного и 2%-ного растворов CaCl2, которые необходимы для приготовления 400 г 5%-ного раствора CaCl2.
9. Из 400 г 50% раствора серной кислоты выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
10. К 500 мл 30% раствора азотной кислоты (плотность 1,20 г/мл) прибавили 1 л воды. Чему равна массовая доля HNO3 в полученном растворе?
Порядок выполнения задания: решение упражнений на смещение химического равновесия.
Задача (пример)
Укажите, как повлияет:
а) повышение давления;
б) повышение температуры;
в) увеличение концентрации кислорода на равновесие системы:
а) Изменение давления смещает равновесие реакций с участием газообразных веществ (г). Определим объёмы газообразных веществ до и после реакции по стехиометрическим коэффициентам:
По принципу Ле Шателье, при увеличении давления, равновесие смещается в сторону образования веществ, занимающих меньший объём, следовательно равновесие сместится вправо, т.е. в сторону образования СО2, в сторону прямой реакции (→).
б) По принципу Ле Шателье, при повышении температуры, равновесие смещается в сторону эндотермической реакции (-Q), т.е. в сторону обратной реакции – реакции разложения СО2 (←), т.к. по закону сохранения энергии:

в) При увеличении концентрации кислорода равновесие системы смещается в сторону получения СО2 (→) т.к. увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции.
Задача для самостоятельного решения:
Укажите, как повлияет:
а) повышение давления;
б) повышение температуры;
в) увеличение концентрации исходных веществ на равновесие систем:
Источник
Фурацилин – эффективный противомикробный препарат

Действие препарата
Основным действующим веществом является нитрофурил. При попадании на пораженный участок мгновенно образуется защитная пленка, которая устраняет имеющиеся там бактерии и грибки. Действие приводит к разрушению поражений и остановке воспалительного процесса. Используется для удаления стрептококков, стафилококков и других опасных микроорганизмов. Оказывает эффективное действие несмотря на низкую стоимость.
Применение в стоматологии фурацилина:
Восстановление десен после установки имплантов и протезов;
Лечебная терапия при ранах, язвочках, воспалительном процессе;
Лечение заболеваний горла, которые могут распространиться на полость рта;
Лечение свища в десне;
Полоскание при заболеваниях десен;
Прикладывание при отечности, растворение уплотнений после укола;
Лечение налета в уголках рта после кандидоза.
Таблетки

Для приготовления следует измельчить таблетку до состояния порошка и растворить его в горячей воде. Использовать в теплом виде для промывания носа, полости рта и горла. Не полоскать горячим, чтобы не повредить слизистую оболочку.
В аптеках можно приобрести средство в тюбиках по 10 или 50 мл. Внутри содержится инструкция по применению. При небольших хирургических операциях мазь назначают для восстановления и удаления воспалительного процесса. Нередко применяется для снятия воспаления слухового прохода.
Паста
Фурацилин в виде пасты применяется для профилактики в летний период времени. Он защищает кожный покров от воздействия высокой температуры. Нередко используется на химических предприятиях, где производятся ядовитые химические вещества.
Пасту необходимо тонким слоем нанести на открытую кожу. Можно использовать на лице. В составе не содержится вредных веществ. Оказывает противовоспалительное действие. После нанесения образуется тонкая пленка, которая защищает кожный покров от воздействия вредных веществ. Смывается обычной водой с мылом.
Раствор
Раствор фурацилина можно приобрести в аптеке в готовом виде. Однако если вы часто путешествуете и носите его с собой, то целесообразнее будет купить таблетки и сделать раствор самостоятельно. Их легче хранить, не беспокоясь за упаковку.
Применяется раствор для лечения проблем горла: фарингит, тонзиллит и другие воспалительные заболевания. Если же вы планируете лечить только в домашних условиях, то купите готовый раствор. Он уже будет приготовлен в верных пропорциях. Вы будете уверены в его стерильности, а упаковка будет герметичной.
При самостоятельном приготовлении необходимо тщательно следовать инструкции. Так как если раствор получится слишком концентрированным, то вы можете повредить слизистую оболочку, которая и так воспалена. При недостаточной концентрации препарат может не оказать нужного воздействия.
С помощью полоскания фурацилином со слизистой оболочки устраняются негативные микроорганизмы. При самостоятельном приготовлении раствора делайте его на 1 процедуру, чтобы он постоянно был свежим. Хранить препарат следует в прохладном темном месте.
Противопоказания применения фурацилина
Подходит для лечения взрослых и детей. Для детей он нередко применяется в лечении стоматита. Важно лишь следить, чтобы ребенок не проглотил препарат для предотвращения негативных последствий в виде тошноты, рвоты, крапивницы и головной боли.
Противопоказаниями к применению могут быть аллергические реакции на компоненты средства, дерматит, лишай и псориаз.
Разрешен ли фурацилин в период беременности и кормлении грудью?
В период беременности женщин фурацилин разрешен для наружного применения. Раствор рекомендуется использовать для подмываний в профилактических целях и для лечения бактериальных инфекций. Молочница часто сопровождает женщин в этот период, фурацилин способен снизить ее проявление и снять воспалительный процесс.
При кормлении грудью фурацилин используется с осторожностью наружным способом. Это связано с тем, что после его использования молоко может иметь горький привкус и малыш откажется от груди. Поэтому применение в этот период должно строго контролироваться врачом для исключения негативных последствий.
Источник
Обучающие задачи с решениями
1. Растворы глюкозы широко используются в медицине. Рассчитайте массовую долю глюкозы в растворе, полученном растворением 25 г глюкозы в 100 мл воды.
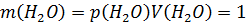

Ответ: 
2. Раствор NaHCO3 используется в медицине для коррекции кислотно-основного баланса организма, раствор CaCl2 используется как противовоспалительное средство. Вычислите массу (г) и количество (моль) растворенного вещества, содержащегося в заданной массе раствора с указанной массовой долей вещества:
а) 200 г 8,4 %-ного раствора NaHCO3;
б) 300 г 11,1 %-ного раствора CaCl2.
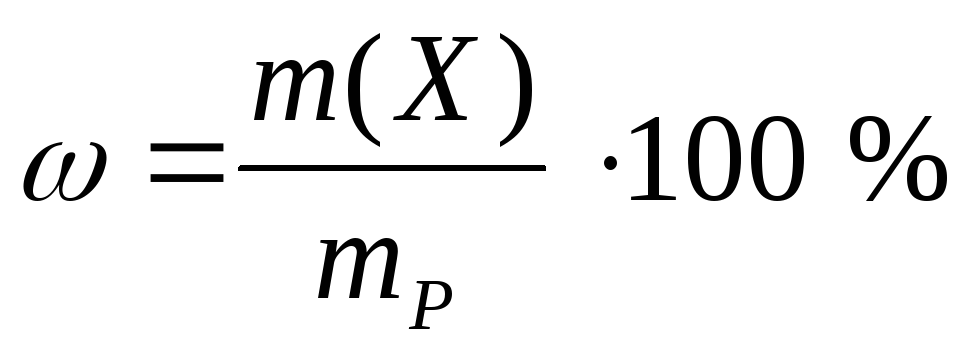

а) 
б) 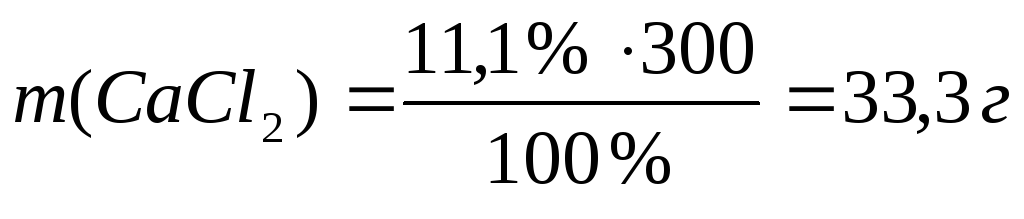
Ответ:

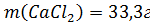

3. Щавелевая кислота и ее соли являются метаболитами живого организма. В дистиллированной воде растворили кристаллическую щавелевую кислоту (H2C2O4 ∙ 2H2O) массой 2,52 г. Вычислите молярную концентрацию щавелевой кислоты в полученном растворе, если его объем равен 200 мл.
4. Для смазывания десен приготовлен раствор из 5 мл 30 %-ного раствора Н2О2 и 15 мл дистиллированной воды. Рассчитайте массовую долю Н2О2 в полученном растворе. Плотность растворов Н2О2 принять равной 1 г/мл.
Ответ: 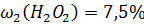
5. Вычислите массу (г) растворенного вещества, содержащегося в заданном объеме раствора с указанной молярной концентрацией:
а) 150 мл 0,5 М СН3СООН;
б) 200 мл 0,1 М КОН.
а) m(CH3COOH) = 0,5 моль/л · 60 г/моль · 0,15 л = 4,5 г
Ответ: 
6. Содержание ионов К + в плазме крови в норме колеблется от 13,7 до 24,0 мг%. Вычислите концентрацию ионов К + в плазме крови в моль/л (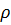
Ответ:
7. В сточной воде находятся ионы Ве 2+ (0,003 моль/л). Во сколько раз необходимо разбавить сточную воду, чтобы ее можно было сливать в водоем (ПДК = 0,0002 мг/л)?
Решение. Содержание вредных примесей в воде, сливаемой в водоем, не должно превышать предельно допустимую концентрацию (ПДК), которая составляет для Ве 2+ 0,0002 мг/л.
А(Ве 2+ ) = 9 г/моль.
В соответствии с условием концентрация ионов Ве 2+ равна 0,003 моль/л ∙ 9 г/моль = 0,027 г/л = 27 мг/л; для достижения ПДК необходимо разбавить воду: 27 : 0,0002 = 135 000 раз.
Ответ: сточную воду необходимо разбавить в 135 000 раз.
8. В человеческом организме в общей сложности содержится примерно 25 мг йода (входящего в состав различных соединений), причем 70 % всей массы йода находится в щитовидной железе. Подсчитайте, сколько атомов йода находится: а) в щитовидной железе; б) в человеческом организме в целом.
Решение. Число атомов йода в человеческом организме равно произведению числа Авогадро (NA) и количества молей йода или произведению числа Авогадро (NA) и отношения массы атомов йода к его молярной массе:
В щитовидной железе число атомов йода на 30 % меньше и составляет N(I) = 0,7 ∙ 1,186 ∙ 10 20 = 8,3 ∙ 10 19 .
Ответ: в человеческом организме содержится 1,19 ∙ 10 20 , в щитовидной железе – 8,3 ∙ 10 19 атомов йода.
9. В лаборатории имеется 200 мл 1 %-ного раствора сульфата меди (II) (ρ = 1,009 г/мл). Вычислите молярную, моляльную, молярную концентрацию эквивалента и титр этого раствора.
Ответ:

10. Вычислите молярную концентрацию 5 %-ного раствора HCl (плотность раствора принять за 1 г/см 3 ).
Решение. В 100 г раствора содержится 5 г HCl.

Ответ: С(HCl) = 1,37 моль/л.
11. В каком объеме воды следует растворить 0,05 кг кристаллогидрата СuSO4 · 5H2O, чтобы получить раствор с массовой долей сульфата меди (II) 3 %.
m(H2O) = mp – m(CuSO4 · 5H2O) = 1066 г – 50 г = 1016 г
12. До какого объема необходимо разбавить 30 мл 80% раствора H2SO4 (ρ=1,8 г/см 3 ), чтобы получить раствор кислоты с концентрацией 0,1 моль/л.
Источник