- КАЛЬЦИМЕТРЫ
- РАЗДЕЛЫ
- ПРАКТИЧЕСКИЕ СОВЕТЫ
- Содержание
- 1. Определение плотности соляной кислоты.
- 2. Определение концентрации водных растворов соляной кислоты.
- 3. Приготовление водных растворов соляной кислоты в заданном объемном соотношении.
- 4. Приготовление водных растворов соляной кислоты требуемой весовой концентрации.
- 5. Приготовление водных растворов соляной кислоты заданной молярной концентрации.
- 6. Расход соляной кислоты для определения карбонатности образцов горной породы.
- 7. Подготовка образца
- 8. Нейтрализация остатков соляной кислоты
- Работа 1. Приготовление рабочего 0,1N раствора HCl
- Приготовление и стандартизация рабочего раствора HCl
КАЛЬЦИМЕТРЫ

набережная реки Лазури, 15 geosfera@geosferatver.ru
tver@upeg.net
| производство и поставка оборудования |
РАЗДЕЛЫПРАКТИЧЕСКИЕ СОВЕТЫСодержание1. Определение плотности соляной кислоты.Пример. Кислота отобрана в шприц, полный объем которого V = 24,6 см 3 . Масса кислоты, измеренная на электронных весах, m = 29,175 г. 2. Определение концентрации водных растворов соляной кислоты.Пример. Масса раствора соляной кислоты объемом 24,6 см 3 равна 26,2 г. Необходимо определить, в каком объемном соотношении концентрированная кислота смешана с водой, исходную концентрацию, а также весовую и молярную концентрацию (нормальность) раствора. 3,881 + (4,004 – 3,881)·(36,5 – 36,0) = 3,942 моль/л Затем по таблице 5 определите весовую концентрацию раствора: 13,30 + (13,69 – 13,30)·(36,5 – 36,0) = 13,49 % вес. 3. Приготовление водных растворов соляной кислоты в заданном объемном соотношении.Пример. Для приготовления 500 мл раствора в объемном соотношении 1:4 необходимо 100 мл концентрированной кислоты аккуратно влить в 400 мл дистиллированной воды, тщательно перемешать и перелить раствор в емкость из темного стекла с герметичной крышкой. 4. Приготовление водных растворов соляной кислоты требуемой весовой концентрации.Пример. Необходимо приготовить 1 л раствора HCL концентрацией 6 % вес. из соляной кислоты концентрацией 36 % вес. (такой раствор используется в карбонатомерах КМ производства ООО НПП «Геосфера»). 1,692 / 11,643 = 0,1453 л. Следовательно, добавив 145 мл кислоты (36 % вес.) в 853 мл дистиллированной воды, получите раствор заданной весовой концентрации. 5. Приготовление водных растворов соляной кислоты заданной молярной концентрации.Vв = V(M/Mp – 1) где M – молярная концентрация исходной кислоты. Пример. Весовая концентрация используемой кислоты 36,3 % вес. Необходимо приготовить 1 л водного раствора HCL с молярной концентрацией 2,35 моль/л. 11,643 + (12,011 – 11,643)·(36,3 – 36,0) = 11,753 моль/л По приведенной выше формуле рассчитайте объем воды: Vв = V (11,753 / 2,35 – 1) = 4·V Принимая Vв + V = 1 л, получите значения объемов: Vв = 0,2 л и V = 0,8 л. Следовательно, для приготовления раствора с молярной концентрацией 2,35 моль/л, нужно влить 200 мл HCL (36,3 % вес.) в 800 мл дистиллированной воды. 6. Расход соляной кислоты для определения карбонатности образцов горной породы.CaCO3 + 2HCL = CaCL2 + H2O + CO2 CaMg(CO3)2 + 4HCL = CaCL2 + MgCL2 + 2H2O + 2CO2 FeCO3 + 2HCL = FeCL2 + H2O + CO2 Наибольшее количество кислоты расходуется на разложение доломита, т.к. в 1 г CaMg(CO3)2 содержится 21,691 мг-экв., в 1 г CaCO3 – 19,982 мг-экв., а в 1 г FeCO3 – 17,262 мг-экв. Для полного разложения карбонатов необходимо израсходовать такое же количество мг-экв. HCL. В 1 мл концентрированной соляной кислоты (35…38% вес.) содержится 11,267…12,381 мг-экв. (таблица 1). Поэтому на разложение 1 г доломита теоретически необходимо от 21,691 / 12,381 = 1,75 мл до 21,691 / 11,267 = 1,92 мл концентрированной кислоты (таблица 7). При проведении исследований образцов горных пород расход концентрированной кислоты должен быть не менее 2 мл на 1 г карбонатных веществ. Избыток кислоты необходим для нормального протекания химической реакции. Для карбонатомеров серии КМ производства ООО НПП «Геосфера» расход концентрированной соляной кислоты на один образец составляет не более 2,35 мл. 7. Подготовка образцаДля определения карбонатности горной породы необходима навеска измельченного образца массой от 500 мг до 1000 мг. Навеска большей массы позволяет достовернее определить содержание кальцита и доломита, особенно в низкокарбонатных образцах. Для получения навески массой 1000 мг нужно отобрать и измельчить не менее 3 г сухих флагментов керна или промытых и высушенных частиц шлама основной породы. После измельчения образца необходимо просеять порошок через сито с размером ячеек 0,056 мм или 0,063 мм. Если образец отобран из нефтенасыщенного керна или шлама, то после измельчения следует выполнить экстрагирование образца органическим растворителем (четыреххлористым углеродом CCl4 или хлороформом CHCl3). Для экстрагирования просеянный порошок необходимо насыпать кучно на листок фильтровальной бумаги и с помощью пипетки нанести на него под вытяжкой 30…40 капель растворителя. После испарения растворителя из образца нужно отобрать навеску для взвешивания. Взвешивание следует осуществлять на электронных весах не ниже 3 класса точности, имеющих дискретность отсчета не менее 1 мг. Взвешиваемый образец рекомендуется насыпать на подложку из плотной мелованной бумаги (для удобства последующей засыпки в контейнер реакционной камеры карбонатомера). Следует учитывать, что неточное взвешивание образца увеличивает погрешность определения карбонатности. Например, при погрешности взвешивания ± 10 мг дополнительная ошибка определения карбонатности образца массой 500 мг составляет ± 2%. 8. Нейтрализация остатков соляной кислотыДля нейтрализации остатков HCl необходимо добавить в раствор равное количество мг-экв. одного из веществ, взаимодействующих с соляной кислотой (например, бикарбонат натрия NaHCO3, бикарбонат калия KHCO3, углекислый натрий Na2CO3, углекислый калий K2CO3, гидроокись натрия NaOH или гидроокись калия KOH). Расчетное количество безводных веществ, затрачиваемых на нейтрализацию кислоты, содержащейся в 1 мл водных водных растворов HCl разной концентрации, приведено в таблице 10. Количество вещества, используемого для нейтрализации остатков HCl после исследования образца породы массой 1 г, может быть определено исходя из объема раствора кислоты, не затраченной на реакцию. Пример. При исследовании образца породы массой 1 г, содержащего 85% кальцита, израсходовано 15 мл водного раствора HCl (1:6), приготовленного из кислоты с концентрацией 38% вес. Необходимо определить количество NaHCO3 для нейтрализации остатков HCl после реакции. Расчетный объем раствора кислоты для разложения 1 г CaCO3 равен 11,3 мл (таблица 8). Избыток раствора HCl составляет 15,0 – 11,3 = 3,7 мл. Расчетное количество непрореагированной кислоты равно 11,3·(1 – 85/100) = 1,7 мл. Следовательно, необходимо нейтрализовать кислоту в растворе объемом 3,7 + 1,7 = 5,4 мл. Используя таблицу 10, рассчитываем требуемое для нейтрализации количество безводного бикарбоната натрия 0,149 · 5,4 = 0,8 г. Фактический расход безводных веществ, используемых для нейтрализации остатков кислоты в 1 мл раствора, больше расчетных значений (таблица 10) на величину (100/C -1)% где С – весовая доля чистого вещества в безводном порошке, % вес. Пример. Для нейтрализации кислоты, содержащейся в 1 мл разбавленного (1:6) раствора HCl с начальной концентрацией 38 % вес. согласно таблице 10 необходимо 0,099 г KOH. Весовая доля KOH равна 88 % вес. Фактическое количество вещества, затрачиваемого на нейтрализацию кислоты больше расчетного и равно Из химических веществ, пригодных для нейтрализации соляной кислоты, наиболее доступным является бикарбонат натрия NaHCO3 по ГОСТ 2156-76 (он же двууглекислый натрий или пищевая сода). Источник Работа 1. Приготовление рабочего 0,1N раствора HClРАСТВОРЫ В этом разделе представлены работы, касающиеся приготовления растворов заданной концентрации и определения их свойств. Данный раздел является достаточно важным для будущих врачей, т.к. все важнейшие биологические системы (цитоплазма, кровь, лимфа, слюна, моча и т.д.) являются водными растворами солей, белков, углеводов, липидов, а также многие лекарственные средства представляют собой растворы. Работы, представленные в данном разделе, позволяют приобрести навыки приготовления растворов и их анализа. Работа 1. Приготовление рабочего 0,1N раствора HCl Задача работы:ознакомление с методикой определения плотности растворов и приготовление раствора методом разбавления. Оборудование, реактивы: набор ареометров, цилиндр на 200 мл, концентрированный раствор HCl, мерная колба на 100 мл (или иного объема на усмотрение преподавателя), мерные пипетки, дистиллированная вода, груша. Выполнение работы: 1. Чтобы приготовить приблизительно 0,1N раствор HCl путем разбавления концентрированной кислоты, необходимо знать более или менее точно концентрацию исходного концентрированного раствора соляной кислоты. Ее концентрацию можно узнать путем измерения ее плотности при помощи ареометра. Для этого наливают исследуемый раствор в цилиндр на 200 мл и опускают в него ареометр. 2. Измеряют ареометром плотность исходного раствора. 3. По справочной таблице 1.1 находят концентрацию HCl, соответствующую плотности данной соляной кислоты. Источник Приготовление и стандартизация рабочего раствора HClЛабораторная работа № 2 Цель работы – приготовить 0,1 н. раствор HCl путем разбавления более концентрированного раствора и установить точную концентрацию приготовленного раствора (стандартизировать). Сущность работы. Точную концентрацию раствора HCl устанавливают по результатам титрования стандарта – раствора тетрабората натрия Na2B4O7∙10H2O: В точке эквивалентности рН раствора определяется присутствием слабой борной кислоты. Фактор эквивалентности Na2B4O7 равен 1 /2. Приборы и посуда: технические и аналитические весы; электрическая плитка; мерные цилиндры (20–25 мл, 250 мл и 500 мл); денсиметр (ареометр); склянка с этикеткой для хранения рабочего раствора; мерная колба; пипетка; бюретка, колбы для титрования; тигель. Реактивы: Na2B4O7×10H2O (х. ч.); концентрированный раствор HCl; индикатор – метиловый оранжевый. 1. Приготовление рабочего раствора HCl путем разбавления более концентрированного раствора кислоты до концентрации 0,1 н.: ü с помощью денсиметра измеряют плотность концентрированного раствора кислоты: ü по справочнику находят молярную концентрацию (моль/л) HCl в растворе: ü рассчитывают объем концентрированного раствора, необходимый для приготовления 500 мл 0,1 н. раствора^ Vконц = ü цилиндром отмеряют рассчитанный объем, переносят его в мерный цилиндр вместимостью 500 мл и разбавляют дистиллированной водой до нужного объема; ü приготовленный раствор переливают через воронку в склянку для хранения, закрывают притертой пробкой и тщательно перемешивают содержимое. Приготовленный раствор имеют приблизительно известную концентрацию, поэтому его необходимо стандартизировать. 2. Установление точной концентрации приготовленного раствора (стандартизация): ü рассчитывают ориентировочную массу установочного вещества – Na2B4O7×10H2O, необходимую для приготовления 100,0мл 0,1 н. раствора; ü тетраборат натрия в количестве, отличающемся не более чем на 10 % от расчетного, взвешивают в тигле на технических, а затем на аналитических весах. Навеску аккуратно пересыпают через сухую воронку в мерную колбу и струей горячей воды смывают ее в колбу (в холодной воде Na2B4O7×10H2O растворяется плохо). Тигель с оставшимися на стенках частицами Na2B4O7×10H2O снова взвешивают на аналитических весах. По разности двух взвешиваний находят массу вещества, перенесенного в колбу: ü заполняют колбу на 2 /3 объема горячей дистиллированной водой. Снимают с колбы воронку и, перемешивая содержимое колбы плавными круговыми движениями, добиваются полного растворения тетрабората натрия. Охлаждают раствор до комнатной температуры, разбавляют его до метки дистиллированной водой и тщательно перемешивают содержимое колбы, многократно перевертывая и встряхивая ее. Вычисляют молярную концентрацию эквивалента тетрабората натрия С( 1 /2Na2B4O7) с точностью до 4 значащих цифр: С( 1 /2Na2B4O7) = ü приступают к титрованию: вымытую бюретку ополаскивают небольшим количеством приготовленного раствора кислоты и заполняют этим раствором; ü в чистую коническую колбу переносят пипеткой определенный объем (аликвоту) ______ мл приготовленного раствора Na2B4O7, прибавляют 1–2 капли индикатора метилоранжа и начинают титровать, перемешивая жидкость плавным круговым движением колбы, до перехода окраски от желтой к оранжевой; ü титрование повторяют несколько раз, пока не будет получено не менее трех значений объема титранта, различающихся между собой не более чем на 0,1 мл. Все полученные результаты должны обязательно заноситься в лабораторный журнал, даже если они и одинаковые. Рассчитывают средний объем титранта, учитывая только те значения, которые различаются не более чем на 0,1 мл: ü по результатам титрования рассчитывают точную концентрацию приготовленного раствора кислоты: СHCl =
Дата выполнения: «___» ___________ 2009 г. Подпись преподавателя: _________________ Дата защиты: «___» ___________ 2009 г. Источник |


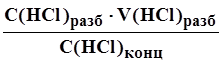 =
=
 =
= =
=