Как приготовить 0 01н раствор серной кислоты
В анализах методом нейтрализации применяют 0,1 н. и 0,5 н. точные растворы серной и соляной кислот, а в других методах анализа, например в окислительно-восстановительном, часто используют 2 н. приблизительные растворы этих кислот.
Для быстрого приготовления точных растворов удобно пользоваться фиксаналами, представляющими собой навески (0,1 г-экв или 0,01 г-экв) химически чистых веществ, взвешенные с точностью до четырех-пяти значащих цифр, находящиеся в запаянных стеклянных ампулах. При приготовлении 1 л. раствора из фиксанала получают 0,1 н. или 0,01 н. растворы. Небольшие количества растворов соляной и серной кислот 0,1 н. концентрации можно готовить из фиксаналов. Стандартные растворы, приготовленные из фиксаналов, обычно служат для установления или проверки концентрации других растворов. Фиксаналы кислот можно хранить долгое время.
Для приготовления точного раствора из фиксанала ампулу обмывают теплой водой, смывая с нее надпись или этикетку, и хорошо обтирают. Если надпись сделана краской, то ее удаляют тряпочкой, смоченной спиртом. В мерную колбу емкостью 1 л. вставляют стеклянную воронку, а в нее — стеклянный боек, острый конец которого должен быть направлен вверх. После этого ампулу с фиксаналом слегка ударяют тонким дном об острие бойка или дают ей свободно падать, чтобы дно разбилось при ударе об острие. Затем стеклянным штырем с заостренным концом разбивают тонкую стенку углубления в верхней части ампулы и дают содержащейся в ампуле жидкости вытечь. Потом ампулу, находящуюся в воронке, тщательно промывают дистиллированной водой из промывалки, после чего удаляют из воронки, промывают воронку и удаляют ее из колбы, а раствор в колбе доливают до метки дистиллированной водой, закрывают пробкой и перемешивают.
При приготовлении растворов из сухих фиксаналов (например, из фиксанала щавелевой кислоты) берут сухую воронку, чтобы содержимое ампулы можно было при легком встряхивании пересыпать в колбу. После того как вещество перенесут в колбу, промывают ампулу и воронку, растворяют вещество в воде, находящейся в колбе, и доводят объем раствора дистиллированной водой до метки.
Большие количества 0,1 н. и 0,5 н. растворов соляной и серной кислот, а также приблизительные растворы этих кислот (2 н. и др.) готовят из концентрированных химически чистых кислот. Вначале ареометром или денсиметром определяют плотность концентрированной кислоты.
По плотности в справочных таблицах находят концентрацию кислоты (содержание хлористого водорода в соляной кислоте или моногидрата в серной), выраженную в граммах на 1 л. По формулам рассчитывают объем концентрированной кислоты, необходимый для приготовления заданного объема кислоты соответствующей концентрации. Расчет проводят с точностью до двух-трех значащих цифр. Количество воды для приготовления раствора определяют по разности объемов раствора и концентрированной кислоты.
Раствор соляной кислоты готовят путем приливания в сосуд для приготовления раствора половины требуемого количества дистиллированной воды, а затем концентрированной кислоты; после перемешивания раствор доливают до полного объема оставшимся количеством воды. Частью второй порции воды ополаскивают мензурку, которой отмеривали кислоту.
Раствор серной кислоты готовят путем медленного приливания концентрированной кислоты при постоянном перемешивании (чтобы не допустить разогревания) к воде, налитой в сосуд из термостойкого стекла. При этом небольшое количество воды оставляют для ополаскивания мензурки, которой отмеривали кислоту, приливая этот остаток в раствор после его охлаждения.
Иногда для химического анализа применяют растворы твердых кислот (щавелевой, винной и др.). Эти растворы готовят растворением в дистиллированной воде навески химически чистой кислоты.
Массу навески кислоты вычисляют по формуле. Объем воды для растворения берут приблизительно равным объему раствора (если растворение ведется не в мерной колбе). Для растворения этих кислот применяют воду, не содержащую углекислого газа.
Пример 1. Рассчитать количество концентрированной соляной кислоты плотности 1,14 г/см 3 и количество воды, необходимое для приготовления 10 л 0,1 н. раствора.
В таблице по плотности находим содержание хлористого водорода HCl в концентрированной кислоте: Гк = 315 г/л.
Рассчитываем объем концентрированного раствора соляной кислоты:
Vк = 36,5N•V / Тк = 36,5•0,1•10000 / 315 = 315 мл.
Количество воды, необходимое для приготовления раствора:
Пример 2. Рассчитать количество щавелевой кислоты, необходимое для приготовления 2 л 0,1 н. раствора.
Масса навески щавелевой кислоты H2C2O4•2H2O:
63,03N•V / 1000 = 63,03•0,1•3000 / 1000 = 12,6 г.
Установление концентрации рабочих растворов кислот можно проводить по карбонату натрия, буре, точному раствору щелочи (титрованному или приготовленному из фиксанала). При установлении концентрации растворов соляной или серной кислот по карбонату натрия или по буре пользуются методом титрования навесок или (реже) методом пипетирования. При методе титрования навесок используют бюретки емкостью 50 или 25 мл.
При установлении концентрации кислот большое значение имеет выбор индикатора. Титрование выполняют в присутствии такого индикатора, у которого переход окраски происходит в интервале pH, соответствующем точке эквивалентности для химической реакции, протекающей при титровании. При взаимодействии сильной кислоты с сильным основанием в качестве индикаторов можно использовать метиловый оранжевый, метиловый красный, фенолфталеин и другие, у которых переход окраски происходит при pH = 4?10.
При взаимодействии сильной кислоты со слабым основанием или с солями слабых кислот и сильных оснований в качестве индикаторов используют такие, у которых переход окраски происходит в кислой среде, например метиловый оранжевый. При взаимодействии слабых кислот с сильными щелочами применяют индикаторы, у которых переход окраски происходит в щелочной среде, например фенолфталеин. Концентрацию раствора нельзя определить титрованием, если при титровании взаимодействует слабая кислота со слабым основанием.
При установлении концентрации соляной или серной кислот по карбонату натрия на аналитических весах в отдельных бюксах берут три-четыре навески безводного химически чистого карбоната натрия с точностью до 0,0002 г. Для установления концентрации 0,1 н. раствора путем титрования из бюретки емкостью 50 мл масса навески должна быть около 0,15 г. Сушкой в сушильном шкафу при 150°С навески доводят до постоянной массы, а затем переносят в конические колбы емкостью 200—250 мл и растворяют в 25 мл дистиллированной воды. Бюксы с остатками карбоната взвешивают и по разности масс определяют точную массу каждой навески.
Титрование раствора карбоната натрия кислотой ведут в присутствии 1—2 капель 0,1%-ного раствора метилового оранжевого (титрование заканчивается в кислой среде) до изменения желтой окраски раствора в оранжево-желтую. При титровании полезно пользоваться раствором — «свидетелем», для приготовления которого в дистиллированную воду, налитую в такую же колбу, как и колба, в которой производится титрование, добавляют одну каплю кислоты из бюретки и столько капель индикатора, сколько его добавляют в титруемый раствор.
Объем дистиллированной воды для приготовления раствора — «свидетеля» должен быть примерно равен объему раствора в колбе в конце титрования.
Нормальную концентрацию кислоты рассчитывают по результатам титрования:
где mн — масса навески соды, г;
V — объем раствора кислоты (мл), израсходованный на титрование.
Из нескольких опытов берут среднюю сходящуюся величину концентрации.
Пример 3. Рассчитать массу навески карбоната натрия для установления концентрации 0,1 н. раствора серной кислоты, если для титрования используют бюретку емкостью 25 мл.
Предполагаем израсходовать на титрование около 20 мл кислоты.
Масса навески соды:
52,99 • 0,1 • 20 / 1000 = 0,1 г.
Пример 4. Навеска карбоната натрия в 0,1482 г оттитрована 28,20 мл раствора соляной кислоты. Определить концентрацию кислоты.
Нормальная концентрация соляной кислоты:
1000 • 0,1482 / 52,99 • 28,2 = 0,1012 н.
При установлении концентрации раствора кислоты по карбонату натрия методом пипетирования навеску химически чистого карбоната натрия, предварительно доведенную высушиванием в сушильном шкафу до постоянной массы и взвешенную с точностью до 0,0002 г, растворяют в дистиллированной воде в откалиброванной мерной колбе емкостью 100 мл.
Величина навески при установлении концентрации 0,1 н. раствора кислоты должна быть около 0,5 г (чтобы при растворении получить примерно 0,1 н. раствор). На титрование берут пипеткой 10—25 мл раствора карбоната натрия (в зависимости от емкости бюретки) и 1—2 капли 0,1%-ного раствора метилового оранжевого.
Метод пипетирования часто применяют при установлении концентрации растворов с помощью полумикробюреток емкостью 10 мл с ценой деления 0,02 мл.
Нормальную концентрацию раствора кислоты при ее установлении методом пипетирования по карбонату натрия вычисляют по формуле:
где mн — масса навески карбоната натрия, г;
V1 — объем раствора карбоната, взятый на титрование, мл;
Vк — объем мерной колбы, в которой производилось растворение навески карбоната;
V2 — объем раствора кислоты, израсходованный на титрование.
Пример 5. Определить концентрацию раствора серной кислоты, если для ее установления 0,5122 г карбоната натрия было растворено в мерной колбе емкостью 100,00 мл и на титрование 15,00 мл раствора карбоната израсходовано 14,70 мл раствора кислоты (при использовании бюретки емкостью 25 мл).
Нормальная концентрация раствора серной кислоты:
1000 • 0,5122 • 15 / 52,99 • 100 • 14,7 = 0,09860 н.
При установлении концентрации серной или соляной кислот по тетраборату натрия (буре) обычно используют метод титрования навесок. Кристаллогидрат буры Na2B4O7•10H2O должен быть химически чистым и перед установлением по нему концентрации кислоты его подвергают перекристаллизации. Для перекристаллизации 50 г буры растворяют в 275 мл воды при 50—60°C; раствор фильтруют и охлаждают до 25—30°C. Энергично помешивая раствор, вызывают кристаллизацию. Кристаллы отфильтровывают на воронке Бюхнера, растворяют снова и перекристаллизовывают. После фильтрования кристаллы сушат между листами фильтровальной бумаги при температуре воздуха 20°C и относительной влажности воздуха 70%; сушку проводят на воздухе или в эксикаторе над насыщенным раствором хлорида натрия. Высушенные кристаллы не должны прилипать к стеклянной палочке.
Для титрования отбирают в бюкс поочередно 3—4 навески буры с точностью до 0,0002 г и переносят их в конические колбы для титрования, растворяя каждую навеску в 40—50 мл теплой воды при энергичном взбалтывании. После перенесения каждой навески из бюкса в колбу бюкс взвешивают. По разности масс при взвешивании определяют величину каждой навески. Величина отдельной навески буры для установления концентрации 0,1 н. раствора кислоты при применении бюретки емкостью 50 мл должна быть около 0,5 г.
Титрование растворов буры кислотой ведут в присутствии 1—2 капель 0,1%-ного раствора метилового красного до изменения желтой окраски раствора в оранжево-красную или в присутствии раствора смешанного индикатора, состоящего из метилового красного и метиленового синего.
Нормальную концентрацию раствора кислоты рассчитывают по формуле:
где mн — масса навески буры, г;
V — объем раствора кислоты, израсходованный на титрование, мл.
Пример 6. Рассчитать навеску буры для установления концентрации 0,1 н. раствора соляной кислоты методом титрования навесок при применении бюретки емкостью 25 мл.
На титрование предполагается израсходовать 15 мл раствора кислоты.
Масса навески буры:
190,69 • 0,1 • 15 / 1000 = 0,3 г.
Пример 7. Найти концентрацию раствора соляной кислоты, если для титрования навески буры в 0,4952 г израсходовано 24,38 мл соляной кислоты.
1000 • 0,4952 / 190,624,38 = 0,1068
Установление концентрации кислоты по раствору едкого натра или едкого кали проводят путем титрования раствором кислоты раствора щелочи в присутствии 1—2 капель 0,1%-ного раствора метилового оранжевого. Однако этот метод установления концентрации кислоты менее точный, чем приведенный выше. Его обычно используют при контрольных проверках концентрации кислот. В качестве исходного раствора часто пользуются раствором щелочи, приготовленным из фиксанала.
Нормальную концентрацию раствора кислоты N2 рассчитывают по формуле:
где N1 — нормальная концентрация раствора щелочи;
V1 — объем раствора щелочи, взятый для титрования;
V2 — объем раствора кислоты, израсходованный на титрование (средняя величина сходящихся результатов титрования).
Пример 8. Определить концентрацию раствора серной кислоты, если на титрование 25,00 мл 0,1000 н. раствора едкого натра израсходовано 25,43 мл раствора серной кислоты.
Источник
Опыт 2. Приготовление приблизительной концентрации (0,1 н) серной кислоты разбавлением концентрированного раствора
Для выполнения опыта необходимы серная кислота, дистиллированная вода, мерные цилиндры объемом 250 мл и 10 мл, мерная колба объемом 250 мл, ареометр, склянка с этикеткой для хранения приготовленного раствора.
Необходимо получить у преподавателя или лаборанта раствор серной кислоты в цилиндре объемом 250 мл, опустить в кислоту сухой ареометр и, следя за тем, чтобы он не прикасался к стенкам цилиндра, измерить плотность раствора.
Пользуясь табл. 1 (с.50), определить процентное содержание кислоты, соответствующее найденной плотности раствора.
На основании полученных данных рассчитать объем серной кислоты, требуемой для приготовления 250 мл приблизительно 0,1 н раствора этой кислоты.
Пример расчета.
Молярная масса H2SO4 равна 98 г/моль.
Эквивалентная масса H2SO4 равна 49 г/моль.
Для приготовления 250 мл 0,1 н раствора надо взять 4,9:4 = 1,225 г серной кислоты, исходя из концентрированного раствора серной кислоты. Допустим, плотность раствора (r), измеренная ареометром, равна 1,715 г/мл. Это соответствует по таблице 78,93 % серной кислоты. Следовательно, в 100 г такого раствора содержится 78,93 г чистой серной кислоты.
Необходимо вычислить, в какой массе этого раствора содержится нужное число граммов (1,225 г) H2SO4:
78,93 г H2SO4 содержится в 100 г раствора,
1,225 г H2SO4 содержится в Х г раствора.
Отсюда 
Взвешивать раствор серной кислоты трудно, поэтому пересчитывают массу его на объем по формуле
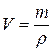
где m – масса раствора, г; r – плотность раствора, г/мл.
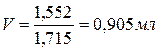
Рассчитанный объем кислоты отмерить маленьким мерным цилиндром и перенести в мерную колбу на 250 мл, куда предварительно налить небольшое количество воды (кислоту льют в воду!).
Дистиллированной водой дополнить мерную колбу до метки, тщательно перемешать полученный примерно 0,1 н раствор серной кислоты, перелить в склянку с этикеткой (фамилия, группа, название вещества и его концентрация) и оставить для опыта 2 в лабораторной работе № 7.
Вопросы для самоконтроля и повторения
1. Понятия раствор и растворимость.
2. Понятия гидраты, сольваты, гидратация и сольватация.
3. Дать определение концентрации растворов.
4. Способы выражения весовой концентрации.
5. Способы выражения объемной концентрации.
Лабораторная работа № 7
Определение точной концентрации растворов
Цель работы:
1. Освоить методику определения точной концентрации раствора методом титрования (опыты 1, 2).
2. Познакомится с фотоколориметрическим методом определения точной концентрации раствора (опыт 3).
Опыт 1. Определение точной концентрации раствора гидроксида
Натрия методом титрования
Для выполнения опыта необходимы бюретка, воронка, коническая колба для титрования, пипетка вместимостью 10 мл, резиновая груша, раствор гидроксида натрия приблизительно 0,1 н, фенолфталеин, дистиллированная вода, раствор щавелевой кислоты (приготовленный в предыдущей лабораторной работе).
Для определения точного значения титра раствора NaOH используют приготовленный в предыдущем опыте раствор щавелевой кислоты с известным титром. Определение проводят методом титрования. Титрование осуществляют путем прибавления исследуемого раствора гидроксида натрия приблизительно 0,1 н концентрации к определенному количеству щавелевой кислоты с индикатором. Порядок работы следующий. Тщательно вымытую бюретку ополаскивают небольшими порциями рабочего раствора NaOH для удаления оставшейся на стенках воды. С помощью воронки заполняют бюретку раствором гидроксида натрия приблизительно 0,1 н концентрации несколько выше нулевого деления. Удаляют пузырьки воздуха из «носика» бюретки. Убирают воронку и выпускают лишний раствор щелочи, устанавливая нижний край мениска жидкости на нулевом делении.
Вымытую коническую колбу для титрования ополаскивают дистиллированной водой, отмеряют в нее с помощью резиновой груши 10 мл раствора щавелевой кислоты и прибавляют 1…2 капли фенолфталеина.
На основание штатива положите лист белой бумаги. Колбу для титрования с 10 мл раствора щавелевой кислоты подставляют под бюретку и приступают к титрованию. Раствор гидроксида натрия прибавляют из бюретки по каплям, при постоянном перемешивании, до появления от одной капли розового окрашивания, которое не исчезает в течение 1 минуты. Повторяют титрование трижды, каждый раз отмеряя по 10 мл раствора щавелевой кислоты. Разница между отсчетами не должна превышать 0,1 мл. Объем гидроксида натрия, израсходованного на титрование, записывают в тетрадь, для расчета берут среднее арифметическое из трех близких значений. Титр раствора гидроксида натрия ТNaOH рассчитывают по формуле
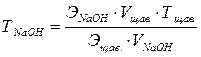
где ЭNaOH – моль-эквивалент гидроксида натрия (40 г/моль);
Эщав. – моль-эквивалент щавелевой кислоты (63 г/моль);
Тщав. – титр щавелевой кислоты (см. лаб. работу № 6);
Vщав. – объем щавелевой кислоты (10 мл);
VNaOH – объем гидроксида натрия, израсходованного на титрование.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Источник



