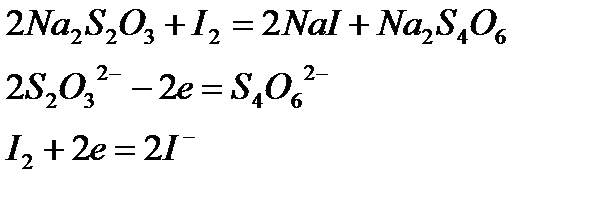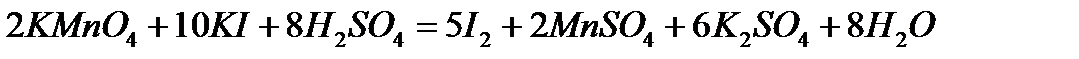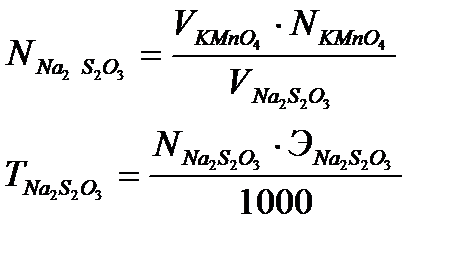Приготовление индикаторов
1. Метиловый красный — 0,2%-ный раствор (метилрот; диметиламиноазобензол-о-карбоновая кислота). Реактив представляет собой блестящие темно-фиолетовые кристаллы или красно-бурый порошок. В воде нерастворим; растворим в спирте. Переход окраски от красной к желтой наступает в интервале pH 4,2-6,2.
0,2 г индикатора растворяют в 60 мл спирта и добавляют 40 мл воды.
2. Метиловый оранжевый — 0,1%-ный раствор (метилоранждиметиламиназобензол сульфонат натрия) — оранжево-желтый порошок или листочки. Нерастворим в спирте, легкорастворим в горячей воде.
Переход окраски от красной к желтой в интервале pH 3,0-4,4. 0,1 г индикатора растворяют в 100 мл воды.
3. Фенолфталеин — 1%-ный раствор. Мелкокристаллический порошок белого (или слегка кремового цвета) растворяется в спирте и нерастворим в воде. Переход окраски от бесцветной к красной в интервале pH 8,2-10,0. 1 г индикатора растворяют в 100 мл 96%-ного спирта.
4. Бромфеноловый синий — 0,1%-ный раствор (тетрабромфенолсульфофталеин) — мелкие, почти бесцветные или бледно-розовые кристаллы, плохо растворимые в воде; растворяются в этиловом спирте и в серном эфире. В растворах щелочей и аммиака растворяются с синим окрашиванием.
100 мг индикатора растирают в фарфоровой ступке с 1,5 мл 0,1 н. раствора едкого натра, постепенно прибавляют прокипяченную дистиллированную воду. В мерной колбе раствор доводят прокипяченной дистиллированной водой до 100 мл.
5. 10%-ный раствор хромовокислого калия (K2CrO4). 10 г реактива отвешивают с точностью до 0,01 г и растворяют в 90 мл дистиллированной воды.
6. 1%-ный раствор крахмала. 1 г растворимого крахмала растирают в ступке с небольшим количеством холодной воды, полученную кашицу выливают в 100 мл кипящей дистиллированной воды. Кипятят, пока раствор не станет прозрачным.
Источник
Раствор крахмала с массовой долей 1%
8.2.11 Раствор крахмала с массовой долей 1%
Навеску 1,0 г крахмала растворяют примерно в 20 см 3 обессоленной воды и вливают полученный раствор в 80 см 3 кипящей обессоленной воды. Реактив хранят в склянке из темного стекла. Срок хранения раствора 2 суток.
Словарь-справочник терминов нормативно-технической документации . academic.ru . 2015 .
Смотреть что такое «Раствор крахмала с массовой долей 1%» в других словарях:
Раствор — Однофазная система, состоящая из растворенного вещества, растворителя и продуктов их взаимодействия Источник … Словарь-справочник терминов нормативно-технической документации
МУ 08-47/225: Воды производственные тепловых электростанций. Фотометрический метод определения массовой концентрации гидразина — Терминология МУ 08 47/225: Воды производственные тепловых электростанций. Фотометрический метод определения массовой концентрации гидразина: 8.2.14 Приготовление раствора сульфаминовой кислоты с массовой долей 5 % Навеску 5,0 г сульфаминовой… … Словарь-справочник терминов нормативно-технической документации
Подготовка — 5. Подготовка* Преобразование принятых сигналов согласно настоящему стандарту в форму, которая позволяет измерять, обрабатывать или выдавать информации (например усиление, преобразование в код) Источник … Словарь-справочник терминов нормативно-технической документации
Подготовка к анализу — 2.3. Подготовка к анализу 2.3.1. Приготовление 0,1 н раствора серноватистокислого натрия 25 г тиосульфата натрия Na2S2O3 · 5H2O растворяют в свежепрокипяченной и охлажденной дистиллированной воде, добавляют 0,2 г углекислого натрия (Nа2СО3) и… … Словарь-справочник терминов нормативно-технической документации
Аппаратура, реактивы и растворы — 6.2. Аппаратура, реактивы и растворы Весы по ГОСТ 29329 или ГОСТ 24104. Фотоколориметр ФЭК 56М или спектрофотометр СФ 4, или другие аналогичные приборы. Цилиндры стеклянные вместимостью 250 см3 из прозрачного бесцветного стекла (внутренний… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 30054-2003: Консервы, пресервы из рыбы и морепродуктов. Термины и определения — Терминология ГОСТ 30054 2003: Консервы, пресервы из рыбы и морепродуктов. Термины и определения оригинал документа: [ морепродуктов ]: Соленый продукт из рыбы [морепродуктов], содержащий рыбы не менее 65 % (морепродуктов 55 %) массы нетто, с… … Словарь-справочник терминов нормативно-технической документации
Энергоносители — (Energy) Понятие энергоносителей, виды энергоносителей Понятие энергоносителей, виды энергоносителей, альтернативные энергоносители Содержание Содержание Природний газ Торф Ядерное томливо против черного золота Альтернативные Топливные брикеты… … Энциклопедия инвестора
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
СССР. Естественные науки — Математика Научные исследования в области математики начали проводиться в России с 18 в., когда членами Петербургской АН стали Л. Эйлер, Д. Бернулли и другие западноевропейские учёные. По замыслу Петра I академики иностранцы… … Большая советская энциклопедия
Источник
Как приготовить 1 крахмал для титрования
Приготовление растворов индикаторов
и вспомогательных реактивов
Учителю химии и студенту на педагогической практике часто приходится готовить растворы индикаторов и вспомогательных реактивов. Порой на это уходит достаточно много времени; прописи по их приготовлению не всегда подходят для школьных условий. В связи с этим предлагаем ряд простых, безопасных и доступных рецептов, которые мы с успехом применяем в школе и на практических занятиях по методике преподавания химии.
1. Приготовление раствора метилового оранжевого. Отвесьте примерно 0,1 г индикатора и растворите его в 100 мл теплой дистиллированной воды. Окраска в кислой среде – красная, в щелочной – желтая, в нейтральной – оранжевая.
2. Приготовление раствора лакмоида (резорциновый синий). Отвесьте примерно 0,5 г индикатора и растворите в 100 мл раствора этанола с массовой долей спирта равной 80-90%. Окраска в кислой среде – красная, в щелочной – синяя, в нейтральной – фиолетовая.
3. Приготовление раствора фенолфталеина. Отвесьте около 0,5 г индикатора (можно взять лекарственную форму) и растворите в 100 мл раствора этанола с массовой долей спирта равной 50-60%. Окраска в кислой среде – бесцветная, в щелочной – малиновая, в нейтральной – бесцветная.
4. Приготовление раствора крахмала. Вскипятите 100 мл воды, добавив в нее предварительно чайную ложку поваренной соли. В фарфоровой чашке разотрите немного крахмала (1-2 г) с небольшим объемом воды (10-20 мл) до получения однородной жидкой массы. Полученную смесь вылейте в кипящий раствор соли и при перемешивании доведите его вновь до кипения. Когда жидкость станет прозрачной, добавьте в колбу еще 100 мл воды и охладите. Лучше всего хранить раствор на холоду в темной склянке. Соль в растворе увеличивает срок хранения раствора крахмала, который обычно быстро портится и плесневеет. Раствор крахмала используют как индикатор для обнаружения свободного иода, в присутствии которого появляется синяя окраска.
5. Приготовление иодкрахмального раствора. К раствору крахмала (см. рецепт 4) объемом 100 мл добавьте иодид калия массой примерно 0,5 г и перемешайте до растворения соли. Полученный раствор используется для обнаружения сильных окислителей, при взаимодействии с которыми выделяется свободный иод, дающий с крахмалом синее окрашивание.
6. Приготовление раствора ацетата свинца. В 100 мл воды, подкисленной 2-3 мл уксусной кислоты (во избежание гидролиза соли) растворите 1-2 г ацетата свинца. Полученный раствор используют для качественного определения сероводорода и сульфидов, в присутствии которых образуется черный осадок сульфида свинца.
7. Приготовление индикаторных бумажек. Нарежьте фильтровальную бумагу (лучше всего подойдет бумага невысокой плотности) на полоски шириной 4-5 см и длиной 8-10 см, смочите их в одном из полученных растворов (см. рецепты 1-6) и высушите в помещении свободном от аммиака, паров кислот и других летучих веществ. После высыхания разрежьте бумажки на мелкие полоски и поместите в закрывающиеся склянки с этикетками.
8. Приготовление индикаторной бумаги для обнаружения паров ртути в воздухе. Если в помещении была разлита ртуть или разбился ртутный термометр (градусник) следует провести анализ воздуха на содержание в нем паров ртути. Качественную пробу можно выполнить с помощью специальной индикаторной бумажки. Предварительно приготовьте растворы сульфата или хлорида меди ( II ) с массовой долей соли 5%, иодида калия (10%), сульфита натрия (2%).
Нарежьте полоски фильтровальной бумаги малой плотности (черная или белая лента) длиной 8-10 см и шириной 4-5 см и окуните их на несколько секунд в раствор соли меди. Дайте избытку жидкости стечь, слегка подсушите и окуните в раствор иодида калия. Бумага побуреет вследствие выделения иода, а в порах фильтра осадится иодид меди ( I )
Вновь дайте избытку раствора стечь и подсушите бумажку. Для удаления иода опустите бумажку в раствор сульфита натрия. Как только бурая окраска исчезнет, окуните несколько раз бумажку в чистую воду (для удаления всех растворимых веществ). Приготовленную таким образом бумажку (содержит в порах CuI ) высушите и сохраните в закрытых склянках.
Анализ основан на взаимодействии паров ртути и иодида меди ( I ) с образованием комплексного соединения Cu 2 [ HgI 4 ] красного цвета. Для проведения анализа бумажки оставляют в помещении на 5-6 часов на открытом месте. Если бумага не порозовеет, то содержание ртути в воздухе не превышает предельно допустимую концентрацию. Если же бумажка окрасится в розовый цвет, то есть основание для вызова санитарной службы и проведения более точных количественных исследований.
9. Приготовление хлорной воды (раствора хлора в воде). Можно получать хлорную воду традиционным способом, пропуская газообразный хлор через воду. Однако в учебных целях проще и безопаснее готовить раствор иначе. Налейте в колбу 10-20 мл раствора бытового хлорсодержащего отбеливающего средства (Белизна), разбавьте его водой в 2 раза и добавьте (осторожно!) несколько капель концентрированной соляной кислоты. Выделяющийся хлор насыщает исходный раствор, который в результате приобретает свойства хлорной воды. Раствор используют для учебных целей при демонстрации свойств хлора.
10. Получение бромной воды (раствора брома в воде). Можно получать бромную воду традиционным способом, насыщая воду жидким бромом. Однако в учебных целях проще и безопаснее готовить раствор иначе. К раствору бромида калия или натрия (50 мл; 5%) добавьте 2-3 мл хлорной воды. Выделяющийся бром растворяется в исходном растворе, в результате он приобретает свойства бромной воды, которые можно с успехом демонстрировать в учебном эксперименте.
11-12. Получение иодной воды (раствора иода в воде). Несколько капель аптечной иодной настойки растворите в 50 мл воды до получения раствора желто-соломенного цвета.
К раствору иодида калия или натрия (50 мл; 5%) добавьте 2-3 мл хлорной воды. Выделяющийся иод растворяется в исходном растворе, в результате он приобретает свойства иодной воды, которые можно с успехом демонстрировать в учебном эксперименте.
13. Получение сероводородной воды. Можно получать сероводородную воду традиционным способом, насыщая воду газообразным сероводородом. Однако в учебных целях проще и безопаснее готовить раствор иначе. Поместите в колбу Вюрца несколько кусочков сульфида железа, залейте его разбавленным раствором (2-5%) соляной кислоты. Газоотводную трубку соедините с промывалкой (5% CuSO 4 ) для дегазации избытка сероводорода и оставьте на ночь в вытяжном шкафу. На следующий день слейте прозрачную жидкость, которая обладает свойствами сероводородной воды и вполне пригодна для учебного эксперимента.
14. Получение известковой воды (раствор гидроксида кальция в воде). Растворимость гидроксида кальция в воде составляет всего 0,165 г вещества в 100 г воды. Готовят известковую воду, используя гашеную или негашеную известь.
Однако удобнее готовить раствор из металлического кальция. Добавьте к воде объемом 500 мл в колбе кусочек кальция массой около 1 г, закройте колбу, в которой проводите реакцию, ватным тампоном, смоченным разбавленным раствором щелочи, и оставьте на несколько часов. После того, как реакция закончится, и избыток гидроксида осадится, слейте прозрачный раствор в заранее приготовленный плотно закрывающийся сосуд. Известковая вода на воздухе быстро карбонатизируется вследствие взаимодействия гидроксида кальция с углекислым газом воздуха, поэтому перед ее использованием необходимо провести соответствующую проверку.
Не забывайте снабжать каждый приготовленный реактив соответствующей этикеткой с указанием даты приготовления.
Источник
Приготовление раствора крахмала
Лабораторная работа №13
Тема:Приготовление и стандартизация раствора натрий тиосульфата
Цель работы:научиться приготавливать раствор натрий тиосульфата и стандартизировать его.
Рассмотрим окислительно-восстановительные процессы в реакции между 

Т.к. два иона 
Вычислить нормальность приготовленного раствора тиосульфата натрия по навеске его нельзя вследствие того, что кристаллы тиосульфата на воздухе выветриваются и поэтому химический состав их не всегда соответствует формуле 
Методика выполнения лабораторного исследования
и оформление отчета:
Приготовление рабочего раствора тиосульфата натрия
Расчет навески тиосульфата натрия m Na2S2O3 г, для приготовления 150 мл 0,05 н. раствора:

Навеску взвешивают на технохимических весах, затем пересыпают в стакан и растворяют в 150 мл дистиллированной воды.
Приготовление раствора крахмала
0,5 г растворимого крахмала тщательно взбалтывают в небольшом количестве холодной воды, смесь вливают тонкой струей в 100 мл кипящей воды, хорошо размешивают и кипятят 1-2 мин. Прибавляют 1г салициловой кислоты или хлорида цинка. После охлаждения раствор готов к употреблению.
Раствор крахмала хранят в колбе, закрытой ватой. Он должен быть однородным, без комков. Правильно приготовленный раствор крахмала должен давать синее окрашивание с 2-3 капли 0,01 н. раствора иода. Коричнево-бурая окраска раствора служит признаком разложения крахмала. Такой крахмал непригоден к употреблению.
3. Определение нормальности раствора тиосульфата натрия по титрованному раствору перманганата калия.
В три конические колбы для титрования отмеряют пипеткой 20 мл титрованного раствора перманганата калия, затем отмеривают мерным цилиндром в каждую колбу по 30 мл 2н раствора серной кислоты и 15 мл 10% раствора КI.
Смесь выдерживают 2-3 минуты, после чего добавляют 100-150 мл воды и титруют раствором тиосульфата натрия, помещенного в бюретку, сначала без индикатора до получения бледно-желтой окраски раствора, а затем, добавив 2-3 мл раствора крахмала, до полного обесцвечивания раствора.
Полученные результаты оформите в виде таблицы:
| N KMnO4 | V KMnO4 (мл) | V Na2S2O3 (мл) | Vср Na2S2O3 (мл) |
где VKMnO4 – объем раствора калий перманганата, взятый на титрование, мл,
NKMnO4 – нормальность раствора калий перманганата, моль/дм 3 ,
1. Опишите роль KMnO4 в данной реакции.
2. Укажите, в какой среде ведется определение тиосульфата натрия, и рассчитайте молярную массу эквивалента KMnO4 в данной среде.
3. Объясните, почему раствор тиосульфата натрия готовят приблизительной концентрации?
4. Составьте уравнение химической реакции, лежащей в основе данного определения.
5. Рассчитайте молярную массу эквивалента тиосульфата натрия и объясните результат.
6. Сделайте вывод о возможном применении метода оксидиметрии в пищевой промышленности
7. Проанализируйте результаты титрования и сделайте заключение о погрешности титрования.
1. Ольшанова, К. М. Аналитическая химия: учебник / К. М. Ольшанова, С. К. Пискарёва, К. М. Барашкова. – М.: Химия, 1990. – с.314-316.
2. Шапиро, М. А. Аналитическая химия: учебник / М. А. Шапиро, С. А. Шапиро. – М.: Высшая школа, 1979. – с.264-266.
Источник