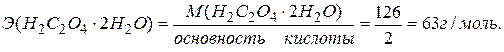- Опыт 1. Приготовление 0,1 н раствора щавелевой кислоты
- Как приготовить раствор кислоты из порошка
- Приготовление стандартного раствора щавелевой кислоты
- Лабораторные работы по теме: Окислительно-восстановительное титрование
- Описание
- Оглавление
- 1. Лабораторная работа. Метод перманганатометрии
- Метод перманганатометрии
- Оглавление
- Теоретическая часть
- Экспериментальная часть
- 1. Приготовление раствора KMnO4
- 2. Приготовление стандартного раствора щавелевой кислоты
- 3. Стандартизация раствора KMnO4 по щавелевой кислоте
Опыт 1. Приготовление 0,1 н раствора щавелевой кислоты
С помощью точной навески
Для выполнения опыта необходимы щавелевая кислота кристаллическая, дистиллированная вода, торсионные весы, мерная колба вместимостью 50 мл, воронка, склянка с этикеткой для хранения приготовленного раствора.
Для приготовления раствора щавелевой кислоты определенной концентрации необходимо рассчитать величину навески кристаллической щавелевой кислоты, которую нужно взять с учетом объема мерной колбы и заданной концентрации раствора.
Объем мерной колбы равен 50 мл. Концентрация раствора щавелевой кислоты равна 0,1 н.
Согласно определению, нормальная концентрация определяется числом моль-эквивалентов растворенного вещества, содержащимся в 1 л раствора. Следовательно, для приготовления 0,1 н раствора необходимо взять 0,1 моль-эквивалент щавелевой кислоты в 1 л раствора.
Моль-эквивалент щавелевой кислоты равен
0,1 моль-эквивалент щавелевой кислоты составляет 63 . 0,1 = 6,3 г.
Для приготовления 0,1 н раствора объемом не 1 л, а 50 мл, навеску щавелевой кислоты нужно уменьшить в 20 раз, т.е. 6,3:20 = 0,315 г. Следовательно, для приготовления 50 мл 0,1 н раствора щавелевой кислоты требуется навеска кислоты 0,315 г.
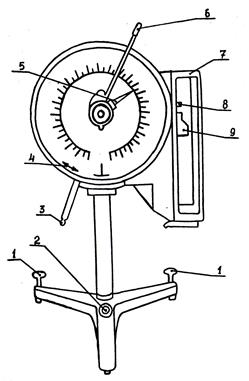
Взвешивание проводят с помощью торсионных весов (рис.2).
Перед взвешиванием необходимо подготовить весы к работе. Для этого освободите коромысло 8 передвижением вправо рычага 3. Передвижением поводка 6 установите отчетную стрелку 5 на нулевое деление шкалы циферблата. Вращением тарировочной рукоятки, находящейся на задней стенке весов, совместите контрольную стрелку 4 с контрольным штрихом циферблата. Закрепите коромысло передвижением влево рычага 3.
Взвешивание проводят в таком порядке:
§ откройте крышку, поместите на чашечку взвешиваемую пробу (образец), закройте крышку;
§ освободите коромысло передвижением рычага вправо;
§ плавно поворачивая поводок против часовой стрелки, совместите контрольную стрелку с контрольным штрихом циферблата, после чего запишите показания отсчетной стрелки;
§ закрепите коромысло передвижением рычага влево, откройте крышку, снимите с чашки взвешиваемую пробу (образец), закройте крышку, переведите отсчетную стрелку в нулевое положение.
|
 |
Навеску щавелевой кислоты путем встряхивания пересыпают через сухую воронку в мерную колбу объемом 50 мл. Тщательно обмывают внутреннюю поверхность воронки струей дистиллированной воды. Осторожно взбалтывают колбу круговыми движениями до полного растворения навески. После этого в колбу доливают дистиллированную воду до метки, добавляя последние порции воды по каплям, пока нижняя часть мениска жидкости не коснется метки.
Закрывают колбу и тщательно перемешивают раствор. Приготовленный раствор переливают в чистую склянку, предварительно ополоснув ее небольшим количеством приготовленного раствора щавелевой кислоты. На склянку наклеивают этикетку с указанием титра раствора, фамилии студента и номера учебной группы. Титр щавелевой кислоты вычисляют делением навески (г) на объем раствора (мл) по формуле (8). Приготовленный раствор щавелевой кислоты используют в опыте 1 лабораторной работы № 7. (по старому 4)
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Источник
Как приготовить раствор кислоты из порошка
Здравствуйте!
мне нужно приготовить 5% раствор щавелевой кислоты, сейчас она у меня в виде порошка.
правильно ли я понял, что для приготовления 1 литра надо тупо взять 0.95 л. дистилированной воды и 50 грамм порошка?
п. с. на мешке написано «Щавелевая кислота, 2-водная».
Чтобы правильно приготовить 5%-ный раствор, нужно сделать поправку на кристаллизационную воду в препарате. Составляется такая пропорция:
5 г Н2С2О4 —————90 г/моль
Х г Н2С2О4*2Н2О——126 г/моль
Отсюда Х = 5*126/90 = 7 г.
Нужно взвесить 7 г кристаллогидрата и добавить 93 г воды, или 70 г + 930 г воды. Естественно, объём будет меньше 1 л, т. к. плотность такого раствора — больше 1
Неправильно. Молекулы кислоты связываются с молекулами воды и объем раствора почти не увеличивается. Поэтому литр там не получится, я гарантирую это.
В общем правильно. Но если быть точнее, надо учитывать и химически связанную воду.
ну примерно так правильно поняли
5% раствор — это на литр 50 грамм порошка.
5% — это 950 грамм воды и 50 грамм кислоты.
Почему не 50 грамм на литр? И не 50 грамм, доведенные водой до литра? Да потому, что это МАССОВАЯ ДОЛЯ! ! А не объемная концентрация.
Кстати, щавелевая кислота обладает какой-никакой гигроскопичностью, так что если нужна точная концентрация, лучше титрануть потом.. .
А если это дигидрат, как совершенно верно указал Вячеслав, то это будет не 50 грамм, а аж 70! На 930 г воды.
Источник
Приготовление стандартного раствора щавелевой кислоты



Точную концентрацию приготовленного раствора гидроксида натрия устанавливают прямым титрованием аликвотной части стандартного раствора щавелевой кислоты, используя для отбора пробы стандарта способ пипетирования.
Для приготовления стандартного раствора щавелевой кислоты используют мерную колбу на 250 мл, для отбора пробы стандартного раствора – пипетку на 10 мл. Бюретка (Vбюр.= 25 мл) заполняют рабочим раствором щелочи.
Расчет навески щавелевой кислоты ведут по формуле:
Vбюр.(NaOH) = 20 мл (оптимальный объем)
Методика приготовления: Рассчитанную навеску щавелевой кислоты берут на аптечных весах, пересыпают в бюкс и взвешивают на аналитических весах. Аккуратно переносят навеску через сухую воронку в мерную колбу на 250 мл, растворяют в дистиллированной воде, доводят объем раствора до метки, закрывают пробкой и тщательно перемешивают. Затем взвешивают пустой бюкс и по разности определяют величину точной навески щавелевой кислоты.
Лабораторная работа № 3
Стандартизация рабочего раствора гидроксида натрия
По щавелевой кислоте
Точную концентрацию рабочего раствора гидроксида натрия устанавливают прямым титрованием аликвотной части стандартного раствора. В основе титрования лежит реакция:
рН в точке эквивалентности равен 9. Следовательно, для фиксирования точки конца титрования подходит индикатор фенолфталеин.
1. Бюретку споласкивают и заполняют приготовленным раствором щелочи.
2. В колбу для титрования отмеривают пипеткой 10 мл стандартного раствора щавелевой кислоты, добавляют 1-2 капли фенолфталеина и титруют раствором щелочи до появления слабо розовой окраски, не исчезающей в течение 15 секунд.
3. Титрование аликвотной части стандартного раствора повторяют 3-5 раз.
4. По результатам титрований рассчитывают точную концентрацию раствора щелочи и Kn:
Vбюр.(NaOH) — объем щелочи, пошедший на титрование аликвотной части стандартного раствора (мл).
5. Все результаты сводят в таблицу протокола.
Лабораторная работа № 4
Определение массы хлороводородной кислоты
В растворе
Определение проводят прямым титрованием, отбор пробы анализируемого раствора – способ пипетирования.
Реакция, лежащая в основе титрования:
HCl + NaOH ® NaCl + H2O
Точку конца титрования фиксируют, используя в качестве индикатора фенолфталеин (обоснуйте выбор индикатора!).
fэк(HCl) = 1; Mэк(HCl) = M(HCl) = 36,46 г/моль
1. Полученную задачу в мерной колбе на 100 мл разбавляют дистиллированной водой, доводят объем до метки, закрывают пробкой, тщательно перемешивают.
2. Бюретку заполняют рабочим титрованным раствором щелочи.
3. В колбу для титрования отбирают пипеткой 10 мл раствора хлороводородной кислоты, добавляют 1-2 капли фенолфталеина и титруют до появления слабо розовой окраски, не исчезающей в течение 15 секунд.
4. Титрование аликвотной части раствора задачи повторяют 3- 5 раз.
5. По результатам титрований рассчитывают массу хлороводородной кислоты в анализируемом растворе:

6. Результаты сводят в таблицу протокола.
7. Найденное значение массы хлороводородной кислоты проверяют у преподавателя, рассчитывают абсолютную и относительную ошибку определения.
Источник
Лабораторные работы по теме: Окислительно-восстановительное титрование
| Сайт: | Информационно-образовательная среда |
| Курс: | Аналитическая химия |
| Книга: | Лабораторные работы по теме: Окислительно-восстановительное титрование |
| Напечатано:: | Гость |
| Дата: | Пятница, 8 Октябрь 2021, 17:04 |
Описание
Оглавление
1. Лабораторная работа. Метод перманганатометрии
Метод перманганатометрии
Оглавление
Теоретическая часть
Методы окисления-восстановления — титриметрические методы, основанные на использовании реакций окисления-восстановления. К основным достоинствам методов относятся: большая точность, хорошая воспроизводимость, простота и экспрессность, широкий спектр применения, возможность автоматизации и др.
Методы окисления-восстановления классифицируются в зависимости от титранта (стандартного раствора). Например: метод, основанный на окислении перманганатом калия, называют перманганатометрией; на окислении иодом — иодометрией; Cr (VI) — хроматометрией и т.д.
В процессе титрования по методу окисления-восстановления происходит изменение окислительно-восстановительных потенциалов реагируюших веществ.
Для обратимой редокс системы, выражаемой уравнением
а Окисл + nē ↔ b Восст ,
величина окислительно-восстановительного потенциала Е определяется уравнением
Е = Е 0 + (R T/ nF) ln ([Окисл] а / [Восст] b ),
где Е — окислительно-восстановительный потенциал, В; Е 0 — стандартный окислительно-восстановительный потенциал, В; R — универсальная газовая постоянная, равная 8,31 Дж/(моль∙К); Т — абсолютная температура, К; n — число электронов, участвующих в реакции; F — число Фарадея, равное 96 500 Кл; [Окисл]- концентрация окисленной формы, моль/л; [Восст]- концентрация восстановленной формы, моль/л.
Если в реакции принимают участие H + -ионы, то значение Е зависит от [Н + ]:
Е = Е 0 + (R T/ nF) ln ([Окисл] а [Н + ] m / [Восст] b )
Если заменить константы их числовыми значениями и перейти от ln к lg, то при T = 298 К ( 25 °C ) уравнение примет вид
Е = Е 0 + (0,059/n) lg ([Окисл] а [Н + ] m /[Восст] b ).
Таким образом, потенциал окислительно-восстановительной системы зависит от природы реагирующих веществ (Е 0 ), температуры, концентрации окисленной и восстановленной форм, а также концентрации H + -ионов.
При 25 °C коэффициент 0,059; при 30 °C — 0,060, т.е. температура не очень сильно влияет на потенциал. Более существенно влияние температуры на энергию активации, скорость и механизм окислительно-восстановительной реакции. Бывают реакции, когда H + -ионы в реакции не участвуют, а pH влияет на потенциал системы.
Значения стандартных окислительно-восстановительных потенциалов приведены в справочных таблицах.
Окислитель — вещество с большим значением Е 0 . Меняя соотношение концентраций окисленной и восстановленной форм, а также концентрацию H + -ионов, можно изменять Е в широких пределах, а, следовательно, направить реакцию в нужную нам сторону.
В ряде случаев окислительно-восстановительного титрования точку эквивалентности фиксируют по изменению окраски титруемого раствора, вызываемой избытком окрашенного стандартного раствора. Кроме того, могут быть использованы в методах окисления-восстановления так называемые ред-окс-индикаторы, которые изменяют окраску в зависимости от величины Е. Наиболее широко для фиксирования точки эквивалентности применяют физико-химические методы.
В качестве стандартного раствора в перманганатометрии применяют раствор KMnO4, который обладает наиболее высокой окислительной активностью в кислой среде (Е = +1,51 В).
Метод перманганатометрии используют для определения восстановителей (прямое титрвание), окислителей (обратное титрование) и веществ, не обладающих окислительно-восстановительными свойствами, но которые могут быть переведены путем химических реакций в другие соединения, участвующие в окислительно-восстановительных реакциях (заместительное титрование).
Экспериментальная часть
Цель работы: Познакомиться на практике с методом окислительно-восстановительного титрования.
1. Приготовить раствор титранта KMnO4 приблизительной концентрации 0,02 моль/л.
2. Приготовить стандартный раствор щавелевой кислоты с молярной концентрацией эквивалента 0,02 моль/л в объеме 200 мл.
3. Провести стандартизацию раствора KMnO4 по щавелевой кислоте.
4. Определить содержание Fe (II) в растворе соли Мора методом перманганатометрии.
5. Определить окисляемость воды.
Приборы и реактивы:
весы технические и аналитические; штатив; стакан вместимостью 100 см 3 ; бюретка вместимостью 20 см 3 ; пипетки вместимостью 10 и 100 см 3 ; колбы мерные вместимостью 200, 250 и 500 мл; цилиндры мерные вместимостью 5 и 10 см 3 ; плитка; шпатель; часовое стекло; запаянные капилляры или кусочки битого фарфора;
KMnO4; H2C2O4∙2H2O, соль Мора, раствор H2SO4 с концентрацией 1 моль/л и 3 моль/л, дистиллированная вода.
1. Приготовление раствора KMnO4
Титрованный раствор перманганата калия нельзя приготовить растворением точной навески, так как реактив содержит ряд примесей.
Стандартизацию раствора перманганата калия устанавливают через 5-7 дней после приготовления. Исходным веществом для его стандартизации служит щавелевая кислота (H2C2O4∙2H2O). Реакция протекает по уравнению:
В реакции окисляются анионы C2O4 2- , теряя 2 электрона и превращаясь в две электронейтральные молекулы СО2. Mn(VІІ), наоборот, приобретая 5 электронов, восстанавливается до Mn(ІІ):
Очевидно, молярная масса эквивалента перманганата калия равна 1/5 молярной массы, т.е. 158,03/5 = 31,61 г/моль. Для приготовления 0,5 л раствора KMnO4 с молярной концентрацией эквивалента 0,02 моль/л рассчитывают навеску: 31,61∙0,02·0,5 = 0,3161 г Учитывая легкую восстанавливаемость KMnO4, увеличивают массу навески на 10 %.
Навеску KMnO4 переносят в стакан и приливают небольшие порции горячей воды, время от времени сливая жидкость с кристаллов в мерную колбу вместимостью 500 мл. Растворение ускоряют путем непрерывного перемешивания. Когда вся навеска перейдет в раствор, доливают объем до метки дистиллированной водой и тщательно перемешивают. Раствор переливают в склянку из темного стекла, закрывают пробкой и оставляют стоять 5 — 7 дней, после чего раствор фильтруют.
2. Приготовление стандартного раствора щавелевой кислоты
Рассчитывают навеску для приготовления 200 мл стандартного раствора щавелевой кислоты с молярной концентрацией эквивалента 0,02 моль/л. Молярная масса эквивалента H2C2O4·2H2O в рассматриваемой реакции равна 126,07/2 = 63 г/моль.
Рассчитанную навеску H2C2O4·2H2O взвешивают на аналитических весах, переносят в мерную колбу вместимостью 200 мл и растворяют при перемешивании в дистиллированной воде, доводя объем до метки. Вычисляют молярную концентрацию эквивалента стандартного раствора щавелевой кислоты.
3. Стандартизация раствора KMnO4 по щавелевой кислоте
Реакция взаимодействия перманганата калия со щавелевой кислотой протекает полностью только в кислой среде, является автокаталитической (катализатор – соль Mn(ІІ)). Скорость увеличивается при нагревании.
Заполняют бюретку раствором KMnO4 до нулевого деления. В три колбы для титрования отбирают по 10 мл раствора кислоты, предварительно ополоснув им пипетку. В каждую колбу прибавляют 10 мл раствора H2SO4 с концентрацией 1 моль/л. Содержимое одной из колб нагревают на плитке до 70 — 80 °С и горячий раствор титруют стандартным раствором KMnO4. Раствор титранта приливают медленно, по каплям, при непрерывном перемешивании. Каждую следующую каплю добавляют лишь после того, как обесцветилась предыдущая. Титрование прекращают, когда при добавлении избыточной капли титранта раствор приобретает бледно-малиновую, не исчезающую в течение 1 — 2 минут окраску.
Титрование повторяют 3 раза, находят средний объем, пошедший на титрование 10 мл раствора щавелевой кислоты. Результаты записывают в таблицу 1.
Источник