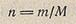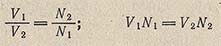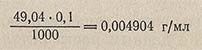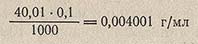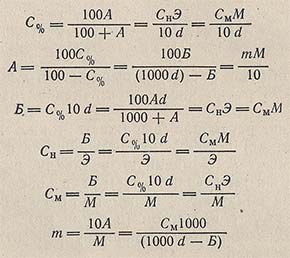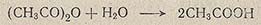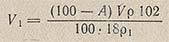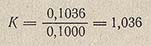- Мир науки
- Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
- Химия — рефераты, шпаргалки, семинары, конспекты, лекции
- Приготовление и стандартизация 0,1 М рабочего раствора щелочи
- Как приготовить 1 молярный раствор щелочи
- Приготовление раствора щёлочи.
- Приготовление растворов
- Способы выражения концентрации растворов
- Формулы перехода от одних выражений концентрации растворов к другим
- Растворимость
- Техника приготовления растворов
- Приготовление водных растворов кислот приблизительной концентрации
- Приготовление безводного раствора хлорной кислоты
- Приготовление растворов щелочей
- Приготовление водного раствора аммиака
- Приготовление рабочих растворов точной концентрации
Мир науки
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Химия — рефераты, шпаргалки, семинары, конспекты, лекции
Приготовление и стандартизация 0,1 М рабочего раствора щелочи
В методе нейтрализации в качестве растворов щелочей используют обычно 0,1 М раствор гидроксида натрия. Поскольку NaÜH энергично реагирует с СО2 воздуха, образуя на поверхности реактива карбонаты,
и является гигроскопичным, то его раствор готовят быстро, по приблизительной навеской.
а) Приготовление Около 0,1 М раствора NaOH
Для приготовления 1 л 0,1 М раствора гидроксида натрия навеска NaÜH должна быть 4 г ( m( NaÜH) = 0,1 • 40 • 1 = 4 г), но вместо рассчитанных 4 г NaÜH берут 5-6 г. Навеску взвешивают быстро на технохімічних весах в закрытом бюксі. После чего высыпают ее в стакан и ополаскивают 2-3 раза малыми порциями воды. Промытый едкий натр помещают в калибровочную на 1 л стакан, добавляют небольшое количество воды, а когда реактив полностью растворится, дают растворы остыть и доводят объем раствора дистиллированной водой до метки. Тщательно перемешивают и переливают в чистый стакан. Наносят маркировку (концентрация, дата).
б) Стандартизация приготовленного раствора NaOH
Стандартизации раствора NaÜH выполняют відстандартизованим рабочим раствором HCl или по 0,1 М раствором HCl, который приготовили из фіксаналу.
Для титрования сильной кислоты гидроксидом натрия можно выбрать любой индикатор, рН которого ближе всего подходит к рН = 7 (точка эквивалентности). В случае титрования сильных кислот щелочами (или наоборот) могут использоваться и метиловый оранжевый, и фенолфталеин.
Концентрация щелочи устанавливают быстрым титрованием 10 или 20 мл рабочего раствора HCl с метиловым оранжевым приготовленным раствором NaÜH до перехода цвета от красного через оранжевый до желтого от одной капли NaÜH (рН = 4,4). С фенолфталеином раствор HCl титруют от бесцветного до слабо розового окраса (рН = 9), которое не исчезает в течение 30 сек. Титрования повторяют не менее чем трижды; разница в измерении объема не должна превышать 0,03 мл. Пользуясь несколькими индикаторами (метиловый оранжевый, фенолфталеин), проверяют концентрацию раствора щелочи.
Источник
Как приготовить 1 молярный раствор щелочи
В химическом анализе часто применяют: 0,1 н. растворы едкого натра или едкого кали; реже — 0,5 н., 0,05 н. и 0,001 н. растворы этих щелочей, а также насыщенные растворы гидроокиси кальция и гидроокиси бария; спиртовый раствор едкого кали; 0,1 н. раствор соды; 0,1 н. раствор щелочной смеси, состоящей из равных объемов 0,1 н. растворов едкого натра и соды; водные растворы аммиака.
Для приготовления небольших количеств точных растворов едких щелочей могут быть использованы фиксаналы. Щелочные фиксаналы пригодны в течение определенного срока (до шести месяцев); очень старые щелочные фиксаналы могут быть неточными из-за загрязнения продуктами выщелачивания стекла. Растворы щелочей, приготовленные из фиксаналов, обычно применяют для проверки концентрации растворов кислот.
Для приготовления больших количеств растворов едкого натра или едкого кали пользуются химически чистыми твердыми щелочами или их концентрированными растворами. Если раствор готовят из твердой щелочи, то удобнее брать гранулированный (чешуйчатый) препарат. Массу навески этого препарата рассчитывают по формуле.
Гранулированный препарат после взвешивания его на техно-химических весах растворяют при охлаждении и постоянном перемешивании в объеме воды, примерно равном объему раствора. Для растворения берут дистиллированную воду, освобожденную от углекислого газа.
Если для приготовления раствора применяется кусковой препарат щелочи, то свеженаколотые куски взвешивают на технических весах, при этом навеска должна быть на 30—50% больше необходимой. Перед растворением навески ее дважды быстро споласкивают дистиллированной водой, чтобы удалить с поверхности кусков карбонат натрия, и немедленно растворяют в небольшом количестве воды, примерно равном по массе начальному количеству щелочи, а затем разбавляют дистиллированной водой до нужного объема.
Для получения рабочих растворов едких щелочей, не содержащих карбонаты, следует применять концентрированные растворы щелочей. Для этого твердую щелочь растворяют в равном по массе количестве воды (кусковой препарат перед этим быстро обмывают дистиллированной водой). Приготовление раствора проводят, пользуясь защитными очками и перчатками. Растворение ведут при постоянном перемешивании и охлаждении в жаростойкой стеклянной или фарфоровой посуде, добавляя щелочь небольшими порциями. Раствор переливают в высокую склянку или цилиндр, закрывают резиновой пробкой и оставляют стоять для отстаивания в течение 1—2 недель. При этом карбонаты выпадают в осадок. После определения плотности раствора по таблицам находят концентрацию раствора щелочи. Объем концентрированного раствора щелочи, необходимый для приготовления рабочего раствора, рассчитывают по формулам.
Для приготовления раствора берут объем воды, равный разности между объемами рабочего и концентрированного растворов.
При приготовлении рабочего раствора отбирают пипеткой прозрачный концентрированный раствор щелочи и разбавляют его дистиллированной водой, свободной от углекислого газа.
Спиртовые растворы щелочей готовят путем растворения при охлаждении навески щелочи в спирте или в водноспиртовой смеси. При анализе применяют раствор едкого кали в 90%-ном (объемн.) спирте. Этот раствор готовят растворением чешуйчатого химически чистого едкого кали в дистиллированной воде и разбавлением полученного раствора до нужного объема 96%-ным спиртом.
Объем 90%-ного спирта будет примерно равен объему раствора. Объем 96%-ного спирта рассчитывают по формуле:
где V — объем раствора.
Объем дистиллированной воды для предварительного растворения навески щелочи определяют по разности объемов раствора и спирта 96%-ного.
Растворение щелочи и разбавление раствора проводят при охлаждении. Объемную процентную концентрацию спирта предварительно определяют спиртомером.
Если в спирте содержатся примеси, особенно непредельные соединения, то спиртовые растворы щелочей желтеют и темнеют, так как щелочи вызывают их осмоление. Поэтому для приготовления растворов щелочей нужно применять спирт, свободный от примесей, способных к осмолению. Спирт можно освободить от этих примесей, смешивая его с едким кали, из расчета 10 г едкого кали на 1 л спирта. Смесь кипятят 30 мин с обратным холодильником, а затем отгоняют спирт.
Раствор гидроокиси кальция готовят в виде насыщенного раствора (0,04 н.). Для этого в 1 л дистиллированной воды, не содержащей углекислого газа, взбалтывают 20 г гидроокиси кальция и дают раствору отстояться в течение суток. Перед использованием его декантируют через сифон.
Раствор гидроокиси бария часто применяют в виде насыщенного раствора (0,35 н.) и для его приготовления 70 г Ba(OH)2•8H2O взбалтывают в 1 л дистиллированной воды, не содержащей углекислого газа; отстаивают и декантируют прозрачный раствор. Растворы меньшей концентрации получают разбавлением насыщенного раствора.
Растворы аммиака применяют в виде приблизительных растворов, часто 6 н. и 2 н. Их готовят путем разбавления дистиллированной водой концентрированного (25%-ного) раствора аммиака.
Объем концентрированного раствора аммиака рассчитывают по формуле.
Концентрация 25%-ного раствора аммиака Тк = 228 г/л, плотность его dк=0,91 г/см 3 .
Концентрация концентрированного раствора может быть найдена по таблице, исходя из плотности раствора, которую предварительно определяют ареометром.
Раствор щелочной смеси едкого натра и соды готовят путем смешивания равных объемов 0,1 н. раствора едкого натра и 0,1 н. раствора соды. При этом получают 0,1 н. раствор щелочной смеси.
Количество кальцинированной соды, необходимое для приготовления определенного объема 0,1 н. раствора, рассчитывают по формуле:
где V — объем раствора, мл.
Пример 1. Рассчитать количество химически чистого чешуйчатого едкого натра, необходимого для приготовления 12 л 0,1 н. раствора.
Масса едкого натра:
40 • 0,1 • 12000 / 1000 = 48 г.
Пример 2. Рассчитать объем концентрированного раствора едкого натра плотностью 1,469 г/см 3 для приготовления 5 л 0,5 н. раствора щелочи.
По таблице находим концентрацию концентрированного раствора щелочи Тк=645 г/л.
Объем концентрированного раствора:
40 • 0,5 • 500 / 645 = 155 мл.
Пример 3. Определить концентрацию концентрированного раствора едкого натра, если 10 мл этого раствора разбавлены водой в мерной колбе емкостью 500 и 10 мл разбавленного раствора были оттитрованы 20,40 мл 0,1036 н. раствора соляной кислоты.
Концентрация концентрированного раствора:
40 • 0,1036 • 20,40 • 500 / 10 • 10 = 423 г/л.
Пример 4. Рассчитать количество едкого кали, воды и 96%-ного спирта для приготовления 2 л 0,5 н. раствора едкого кали в 90%-ном спирте (концентрация спирта указана в объемных процентах).
Масса навески едкого кали:
56 • 0,5 • 2000 / 1000 = 56 г.
Объем 90%-ного спирта равен 2 л.
Объем 96%-ного спирта:
90 • 2 / 96 = 1,875 = 1875 мл.
Объем воды 2000 — 1875 = 125 мл.
Пример 5. Рассчитать объемы 25%-ного раствора аммиака и воды для приготовления 1 л 2 н. раствора аммиака.
Концентрация концентрированного раствора аммиака (по таблице) Тк = 228 г/л.
Источник
Приготовление раствора щёлочи.
Определение молярной концентрации эквивалента, титра стандартного раствора щелочи.
ЦЕЛЬ РАБОТЫ: приготовить стандартный раствор щелочи и определить его титр и молярную концентрацию эквивалента.
1 Приготовление стандартного раствора щёлочи.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: В качестве стандартного раствора обычно употребляют раствор гидроксида калия КОН или NaOH, С(1/1) = 0,1 моль/дм 3 . Для приготовления используют твёрдую щёлочь или её концентрированный раствор.
Приготовить раствор щёлочи NaОН, С(Naон) 0,1 моль/дм 3 , из твёрдого гидроксида натрия в объёме 500 см 3 .
1н 1000 см 3 раствора NaОН — 40 г.
0,1н 500 см 3 — х г.
х = 
Щёлочь при хранении поглощает из воздуха СО2, поэтому всегда содержит примеси карбоната. Учитывая это свойство щёлочи и гигроскопичность твёрдой щёлочи, для приготовления раствора берут массу навески на 50% больше рассчитанной.
ПРИБОРЫ И РЕАКТИВЫ:
1. Раствор Н2С2O4 * 2Н2O 0,1н приготовленный из фиксанала.
2. Сухая щёлочь NaОН.
3. Дистиллированная вода.
4. Индикатор фенолфталеин.
5. Склянка на 500 см 3 .
6. Бюретка на 25 см 3 .
7. Пипетка на 10 см 3 .
8. Колбы для титрования.
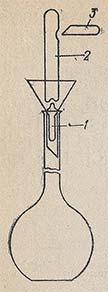
На технических весах взвешивают стакан объёмом 100 — 200 см 3 и пластмассовым шпателем помещают в него кусочки NaОН. Затем в стакан наливают 30-50 см 3 дистиллированной воды и быстро сливают, и так ополаскивают кусочки 2-3 раза. При этом часть Na2СО3, покрывающей кусочки щёлочи, растворится. Если щелочь имеет чешуйчатый вид , то ее не обливают и навеску берут на 10 — 20 % больше рассчитанной. Промытые кусочки щёлочи растворяют в том же стакане охлаждённой прокипяченной водой и через воронку сливают в склянку объёмом 500 см 3 . В склянке раствор разбавляют прокипяченной дистиллированной водой до заданного объёма, закрывают и осторожно перемешивают. Приготовлен раствор щёлочи приблизительной концентрации.
2 Определение молярной концентрации эквивалента и титра стандартного раствора.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: Установление точной концентрации приготовленного раствора щёлочи можно проводить по щавелевой кислоте Н2С2О4 * 2Н2О, янтарной кислоте Н6С4О4 или по раствору соляной кислоты НСl. Наиболее часто используется щавелевая кислота.
В точке эквивалентности образуется соль слабой кислоты и сильного основания.
рН = 7 + (4,2-1,3)/ 2 = 8,45
Индикатор фенолфталеин имеет интервал перехода 8,0 — 10,0 и обеспечивает наименьшую ошибку титрования.
В подготовленную бюретку наливают раствор щёлочи, заполняют кончик бюретки и доводят раствор щёлочи до нулевой метки. В коническую колбу, в которой проводят титрование, пипеткой переносят точный объем исходного раствора щавелевой кислоты (10 см 3 ) и добавляют 1-2 капли фенолфталеина. Титруют щавелевую кислоту щёлочью до появления от одной избыточной капли щёлочи бледно — розовой окраски, не исчезающий при перемешивание в течении 0,5 минуты.
Титрования повторяют до тех пор, пока три последних титрования не совпадут или не будут различаться не более, чем на 0,1 см 3 . Окончательным считают среднее значение из результатов трёх титрований.
Vcp( NAOH) = 
РАСЧЕТ РЕЗУЛЬТАТОВ АНАЛИЗА:
СNaOH = 
TNaOH = 
К NaOH = 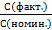
Источник
Приготовление растворов
Растворы — однородные системы, образованные двумя или большим числом компонентов. Компонент, содержание которого в растворе преобладает, обычно называют растворителем; компонент с меньшим содержанием называют растворенным веществом.
Способы выражения концентрации растворов
Количественное содержание компонента раствора, отнесенное к определенной массе или к определенному объему раствора или растворителя, называется концентрацией этого компонента. При этом содержание растворенного вещества обычно выражают в единицах массы, в молях или в эквивалентах.
Процентная концентрация (по массе) — это число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. (Ниже процентная концентрация обозначена С%.) Так, 20% водный раствор КОН содержит 20 единиц массы КОН и 80 единиц массы воды.
Молярная концентрация (молярность) выражается числом молей растворенного вещества в 1 л раствора и обозначается буквой М или См.
Моль — единица количества вещества. Моль — это количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода 12С (6,022*10 в 23). Масса вещества, содержащаяся в 1 моле данного простого или сложного вещества, называется мольной массой. Мольная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная масса.
Число молей простого или сложного вещества n находят из отношения массы m этого вещества в рассматриваемой системе к его мольной массе М:
Произведение объема раствора, выраженного в миллилитрах, на его молярность равно числу миллимолей растворенного вещества.
Эквивалентная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора и обозначается буквами N, н. или Сн.
Эквивалентом вещества называется такое его количество, которое в данной реакции равноценно (эквивалентно) 1 молю атомов водорода (1,0079 г). Масса 1 эквивалента называется эквивалентной массой.
Выражение концентрации растворов в единицах нормальности значительно упрощает вычисление объемов растворов количественно реагирующих друг с другом веществ. Эти объемы обратно пропорциональны их концентрациям, выраженным в единицах нормальности:
Произведение объема раствора, выраженного в миллилитрах, на его нормальность равно числу миллиэквивалентов растворенного вещества.
Концентрацию растворов выражают также через титр, т. е. массой (в г или мг) вещества, содержащегося в 1 мл раствора, и обозначают буквой Т. Найденную величину называют титром по растворенному (рабочему) веществу. В аналитической практике пользуются также титром по анализируемому веществу, т. е. массой (в г или мг) анализируемого вещества, эквивалентной тому количеству реагента, которое содержится в 1 мл раствора.
Например, титр 0,1 н H2SO4 (эквивалентная масса H2SO4 = 49,04 г/моль) равен:
При титровании этим раствором NaOH титр H2SO4, выраженный по анализируемому веществу NaOH (эквивалентная масса NaOH = 40,01 г/моль) равен:
Концентрацию растворов часто выражают в единицах моляльности — числом молей вещества, растворенного в 1 кг растворителя. Моляльность обозначают буквой m.
Формулы перехода от одних выражений концентрации растворов к другим
Примем следующие условные обозначения концентрации:
С% — процентная концентрация по массе;
А — число единиц массы растворенного вещества на 100 единиц массы растворителя;
Б — масса растворенного вещества в 1 л раствора;
Сн — число эквивалентов растворенного вещества в 1 л раствора (нормальность);
См — число молей растворенного вещества в 1 л раствора (молярность);
m — число молей растворенного вещества на 1000 г растворителя (моляльность);
Э — эквивалентная масса растворенного вещества, г/моль;
М — мольная масса растворенного вещества, г/моль;
d — относительная плотность.
Растворимость
Растворимость — величина, характеризующая способность вещества образовывать с данным растворителем однородную систему. Количественно растворимость газа, жидкости или твердого тела в жидком растворителе измеряется концентрацией насыщенного раствора при данной температуре.
Обычно растворимость твердых и жидких веществ выражают коэффициентом растворимости, т. е. массой вещества, растворяющегося при данных условиях в 100 единицах массы растворителя с образованием насыщенного раствора. (Насыщенным называется раствор, находящийся в равновесии с избытком растворяемого вещества.)
Каждой температуре соответствует определенная растворимость данного вещества в данном растворителе. Сведения о растворимости приводятся в справочниках.
Растворимость газов в жидкостях повышается с увеличением давления и, в большинстве случаев, с понижением температуры.
Растворимость жидких веществ в жидкостях может быть неограниченной, когда жидкие компоненты смешиваются друг с другом в любых отношениях (этиловый спирт — вода) и ограниченной в случае несмешивающихся жидкостей. В последнем случае расслаивание жидких компонентов системы зависит от температуры; обычно взаимная растворимость компонентов возрастает с температурой. Выше некоторой температурной точки, называемой критической точкой растворимости, взаимная растворимость компонентов системы становится неограниченной (расслаивания нет).
Растворимость твердых веществ в жидкостях может изменяться в широких пределах. Обычно она возрастает с повышением температуры. Однако некоторые вещества не подчиняются этому правилу: растворимость их или понижается с повышением температуры, или повышается только до некоторого предела, выше которого растворимость уменьшается.
Техника приготовления растворов
По точности выражения концентрации растворы делят на приблизительные, точные и эмпирические.
Растворы кислот и оснований приблизительной концентрации служат в качестве вспомогательных реагентов при выполнении аналитических, препаративных и других работ. Концентрацию подобных растворов рассчитывают либо по степени разбавления исходных веществ (растворов), либо по массе вещества (взвешивается на технических весах), растворенного в известной массе растворителя. Часто приблизительную концентрацию растворов определяют по величине плотности.
Растворы с точной, заранее установленной концентрацией, называемые рабочими, стандартными или титрованными растворами, служат для определения точной концентрации других растворов.
Концентрации многих растворов вспомогательных веществ (индикаторы, специфические реактивы и др.) устанавливаются эмпирически и приводятся в соответствующих прописях.
Независимо от того, какие по точности концентрации приготовляют растворы, применять следует только чистые исходные вещества и воду высокой степени очистки, а в ряде случаев (для растворов NaOH, Na2S2O3) — очищенную от CO2.
Следует иметь в виду, что скорость растворения твердого вещества зависит от размера его частиц (тонкоизмельченное растворяется быстрее).
Некоторые вещества не смачиваются водой и плавают на ее поверхности, образуя тонкую пленку. Для приготовления водных растворов подобных веществ рекомендуют порошок вначале облить небольшим количеством этилового спирта (если он инертен по отношению к компонентам раствора), а уже затем приливать воду.
Сосуды для растворения и хранения растворов оснований должны быть снабжены хлоркальциевыми трубками, заполненными аскаритом или натронной известью, чтобы защитить раствор от СO2. В некоторых случаях растворы следует хранить в атмосфере инертного газа (N2, СO2). Растворы веществ, разлагающихся под действием света, например AgNO3, следует хранить в сосудах из коричневого стекла или покрытых черным лаком (в крайнем случае обернутых в черную бумагу).
Приготовление водных растворов кислот приблизительной концентрации
Водные растворы кислот (H2SO4, HCl, HNO3) обычно приготовляют соответствующим разбавлением исходных химически чистых концентрированных кислот. Разбавление проводят из расчета на объем, так как жидкость всегда легче отмерить, чем взвесить. Чтобы получить разбавленную кислоту (например, 1:5), к 5 объемам воды прибавляют 1 объем кислоты.
Процентное содержание концентрированных кислот контролируют по плотности, определяемой большей частью ареометром. Значения концентрации кислот в зависимости от плотности см. в справочниках.
Обращаться с концентрированными кислотами следует осторожно, так как они сильно действуют на кожу, разрушают одежду и обувь, портят полы и столы. При работе с концентрированными кислотами необходимо пользоваться резиновыми перчатками и защитными очками.
При приготовлении разбавленных растворов кислот (в особенности H2SO4) следует приливать кислоту в воду тонкой струей при непрерывном перемешивании стеклянной палочкой. Если при этом смесь сильно разогрелась, то ее охлаждают, после чего приливают следующую порцию кислоты.
Кислоту, попавшую на обувь или одежду, необходимо незамедлительно смыть большим объемом воды, нейтрализовать аммиаком или NaHCO3 и снова обмыть водой. Кислоту, разлитую на столе или на полу, засыпают песком, нейтрализуют Na2CO3, СаО, Са(ОН)2, СаСО3 и лишь после этого производят уборку.
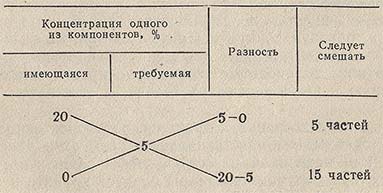
При приготовлении разбавленных растворов из более концентрированных или путем смешения растворов разных концентраций, для расчета соотношения объемов удобно пользоваться так называемым правилом креста или смешения. Это правило может быть иллюстрировано схемой получения 5% (по массе) раствора разбавлением 20% раствора:
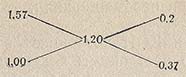
Правило креста распространяется и на случай, когда концентрация смешиваемых водных растворов выражена через плотность. Пусть дан водный раствор плотностью 1,57 г/см3. Нужно из него приготовить раствор с плотностью 1,20 г/см3. По правилу креста составляем схему:
отсюда следует, что нужно смешать 20 см3 раствора с р = 1,57 г/см3 с 37 частями по массе воды.
Расчет концентрации по правилу креста не отличается точностью, и пользоваться этим методом можно лишь для приготовления растворов приблизительной концентрации.
Приготовление безводного раствора хлорной кислоты
Раствор хлорной кислоты в безводной уксусной кислоте широко применяют в качестве титранта для кислотно-основного титрования в неводной среде.
Промышленность выпускает хлорную кислоту различной концентрации (от 42 до 70%), чаще всего в виде 57% водного раствора с плотностью около 1,50.
Избыточную воду из хлорной кислоты удаляют уксусным ангидридом:
Предварительно определив содержание воды в хлорной кислоте, последнюю растворяют в ледяной уксусной кислоте и рассчитывают, какой объем V1 (в мл) уксусного ангидрида необходим для удаления из хлорной кислоты избыточной воды:
где 100 — А — содержание воды в исходном растворе НСlO4, %; V — объем НСlO4, взятый для приготовления раствора, мл; р — плотность применяемого раствора HClO4, г/см3; p1 — плотность уксусного ангидрида, г/см3; 102 — молекулярная масса уксусного ангидрида; 18 — молекулярная масса воды.
Определенный объем HClO4 V постепенно, при непрерывном перемешивании, вливают в 800 мл ледяной уксусной кислоты, прибавляют V1 мл уксусного ангидрида, тщательно перемешивают, доводят объем раствора ледяной уксусной кислотой до 1 л и снова перемешивают. Через сутки раствор готов.
Приготовление растворов щелочей
При растворении NaOH или КОН необходимо пользоваться резиновыми перчатками и защитными очками. Щелочи вызывают химический ожог кожи, разрушают одежду и обувь. Брать твердую щелочь руками запрещается.
Водные растворы NaOH и КОН. При растворении твердых NaOH и КОН в воде происходит сильное разогревание; поэтому насыщенные растворы щелочей приготовляют в термостойкой стеклянной или, лучше, в фарфоровой посуде, постепенно добавляя твердую щелочь при перемешивании, чтобы избежать местного перегрева.
На воздухе NaOH и КОН поглощают воду и СO2. Образующиеся карбонаты мало растворимы в концентрированном растворе щелочей и постепенно выпадают в осадок.
Концентрированные растворы щелочей при хранении в стеклянной посуде разрушают стекло, выщелачивая из него кремневую кислоту. Поэтому лучше хранить их в сосудах из полиэтилена.
Из концентрированных растворов получают разбавленные растворы щелочей, концентрацию которых контролируют по плотности. Ориентировочное значение объемов разбавляемого раствора щелочи и воды можно рассчитать и по правилу креста.
Приготовление 50% раствора NaOH, не содержащего карбонатов (по ГОСТ 4517-75), производят следующим образом: в фарфоровом стакане растворяют при постепенном добавлении и перемешивании 250 г NaOH в 250 мл дистиллированной воды. После охлаждения раствор переливают в полиэтиленовый сосуд, закрывают пробкой и выдерживают 2-3 недели, до полного осаждения NaCO3. Затем прозрачный раствор сифонируют стеклянной трубкой и соответственно разбавляют водой, не содержащей СO2.
Спиртовый раствор КОН. Растворимость NaOH и КОН в метиловом спирте выше, чем в этиловом. Однако поскольку метиловый спирт очень токсичен и огнеопасен, обычно используют этанольные растворы NaOH и КОН. Растворимость NaOH в этиловом спирте при 28 °С составляет 14,7%, а КОН — 27,9%.
Для приготовления раствора КОН применяют этиловый ректификованный спирт, предварительно очищенный от альдегидов.
Наиболее эффективен следующий способ очистки: раствор из 2 г AgNO3 в 5 мл дистиллированной воды вливают в 1200 мл этилового спирта, находящегося в склянке с притертой пробкой, и тщательно перемешивают. Отдельно растворяют 5 г КОН в 25 мл горячего этилового спирта, раствор охлаждают и вливают в спиртовой раствор AgNO3. Выпадает осадок Ag2O, которому дают осесть, фильтруют и отгоняют спирт. Этиловый спирт, очищенный этим способом, остается бесцветным несколько лет.
Спиртовой раствор КОН при хранении часто приобретает слабо-желтую окраску, вызываемую осмолением примесей. Для приготовления растворов КОН, не окрашивающихся при длительном хранении, рекомендуют спирт предварительно обработать бутилатом алюминия (5 г на 1 л спирта). Смеси дают постоять 3-4 недели при комнатной температуре, после чего спирт декантируют и растворяют в нем КОН.
Приготовление водного раствора аммиака
Поступающий в продажу водный раствор аммиака плотностью 0,901-0,907 г/см3 при 20 °С, содержит 25-27% NH3. Препарат и его разбавленные растворы вполне пригодны для выполнения большинства препаративных и вспомогательных лабораторных работ.
Для аналитических работ ГОСТ 4517-75 рекомендует приготовлять растворы из баллонного жидкого синтетического аммиака или из водного аммиака, поступающего в продажу.
Газообразный аммиак вызывает раздражение глаз и слизистой оболочки носа, тошноту и головные боли. Все работы с аммиаком должны проводиться в вытяжном шкафу.
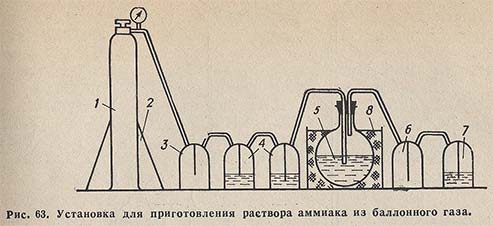
Из баллонного аммиака. Собирают установку (рис. 63). Баллон с аммиаком 1 устанавливают и закрепляют на подставке 2. Баллон соединяют с пустой промежуточной склянкой 3, к которой присоединены две поглотительные склянки 4 с раствором NaOH для поглощения СO2. Аммиак, очищенный от СO2, поступает в приемник 5, где находится дважды перегнанная дистиллированная вода, не содержащая СO2. Насыщение аммиаком проводят до достижения плотности раствора в приемнике 0,907 г/см3, что соответствует 25% раствору аммиака.
Для получения более концентрированного раствора приемник охлаждают водой со льдом в бане 8.
Склянка 6 — брызгоуловитель; склянка 7, содержащая раствор NaOH, предохраняет от попадания СO2 из воздуха в приемник.
Из водного аммиака. 500 мл водного аммиака помещают в круглодонную колбу вместимостью 1 л и осторожно прибавляют свежеприготовленную кашицу из 10 г СаО и воды.
Колбу соединяют с вертикально поставленным обратным холодильником, верхний конец которого закрывают трубкой с натронной известью, и оставляют раствор в покое на 18-20 ч. Затем собирают установку (рис. 64). Колбу 2 с водным аммиаком ставят на водяную баню 1 так, чтобы холодильник был направлен вверх под углом 45°, и соединяют верхний его конец через промежуточную колбу 4 с приемником — колбой 5, содержащей 300-400 мл воды, и закрытой трубкой с натронной известью 6. При нагревании водного аммиака на водяной бане газообразный аммиак поступает в приемник и полностью поглощается водой. Насыщение аммиаком проводят до достижения плотности раствора в приемнике 0,907 г/см3, что соответствует 25% раствору аммиака.
Приготовление рабочих растворов точной концентрации
Приготовление раствора из навески стандартного вещества. Взятую с точностью до 0,0002 г навеску высушенного стандартного вещества, которая приблизительно соответствует рассчитанной для получения определенного объема раствора заданной концентрации, аккуратно переносят в мерную колбу и растворяют в небольшом объеме дистиллированной воды, не содержащей СO2. Полученный раствор при периодическом взбалтывании разбавляют водой, доводя объем раствора в мерной колбе несколько ниже метки. Затем колбу с раствором выдерживают 15-20 мин при 20°С и осторожно добавляют воду до метки. Колбу закрывают пробкой и содержимое взбалтывают в течение 15-30 мин.
Зная массу исходного вещества и объем раствора, вычисляют его концентрацию.
Для упрощения последующих расчетов удобно пользоваться поправкой на нормальность (или коэффициентом нормальности) К. Эта поправка представляет собой отношение нормальности приготовленного раствора к заданной нормальности раствора, выраженной целыми, десятыми или сотыми долями нормальности. Например, нормальность приготовленного раствора оказалась равной 0,1036 н., а заданная 0,1 н. В этом случае
При умножении объема пошедшего на титрование раствора на эту поправку К получают эквивалентный объем заданной концентрации (в данном случае 0,1 н.).
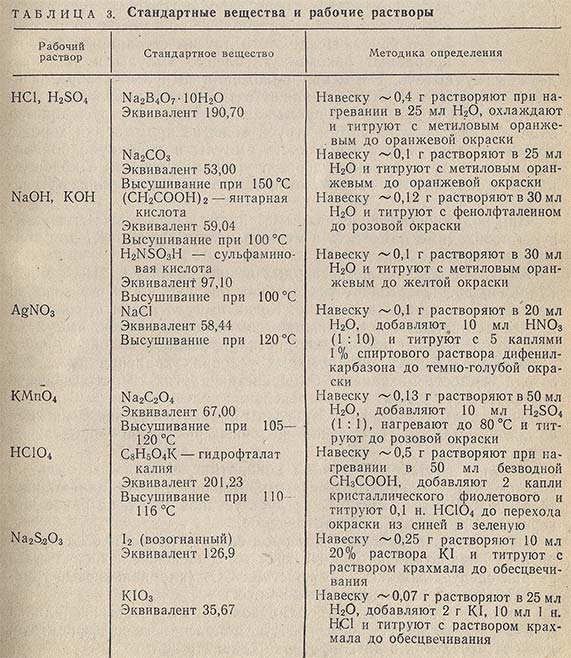
В табл. 3 приведены некоторые твердые стандартные вещества, с помощью которых точно устанавливается концентрация наиболее часто применяемых рабочих растворов.
Приготовление растворов из фиксаналов. Фиксаналы, или стандарт-титры, представляют собой точно отвешенное количество реактива или его раствора, запаянного в стеклянную ампулу. Как правило, в каждой ампуле содержится 0,1 эквивалента вещества. При количественном перенесении содержимого подобной ампулы в мерную колбу на 1 л и доведении объема раствора водой до метки при 20 °С получаются точно 0,1 н. растворы.
Выпускаются фиксаналы HCl, H2SO4, NaOH, КОН, Na2CO3, NaCl, Na2C2O4, H2C2O4-2H2O, K2Cr2O7, K2C2O4, Na2S2O3-5H2O, KMnO4, AgNO3, NH4SCN, KSCN, NaSCN, BaCl2-2H2O, (NH4)2C2O4-H2O, Na2B4O7-10H2O, KCl, K2CO3, NH4Cl, I2 и др.
Фиксаналы рекомендуется применять во всех случаях, когда требуется быстро приготовить точный рабочий раствор, не прибегая к взвешиванию.
Вначале теплой водой смывают надпись на ампуле и хорошо обтирают ее чистым полотенцем. В мерную колбу вместимостью 1 л вставляют воронку с вложенным в нее стеклянным бойком (обычно прилагается к каждой коробке фиксанала), острый конец которого должен быть обращен вверх (рис. 65). Ампуле с фиксаналом дают свободно падать так, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого другим стеклянным бойком пробивают боковое углубление ампулы и дают содержимому вытечь. Не меняя положения ампулы, в образовавшееся верхнее отверстие вставляют оттянутый в капилляр и изогнутый вверх конец трубки промывалки и сильной струей промывают ампулу изнутри. Затем струей воды из промывалки хорошо промывают наружную поверхность ампулы и воронку с бойком. Удалив ампулу из воронки, доводят уровень жидкости в колбе до метки. Колбу плотно закрывают и тщательно перемешивают раствор.
При пользовании фиксаналом 0,1 н. йода перед вскрытием ампулы необходимо поместить в мерную колбу 30-40 г KI для полного растворения йода.
Ампулы с фиксаналами твердых веществ (H2C2O4-2H2O, NaCl, KMnO4 и др.) вскрывают так же, как описано выше, но воронка должна быть совершенно сухая. Когда ампула разбита, содержимое ее осторожным встряхиванием высыпают в колбу, ампулу и воронку тщательно промывают дистиллированной водой.
Фиксанал AgNO3 при обычных условиях хранения через 2-3 года темнеет. Фиксаналы большинства других твердых веществ и кислот могут храниться неопределенно долгое время.
Фиксаналы NaOH, КОН пригодны только в течение 6 месяцев со дня их выпуска. Помутнение щелочных растворов — признак их порчи.
Рабочие растворы с точной концентрацией должны быть по возможности свежеприготовленными. Исключение составляют растворы KMnO4, титр которых следует устанавливать не ранее чем через 3-4 дня после их приготовления.
При хранении рабочих растворов следует периодически проверять их концентрацию. Рабочие растворы щелочей и тиосульфата натрия следует защищать от действия СО2 (хлоркальциевые трубки с натронной известью или аскаритом).
Сосуды с рабочими растворами должны иметь четкие надписи с указанием вещества, нормальности, поправочного коэффициента, даты изготовления и даты проверки концентрации.
Источник