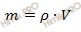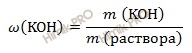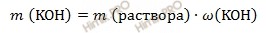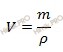- Химик.ПРО – решение задач по химии бесплатно
- Решение задачи
- Ответ:
- LiveInternetLiveInternet
- —Музыка
- —Метки
- —Рубрики
- —Видео
- —Фотоальбом
- —Поиск по дневнику
- —Подписка по e-mail
- —Друзья
- —Постоянные читатели
- —Статистика
- lкак приготовить раствор щелочи калия (школа мыловара)
- 9.2. Растворы щелочей
- Как приготовить 500 мл 20 раствора гидроксида калия
Химик.ПРО – решение задач по химии бесплатно
Сколько 20-процентного (ρ = 1,18 г/см 3 ) и 8-процентного (ρ = 1,06 г/см 3 ) растворов гидроксида калия (KOH) (в миллилитрах) необходимо взять, чтобы приготовить 400 миллилитров 15-процентного его раствора гидроксида калия (ρ = 1,13 г/см 3 )?
Решение задачи
Найдем массу конечного раствора гидроксида калия (KOH) по формуле, устанавливающей связь между объемом и массой раствора:
m (KOH) = 1,13 ⋅ 400 = 452 (г).
Найдем сколько в конечном растворе гидроксида калия (KOH) должно содержаться гидроксида калия (KOH) (в граммах). Для расчета будем использовать формулу нахождения массовой доли вещества в растворе:
Откуда выразим m вещества гидроксида калия (KOH):
m (KOH) = 452 ⋅ 0,15 = 67,8 (г).
Если раствор гидроксида калия (KOH) 15-процентный, то массовая доля гидроксида калия (KOH) в нем 0,15.
Обозначим через х массу 20-процентного раствора, а массу 8-процентного раствора гидроксида калия (KOH) через у, получаем:
Найдем, сколько гидроксида калия (KOH) (в г) содержится в х г 20-процентного раствора:
m (KOH) = х ⋅ 0,2 = 0,2х (г)
Если раствор гидроксида калия (KOH) 20-процентный, то массовая доля гидроксида калия (KOH) в нем 0,2.
Найдем, сколько гидроксида калия (KOH) (в г) содержится в 452 — х г 8-процентного раствора гидроксида калия (KOH):
m (KOH) = (452 — х) ⋅ 0,08 = 36,16 – 0,08х (г)
Если раствор гидроксида калия (KOH) 8-процентный, то массовая доля гидроксида калия (KOH) в нем 0,08.
Учитывая, что суммарная масса гидроксида калия (KOH) в конечном растворе гидроксида калия (KOH) равна 67,8 г, составим уравнение:
0,2х + 36,16 – 0,08х = 67,8
Решив уравнение, найдем, что х = 263,67 то есть масса 20-процентного раствора гидроксида калия (KOH) равна 263,67 г. Найдем его объем по формуле, устанавливающей связь между массой и объемом раствора:
V (KOH) = 263,67 / 1,18 = 223,45 (см 3 )
Масса 8-процентного раствора гидроксида калия (KOH) равна 188,33 г (452 г – 263,67 г), а его объем:
V (KOH) = 188,33 / 1,06 = 177,7 (см 3 ).
Ответ:
объем 20-процентного раствора гидроксида калия (KOH) равен 223,45 миллилитра;
объем 8-процентного раствора гидроксида калия (KOH) равен 177,7 миллилитров.
Источник
LiveInternetLiveInternet
—Музыка
—Метки
—Рубрики
- рукоделие (5341)
- вязалочка (1796)
- вышивка (1211)
- журналы (813)
- бижутерия (603)
- бисер (514)
- хенд мейд (440)
- игрушки (416)
- Мода (281)
- пластика (272)
- квилт (97)
- гобелен (66)
- макраме (45)
- декупаж (35)
- декупаж (15)
- квилинг (10)
- кулинария (1888)
- Выпечка (620)
- Вегетерианство (524)
- заготовки на зиму (335)
- торт (144)
- искусство (1881)
- музыка (507)
- живопись (351)
- рисунок (220)
- антиквариат (201)
- роспись (184)
- ювелирное искусство (183)
- скульптура (163)
- художник (163)
- музеи ,выставки (39)
- батик (21)
- Мастер-классы (1441)
- Видео (815)
- страны и народы (742)
- индейцы (123)
- Китай (74)
- Индия (50)
- буряты (28)
- эвенки (4)
- саморазвитие (669)
- Психология (475)
- фото (462)
- дом (406)
- интерьер (249)
- Фен-шуй (5)
- садово-огородное (362)
- здоровье (325)
- КРАСОТА СЕВЕРНОГО КРАЯ (311)
- Интересно (302)
- Русь Великая (292)
- Байкал (258)
- юмор (234)
- эзотерика (190)
- домашняя косметика (168)
- Братья наши меньшие (142)
- мысли вслух (121)
- Северобайкальск (95)
- праздники (90)
- кошки (85)
- Йога (80)
- ФАРФОР (77)
- религии (77)
- буддизм (42)
- мой дом (76)
- мое творчество (45)
- Моя семья (18)
- магазин (4)
- хиппи (67)
- самоцветы (44)
- люди (44)
- Тайны Земли (44)
- винтаж (33)
- мандалы,фракталы (31)
- история (22)
- Вселенная (3)
—Видео
—Фотоальбом
—Поиск по дневнику
—Подписка по e-mail
—Друзья
—Постоянные читатели
—Статистика
lкак приготовить раствор щелочи калия (школа мыловара)
Как известно, для приготовления мыла с нуля обязательно требуется щелочь. Ведь само мыло – это результат омыления растительных или животных жиров раствором щелочи. Отличие одно – для приготовления твердого мыла используется гидроксид натрия, а для приготовления мыла-бельди и жидкого мыла – гидроксид калия.
Сегодня я покажу, как приготовить раствор гидроксида калия. Этот раствор понадобится нам для приготовления марокканского мыла для хаммама – бельди.
раствор гидроксида калия
Кроме различия в твердости получаемого мыла, никаких особенных тонкостей в приготовлении раствора гидроксида калия нет. Сначала берется рецепт будущего мыла, потом по калькулятору щелочи считается необходимое количество жирных масел и самой щелочи для приготовления мыла. Ну а дальше – просто смотрите пошаговые фотографии этого процесса.
Для приготовления раствора гидроксида калия нам понадобятся – дистилированная вода и щелочь — гидроксид калия. Как я уже говорила в самом начале, количество воды и щелочи считается в калькуляторе щелочи. Раствор щелочи мы готовим в то время, пока расплавляются масла, которые вы выбрали для мыла.
1. Дистилированную воду предварительно охлаждаем в холодильнике – вода должна быть холодная.
2. Взвешиваем гидроксид калия. При работе с любой щелочью обязательно соблюдаем технику безопасности!
взвешиваем гидроксид калия на весах
3. Взвешиваем воду в стеклянной банке.
4. Маленькими порциями при постоянном перемешивании всыпаем калий в воду. Именно так – щелочь в воду, а не наоборот!
всяпаем щелочь в воду
5. Тщательно перемешиваем после каждой порции калия. Чтобы раствор не сильно нагревался, поставьте банку с ним в миску, в которую насыпьте кубики льда.
6. Калий растворился полностью, раствор получился прозрачный.
готовый раствор калия
7. Перед смешиванием раствора щелочи с маслами помните, что они должны быть одинаковой температуры. Поэтому сначала нужно измерить температуру раствора щелочи или масел, и подогнать температуру второго компонента.
измеряем температуру раствора щелочи
Теперь, когда раствор калия готов, можно варить жидкое мыло с нуля, или сделать марокканское мыло-бельди.
| Рубрики: | Мастер-классы домашняя косметика |
Метки: бельди гидроксид калия школа мыловара мыло с нуля
Процитировано 56 раз
Понравилось: 7 пользователям
Источник
9.2. Растворы щелочей
9.2. РАСТВОРЫ ЩЕЛОЧЕЙ
9.2.1. Гидроксиды натрия или калия. Исходными реактивами являются гидроксид натрия (едкий натр), NaOH, х.ч. или ч.д.а., по ГОСТ 4328-77 или гидроксид калия (едкое кали), KOH, х.ч. или ч.д.а., по действующей нормативно-технической документации.
2,5 моль/куб. дм (2,5 н) раствор. Вначале готовят концентрированный раствор с массовой долей примерно 45%. Для этого в фарфоровой посуде взвешивают на технических весах 500 — 520 г NaOH или KOH, смывают водой верхний слой карбоната. Обмытые гранулы растворяют в 500 куб. см воды, добавляя ее постепенно, при непрерывном помешивании. Остывший концентрированный раствор осторожно сливают в бутыль, которую закрывают пробкой с хлоркальциевой трубкой, наполненной натронной известью . Раствор оставляют для отстаивания на срок не менее двух дней, затем сливают с осадка и замеряют плотность ареометром.
Все растворы гидроксида натрия или калия хранят, защищая их от углекислого газа воздуха при помощи вставленных в пробки хлоркальциевых трубок, заполненных натронной известью. Натронную известь получают при взаимодействии концентрированного раствора NaOH со свежепрокаленной CaO (на 2 весовые части CaO одна весовая часть NaOH) с последующим выпариванием (осторожно) и слабым прокаливанием. После измельчения и просеивания ею заполняют хлоркальциевую трубку.
Точность 2,5 моль/куб. дм раствора проверяют титрованием соляной или серной кислотой в присутствии фенолфталеина.
На 10 куб. см точно 2,5 моль/куб. дм (2,5 н) раствора гидроксида натрия или гидроксида калия должно пойти 25 куб. см точно 1 моль/куб. дм (1 н) раствора соляной или 0,5 моль/куб. дм (1 н) раствора серной кислоты. Если кислоты идет на титрование больше или меньше, то концентрацию раствора гидроокиси натрия соответственно уменьшают, разбавляя водой, или увеличивают, добавляя раствор гидроксида натрия с массовой долей 45%.
Коэффициент поправки 1 моль/куб. дм растворов NaOH и KOH устанавливают по 1 моль/куб. дм (1 н) раствору соляной или 0,5 моль/куб. дм (1 н) серной кислоты, приготовленному из фиксанала (К = 1), или с установленным коэффициентом поправки. В этом случае в 3 — 4 конические колбы отмеривают пипеткой 10 — 20 куб. см растворов NaOH или KOH добавляют по 3 — 4 капли раствора фенолфталеина с массовой долей 1% и титруют соответствующим раствором соляной или серной кислоты до исчезновения розовой окраски.
Коэффициент поправки вычисляют по формуле:
С этой целью склянку, из которой удаляют углекислоту, соединяют с промывными склянками с помощью стеклянной трубки, вставленной в пробку, промывные склянки также соединяют между собой с помощью стеклянных трубок, вставленных в пробки (рис. 8 — не приводится). Вторую стеклянную трубку склянки присоединяют к водоструйному насосу посредством резиновой трубки с зажимом. По окончании продувания резиновую трубку перекрывают зажимом.
9.2.3. Гидроксид аммония (водный раствор аммиака с массовой долей 25%), х.ч. или ч.д.а., по ГОСТ 3760-79, растворы с массовой долей 15% и 10%. Готовят разбавлением соответственно 622 и 423 куб. см водного раствора с массовой долей 25% аммиака дистиллированной водой до 1000 куб. см.
Источник
Как приготовить 500 мл 20 раствора гидроксида калия
Задача 20
Вычислить рН раствора, содержащего 0,05 моль/л аммиака и 0,02 моль/л хлорида аммония.
Решение:
При смешении слабого основания с его солью получается щелочная буферная смесь.
Для щелочной буферной смеси рН = 14 – рКb + lg(Cосн./Cсоли)
рКb аммиака = – lg Kb
Kb (NH4OH)=1,8∙10^-5
рН =14 + lg(1,8∙10^-5) + lg (0,05 / 0,02) = 9,653 ≈ 9,65
Задача 21
Какую массу NH4Cl надо растворить в 100 мл раствора NH3 с массовой долей 1%, чтобы получить раствор с pН=9?
Решение:
для щелочной буферной смеси рН = 14 – рКb + lgCосн/Cсоли
рКb аммиака = 4,75
См(NH3) = 1000ωρ/M
ρ (1% NH3) = 0,9940 (справ. табл. http://techemy.com/handbook/tab0002.php)
См(NH3) = 1000 ∙ 0,01 ∙ 0,9940 / 17 = 0,585 М
lg(0,585/[NH4Cl]) = 9 – 14 + 4,75 = –0,25
[NH4Cl]= 0,585 / 10^–0,25 = 1,040 M
m=nM = CVM = 1,040 ∙ 0,100 ∙ 53,50 = 5,564 г
Задача 22
Имеются 250 мл раствора аммиака с рН=11. Какую массу нитрата аммония следует растворить в этом растворе для получения буфера с рН=9 ? рК(NH3)=4,75 .
Решение:
Для щелочной буферной смеси рН = 14 – рКb + lg(Cосн/Cсоли)
рКb(NH3) = 4,75
lg(Cосн/Cсоли) = рН –14 + рКb = –0,25
для слабого основания рН = 14 – рКb/2 + lgСосн./2
lgСосн. = (рН – 14 + рКb/2)2 = 2рН – 28 + рКb = 22 – 28 + 4,75 = –1,25
lg(Cсоли) = lgСосн. – lg(Cосн/Cсоли) = –1,25 + 0,25 = –1
Cсоли = 10^–1 = 0,1 моль/л
m=nM = CVM = 0,1 ∙ 0,25 ∙ 53,50 = 1,3375 г
Задача 23
Рассчитайте рН буферного раствора, один литр которого содержит 0,1 моль уксусной кислоты и 0,01 моль ацетата натрия. Константа диссоциации уксусной кислоты Ка=1,74∙10-5; рКа=4,76.Ответ: рН=3,76.
Решение:
рН = рКа + lg ([соли] / [кислоты]) = 4,76 + lg (0,01 / 0,1) = 3,76
Задача 24
У какого раствора буферная емкость по кислоте больше — у того, чья pH(р-ра)=pKд сл.кисл. +1, или у того, чья pH(р-ра)=pKд сл.кисл –1 ?
Задача 25
Рассчитайте объем 0,5%-ного раствора соляной кислоты (плотность раствора 1,002 г/мл) и 0,2М раствора аммиака необходимых для приготовления 200 мл буферного раствора с pH=8,5.
Решение:
В рез. частичной реакции аммиака с соляной кислотой: HCl + NH3 → NH4Cl
(или точнее: NH3∙H2O + HCl → NH4Cl + H2O),
образовалась смесь аммиака с хлоридом аммония, т.е. щелочная буферная смесь.
Для щелочной буферной смеси рН = 14 – рКb + lg(Cосн/Cсоли)
рКb аммиака = 4,75
lg(Cосн/Cсоли) = рН –14 + рКb = 8,5 –14 + 4,75 = – 0,75
Cосн/Cсоли = 10^– 0,75=0,1778
Основание и соль находятся в одном объеме буферного раствора, поэтому вместо отношения конц-й можно использовать отношение количеств веществ в молях:
n осн/ n соли = 0,1778
По ур. реакции, для получения 1 моль соли прореагировали 1 моль кислоты и 1 моль аммиака. Т.е. до реакции на 0,1778+1=1,1778 часть аммиака приходилась 1 часть кислоты, и образовалась 1 часть соли. Т.о. кол-во кислоты = кол-ву полученнной соли.
Общий объем полученного раствора равен 200 мл = 0,2 л
n = СV
См(NH3) = 0,2М
См(HCl) = 1000ρω / M = 1002 ∙ 0,005 / 36,46 = 0,1374 М
Обозначим объем раствора аммиака Vо=х, а объем раствора взятой кислоты Vк=200–х
СоVо / СкVк = 1,1778 / 1
0,2х / 0,1374(200–х) = 1,1778
Vо= х= 89,45 мл
Vк = 200,0–89,45 = 110,55 мл
Задача 26
Рассчитать буферную ёмкость раствора, содержащего 0,3 моль/л хлорида метиламмония и 0,25 моль/л метиламина.
Решение:
при смешении слабого основания с его солью получается щелочная буферная смесь.
Каждый буферный раствор характеризуется сопротивляемостью к изменениям — буферной емкостью β. Она определяется числом молей эквивалентов сильной кислоты или основания,
которые нужно добавить, чтобы изменить рН на единицу:
β = – dСкисл/dрН = dСосн./dрН
где dc – прирост концентрации сильной кислоты или основания, вызвавший изменение на dpH (знак минус указывает на уменьшение рН при добавлении сильной кислоты).
Бесконечно малый прирост сильной кислоты вызываеттакой же прирост концентрации слабой кислоты, а бесконечно малый прирост сильного основания приводит к появлению такого же количества слабого основания, только в первом случае рН немного уменьшится, а во втором увеличится.
Суммарная концентрация компонентов смеси Сбуф не меняется, отсюда уравнение материального баланса: Сбуф = Скисл + Ссоли
Поэтому для щелочного буферного раствора: β = 2,3 С осн. ∙ С соли / (С осн. + С соли)
(для кислого: β = 2,3 С кисл. ∙ С соли / (С кисл. + С соли))
β = 2,3 ∙ 0,3 ∙ 0,25 / (0,3+0,25) = 0,31 моль/л
Задача 27
Определить буферную емкость буфера, состоящая из 0,06 молей эквивалентов соли и 0,06 молей эквивалентов основания, если к 1 л буфера добавили 10 мл 01,н НCl (рКоснов.=4,75).
Bарианты ответов : 1) 3∙10^-3 , 2) 7∙10^-2 , 3) 10^-1.
Решение:
для щелочной буферной смеси рН = 14 – рКосн + lgCосн/Cсоли
соотношение слабого основания и его соли 1:1, поэтому lgCосн/Cсоли — 0 и рН буфера = рК осн. = 4,75.
[OH-] = Kb ∙ Cосн/Cсоли = Kосн ∙ 0,06/0,06 = Косн, рН=4,75
n(HCl) = CV = 0.01 ∙ 0.1 = 0.001 моль
Кислота одноосновная, поэтому z=1
При прибавлении 0,001 моль экв. к-ты Cосн = 0,059 н, Ссоли=0,061 н, [OH-] = Косн. ∙ 0,97,
рН=4,76,
ΔpH = 4,76-4,75 = 0,01
буферная емкость β – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу (ΔpH=1)
β = n / (z ∙ V ∙ ΔpH)
V(буфера) =1 л, z = 1
β = 0,001 / 0,01 = 0,1 моль-экв/л = 10^-1 моль-экв/л
Снежана,
Задача 28
Рассчитайте рН буферного раствора CH3COOH + CH3COONa, если концентрации кислоты и соли одинаковы, а объемы кислоты и соли 20 мл и 80 мл соотвтственно.
Решение:
Несмотря на то, что конц-и взятых растворов кислоты и соли одинаковы, их концентрации в полученном буферном растворе не одинаковы, т.к. они взяты в соотношении 1:4 (20 мл : 80 мл).
Для кислой буферной смеси рН = рКа – lgСк-ты/Ссоли
рКа(CH3COOH)= – lg Kа = – lg (1,75∙10^–5) = 4,76
рН = 4,76 – lg (20/80) = 5,36
Марина,
Задача 29
Для получения буферного раствора с pH = 5,76 к 1 л 1н раствора ацетата натрия необходимо добавить __ моль уксусной кислоты.
Решение:
для кислой буферной смеси рН=рКа – lg(Ск-ты/Ссоли)
рКа уксусной кислоты = 4,76
lg(Ск-ты/Ссоли) = рКа – рН = 4,76 – 5,76 = – 1
Cк-ты/Cсоли = nк-ты / nсоли = 10^– 1=0,1
1 л 1 н р-ра ацетата натрия содержит 1 моль соли
nк-ты = 0,1 nсоли = 0,1 моль
Задача 30
Чему будет равно pН раствора, если к 1 л воды прибавить 1 мл 5%-ого раствора муравьиной кислоты и 1 мл 5%-ного раствора едкого кали?
Решение:
в рез. реакции слабой кислоты со щелочью получим соль слабой кислоты:
НСООН + КОН → НСООК + Н2О
Если НСООН в избытке, получится кислая буферная смесь, содержащая слабую кислоту и ее соль.
Посчитаем кол-ва веществ:
n(в-ва) = m/M
m=m(p-pa) ∙ ω
m(p-pa)=V(p-pa) ∙ ρ
Отсюда: n(в-ва, моль)= V(p-pa, мл) ∙ ρ(г/мл) ∙ ω / M (г/моль)
n(HCOOH) = 1 ∙ 1,012 ∙ 0,05 / 46 = 1,10 ∙ 10^-3 моль
n(KOH) = 1 ∙ 1,041 ∙ 0,05 / 56 = 0,93 ∙ 10^-3 моль
По ур. реакции, кислота и щелочь реагируют в мольном соотношении 1:1, поэтому HCOOH в избытке, в рез. реакции образовались 0,93 ∙ 10^-3 моль формиата калия НСООК и остались в растворе 1,10 ∙ 10^-3 — 0,93 ∙ 10^-3 = 0,17 ∙ 10^-3 моль муравьиной кислоты.
Для кислой буферной смеси: рН = рКа– lgСкисл./Ссоли
С=n/V
V=1,002 л, однако оба в-ва находятся в одном и том же объеме раствора, поэтому вместо молярной конц-и можно подставить в выражение для расчета рН количества кислоты и соли в растворе:
рН = рКа– lg n кисл./n соли
рКа(НСООН)=3,75 (http://www.novedu.ru/ionkisl.htm)
рН = 3,75 – lg (0,93 ∙ 10^-3 / 0,17 ∙ 10^-3) = 3,75 – lg (0,93 / 0,17) = 3,01
Задачa 31
Вычислить pН 0.02 M растворов KOH и HCOOH (Ka=1.8 ∙ 10^-4), pH смеси по 50 мл и 100 мл этих растворов соответственно.
Решение:
KOH: для сильного основания рН = 14 рН + lg[ОН–] = 14 + lg 0,02
HCOOH: для слабой кислоты рН = ½ рКа – ½ lgСк-ты
рКа = – lg Ка
рН = – 0,5 ∙ lg (1,8 ∙ 10^–4) – 0,5 lg 0,02
При смешивании слабой кислоты со щелочью в отношении 2:1 получим эквимолярный (1:1) раствор слабой кислоты и ее соли, т.е. кислую буферную смесь:
KOH + HCOOH → HCOOK + Н2О
Для кислой буферной смеси рН = рКа – lgСк-ты/Ссоли
Для эквимолярного буф. р-ра Ск-ты : Ссоли = 1:1, lgСк-ты/Ссоли = 0, отсюда
рН = рКа = – lg (1,8 ∙ 10^–4)
Решение:
Если аммиак нейтрализовали на 50%, то получили эквимолярный (1:1) раствор аммиака (слабого основания) и его соли, т.е. щелочную буферную смесь (аммиачный буфер).
для щелочной буферной смеси рН = 14 – рКосн. + lgCосн./Cсоли
При соотношении кислоты и соли 1:1 lgCосн./Cсоли = lg 1 = 0
рН = 14 – рКосн. = 9,245
рОН = рКосн = — lg Кд осн. = 4,755
Задачa 33
К 40 мл 0,1 М раствора гидрофосфата калия добавлено 20 мл 0,1 М раствора соляной кислоты. Вычислите рН раствора (Кa1=7,1×10⁻³, Кa2=6,2×10^-8, Кa3=5,0×10^-13).
Как изменится рН буферного раствора, если прилить к нему 10 мл 0,1 М раствора гидроксида калия?
Решение:
К2НРО4 + HCl → КН2РО4 + КCl
2×10^-3 2×10^-3
После добавления 20 мл 0,1 М раствора соляной кислоты половина гидрофосфата калия превратилась в дигидрофосфат калия, так что раствор содержит эквимолярную смесь гидрофосфата калия и дигидрофосфата калия:
n(К2НРО4) = n(КН2РО4) = 0,04 ∙ 0,1/2 = 2×10^-3 моль
Образовалась фосфатная буферная смесь, в кот. ион Н2РО4ˉ играет роль кислоты, а ион НРО42– – сопряженного основания.
рН фосфатного буфера:
рН=рК (Н2РО4⁻) +lg[К2НРО4]/[КН2РО4] = рК (Н2РО4⁻) = – lgКa2=– lg(6,2×10^-8) = 7,21
При добавлении к раствору 10 мл 0,1 М КОН (1×10^-3 моль КОН ) в системе будет протекать реакция:
КН2РО4 + КОН ⇄ К2НРО4 + Н2О , или
Н2РО4– + ОН– ⇄ НРО42– + Н2О
Концентрация иона Н2РО4– уменьшится на 1×10^-3, а концентрация иона НРО42– увеличится на 1×10^-3.
т.к. все в-ва находятся в одном растворе, объем для них одинаков, и можно вместо концентраций использовать кол-ва вещ-в (моль).
Значение рН, соответствующее новому равновесию в системе:
рН=рК2 +lg([К2НРО4]/[КН2РО4]) = 7,21 + lg (3×10^-3 /1×10^-3) = 7,21 + lg3,0 = 7,69
След., добавление щелочи в исходный буфер приведет к изменению рН раствора:
ΔрН = 7,69 – 7,21 = 0,48
Решение:
HCl + NH3 → NH4Cl
n(HCl) = CV = 0,2 ∙ 0,02 = 0,004 моль
n(NH3) = CV = 0,25 ∙ 0,04 = 0,01 моль
В получ. р-ре 0,004 моль NH4Cl и 0,01– 0,004 моль = 0,006 моль NH3 не прореагировали.
Получилась буферная смесь слабого основания и его соли.
рН = 14 – рКосн. + lgCосн./Cсоли
Т.к. оба в-ва в одном р-ре (V=const), то можно вместо отношения конц-й подставить колд-ва в-в:
рН1 = 14 – 4,755 + lg(0,006 / 0,004) = 9,421
При добавления 20 мл 0,1 NH4Cl:
n(NH4Cl) = n1 + n2 = 0,004 + 0,02∙0,1) = 0,006 моль
рН2 = 14 – 4,755 + lg(0,006 / 0,006) = 9,245
ΔрН = 9,421 – 9,245 = 0,176
Биржан,
Задачa 35
Вычислить pH раствора, содержащего в 500 мл 6 гр CH3COOH и 8,2 гр CH3COONa.
Вычислить pH буферного раствора, если к 1 литру добавить 2 грамма NaOH.
Решение:
для кислой буферной смеси рН = рКа – lgСк-ты/Ссоли
С=n/V=m/MV (л)
C(CH3COOH) = 6 г / (60 г/моль ∙ 0,5 л)=0,2 моль/л
C(CH3COONa) = 8,2 г / (82 г/моль ∙ 0,5 л)=0,2 моль/л
рКа(CH3COOH)= 4,76 (http://www.novedu.ru/ionkisl.htm)
рН1 = 4,76 – lg(0,2/0,2) = 4,76
1 л буф. раствора содержит n=CV = 0,2 моль CH3COOH и 0,2 моль CH3COONa.
NaOH + CH3COOH → CH3COONa + Н2О
n(NaOH)=m/M=2/40=0,05 моль, в реакции прореагировали 0,05 моль CH3COOH и
образовались 0,05 моль CH3COONa.
По окончании реакции 1 л р-ра содержит 0,2+0,05=0,25 моль CH3COONa и 0,2–0,05 = 0,15 моль CH3COOH (образованной в реакции водой массой 0,05 ∙ 18=0,9 г можно пренебречь).
рН2 = 4,76 – lg(0,15/0,25) = 4,98
Задачa 36
Определите концентрацию ионов водорода и рН в растворе, содержащем 0,01 моль бензойной кислоты и 0,03 моль бензоата натрия.
Ответ: 2,09 ∙ 10^-5 моль/л; 4,68.
Решение:
Слабая кислота и ее соль образуют кислый буферный раствор, для которого:
рН = рКа – lgСк-ты/Ссоли.
Т.к. оба в-ва находятся в одном растворе, то V одинаков и Ск-ты/Ссоли = n к-ты/n соли.
рКа=4,2 (http://www.novedu.ru/ionkisl.htm)
рН = 4,2 – lg(0,01/0,03) = 4,68
[H+]=10^–рН = 10^–4,68 = 2,09 ∙ 10^-5 моль/л
Надя,
Задачa 37
К 25 мл 0,3 М раствора дигидрофосфата калия добавлено 20 мл 0,2 М раствора гидроксида калия. Вычислите pH раствора (К1 =7,1×10^-3, К2=6,2×10^-8, К3=5,0×10^-13).
Как изменится pH буферного раствора, если к нему прилить 8 мл 0,1М раствора соляной кислоты?
Решение:
КН2РО4 + КОН → К2НРО4 + Н2О
n(КН2РО4)=CV=0,3×0,025 = 7,5×10^-3 моль
n(КОН)=CV=0,2×0,020 = 4,0×10^-3 моль
После добавления 20 мл 0,2 М р-ра КОН 4,0×10^-3 моль дигидрофосфата калия превратилась в 4,0×10^-3 моль гидрофосфат калия, так что раствор содержит смесь обеих солей:
n(КН2РО4) = 3,5×10^-3 моль
n(К2НРО4) = 4,0×10^-3 моль
Образовалась фосфатная буферная смесь, в кот. ион Н2РО4ˉ играет роль кислоты, а ион НРО42– — сопряженного основания.
рН фосфатного буфера:
рН=рК (Н2РО4⁻) + lg[К2НРО4]/[КН2РО4]
Т.к. все в-ва находятся в одном растворе, объем для них одинаков, и можно вместо концентраций использовать кол-ва вещ-в (моль).
рН= – lgКa2 + lg[К2НРО4]/[КН2РО4] = – lg (6,2×10^-8) + lg(4,0×10^-3 / 3,5×10^-3)=7,27
При добавлении к раствору 8 мл 0,1М раствора соляной кислоты (0,8×10^-3 моль HCl) в системе будет протекать реакция:
К2НРО4 + HCl → КН2РО4 + КCl , или
НРО42– + H+ → Н2РО4–
Кол-во ионов НРО42– уменьшится на 0,8×10^-3 и станет 3,2×10^-3 моль, а кол-во ионов Н2РО4– увеличится на 0,8×10^-3 и станет 4,3×10^-3 моль.
Значение рН, соответствующее новому равновесию в системе:
рН=– lgКa2 +lg([К2НРО4]/[КН2РО4]) = 7,21 + lg (3,2×10^-3 /4,3×10^-3) = 7,21 + lg3,0 = 7,08
След., добавление щелочи в исходный буфер приведет к изменению рН раствора:
ΔрН = 7,08 – 7,27 = –0,19
Задачa 38
Рассчитать массу муравьиной кислоты с концентрацией 100%, которую необходимо добавить к 2 л формиата калия с концентрацией 2% и плотностью 1,02 г/см3, чтобы получить буферный раствор с рН=12, если рКк=3,62.
Решение:
Достаточное буферное действие проявляется в интервале рН = рК ± 1, поэтому приготовить формиатный буфер с рН = 12 невозможно, поскольку 12 > рКк + 1.
Это же показывает расчет:
Слабая кислота и ее соль образуют кислый буферный раствор, для которого:
рН = рКа– lg(Скисл/Ссоли)
lg(Скисл/Ссоли) = рКк – рН = 3,62 – 12 = –8,38
Ссоли = 1000ρω/М=1000 ∙ 1,02 ∙ 0,02 / 84,12 = 0,2425 моль/л
Ск-ты/0,2425 = 10^–8,38
Ск-ты = 0,2425 ∙10^–8,38 = 1,011∙10^–9 моль/л
m (НСООН) = Ск-ты ∙ V(р-ра) ∙ М = 1,011∙10^–9 ∙ 2 ∙ 46,02 = 9,300∙10^–8 г
Т.е. невозможно приготовить буферный раствор с рн=12 из муравьиной кислоты и ее соли.
Решение:
для кислой буферной смеси рОН = 14 – рКа + lgСк-ты/Ссоли
Т.к. оба вещества находятся в одном объеме раствора, то вместо конц-й можно использовать их кол-ва:
n = СV, n к-ты = 0,01∙0,1 = 0,001 моль, n соли = 0,01∙0,05 = 0,0005 моль
рКа(CH3COOH)= 4,76 (http://www.novedu.ru/ionkisl.htm)
рОН1 =14 – 4,76 + lg(0,001/0,0005) = 14 – 4,76 + lg2 = 9,54
а) NaOH + CH3COOH → CH3COONa + Н2О
n(NaOH)=0,025 ∙ 0,1 =0,0025 моль, поэтому в реакции прореагировала вся кислота и образовались еще 0,001 моль CH3COONa. По окончании реакции 175 мл р-ра содержат 0,0015 моль CH3COONa и 0,0015 моль NaOH.
CH3COONa в реатворе гидролизуется:
CH3COO– + НОН ⇆ CH3COOН + ОН–
Однако NaOH — сильное основание и будет подавлять гидролиз CH3COONa, смещая его влево. Поэтому рОН полученного раствора будет определяться концентрацией NaOH:
С=n/V=0,0015/0,175 = 8,571 ∙ 10^-3 моль/л
рОН2 = – lg[OH–] = 2,07
б) при добавлении воды обе конц-и — кислоты и соли — изменятся одинаково, и их соотношение не изменится, поэтому рОН не изменится (однако из-за разбавления буферная емкость раствора снизится).
Источник