Как получить ацетат аммония
Ацетат аммония, другое название аммоний уксуснокислый – соль, образованная слабой уксусной кислотой СН3СООН и слабым основанием гидроксидом аммония NH4OH. Ее эмпирическая формула C2H7NO2.Внешний вид – бесцветные кристаллы, очень хорошо растворяющиеся в воде.Весьма гигроскопична. Легко разлагается при температуре около 112 градусов, реакция приводит к образованию ацетамида (вещества с формулой С2H5 ON) и воды. Каким образом можно получить ацетат аммония?
Ацетат аммония получают в лабораторных условиях, например, путем взаимодействия концентрированной, то есть ледяной уксусной кислоты и аммония углекислого (другое название -карбонат аммония). Реакция протекает с образованием ацетата аммония и нестойкой угольной кислоты (Н2СО3), которая тут же разлагается на воду и углекислый газ.
Можно также прилить 80%-ю уксусную кислоту к 10%-му раствору аммиака (нашатырного спирта).Реакцию проводят при низких температурах, например, опустив колбу с реагентами в сосуд с колотым льдом, и при энергичном встряхивании. Фильтрат выпаривают, получая ацетат аммония.
Ацетат аммония можно в лабораторных условиях также получить из нитрила уксусной кислоты (ацетонитрила), при нагревании с водой. Реакция протекает таким образом:
СН3СN + 2H2O=CH3COONH4
В промышленных условиях, основной способ производства ацетата аммония – реакция уксусной кислоты с водным раствором аммиака (аналог лабораторного способа номер 2).Таким образом, получают либо разбавленный продукт разной степени концентрации (для использования в качестве антиобледенителей, например), либо подвергают его последующему выпариванию, осушке и очистке.
Некоторое количество ацетата аммония, в качестве побочного продукта, получается также при химической обработке древесины аммиаком, в результате диацилирования целлюлозы.
Источник
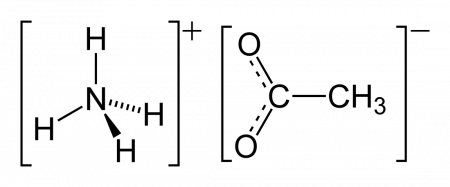
Ацетат аммония
| Ацетат аммония | |
|---|---|
 | |
| Систематическое наименование | Ацетат аммония |
| Хим. формула | C2H7NO2 |
| Рац. формула | CH3COONH4 |
| Состояние | кристаллическое |
| Молярная масса | 77,0825 г/моль |
| Плотность | 1,07 г/см³ |
| Температура | |
| • разложения | 112 °C |
| Растворимость | |
| • в воде | 148 г/100 мл |
| Кристаллическая структура | ромбическая сингония |
| Рег. номер CAS | 631-61-8 |
| PubChem | 12432 |
| Рег. номер EINECS | 211-162-9 |
| SMILES | |
| Кодекс Алиментариус | E264 |
| RTECS | AF3675000 |
| ChEBI | 62947 |
| ChemSpider | 11925 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат аммония — аммониевая соль уксусной кислоты. Пищевая добавка E264 (консервант).
Содержание
Получение
Ацетат аммония получают по реакциям:
Химические свойства
При сравнительно низкой температуре 112 °C (385 K) разлагается на воду и ацетамид:
В водном растворе подвергается гидролизу:
Применение
Соль слабой кислоты и слабого основания, ацетат аммония применяется:
- как биоразлагаемый реагент — антиобледенитель
- как буфер совместно с раствором уксусной кислоты. Особенностью данного буфера является его разложение при низких температурах без образования ионов.
- в органическом синтезе: реакция Кнёвенагеля.
- Растворенный в дистиллированной воде используется как коагулянт, осаждающий белки из раствора.
Источник
Что такое ацетат аммония?
Ацетат аммония (аммоний уксуснокислый) – это аммониевая соль CH3COOH (соль слабых кислоты и основания). Выглядит как твердая масса, сформированная не имеющими цвета кристаллическими образованиями с ромбической решеткой. Обладает гигроскопичностью. Вкус – едва выраженный щелочной. Растворение в H2O – хорошее (148 г/100 мл), также хорошо поддается растворению в этаноле, этерах; в диметилкетоне (ацетоне) растворяется слабо. Разлагается легко при небольшой температуре с образованием амида уксусной кислоты и воды.
Молярная масса – 77,0825 г/моль, плотность – 1,07 г/см³, t разложения – 112 °C. Формула: C2H7NO2.
Синтез
Чтобы создать данное вещество, необходимо соединить карбонат аммония и абсолютную этановую кислоту. В кислоту, охлаждаемую водой и активно помешиваемую, вливают 10 %-ный NH4OH. Когда появляется сильный запах аммиака, массу фильтруют, при необходимости осуществляют выпаривание на водяной бане до того момента, пока не образуется кристаллическая пленка. Далее следует отстаивание выпавших кристаллов на воронке Бюхнера и беспромедлительное перемещение в плотно закрывающуюся емкость.
Применение
Ацетат аммония – это материал, важный для многих промышленных отраслей, в каждой из которых ему отведена особая роль.
В пищепроме он используется как добавка к пище E264 из группы консервантов, благодаря которой можно достичь сохранности пищевых продуктов путем остановки и прекращения репродуцирования бактерий и грибков, провоцирующих болезни человека. Одна из наиболее частых задач, для выполнения которых задействуется – регулировка созревания вин. К тому же, может выступать солью-плавителем, благодаря способности смягчать кислый вкус CH3COOH в пище.
В медицине применяется как лекарство с мочегонными характеристиками.
При окрашивании шерсти выступает протравой.
В состав средств, предотвращающих локальное обледенение, входит как биологически разлагаемый реактив.
Вместе с уксусной кислотой является компонентом буферных растворов. Особенность его в этой роли – разложение при малой температуре без формирования ионов.
В органическом синтезе этот реагент находит применение в реакции Кневенагеля.
В аналитической химии служит коагулянтом. Если растворить данное вещество в очищенной водной среде, можно осаждать белки из растворов.
Такая широта использования объясняется доступностью этого соединения и его невысокой стоимостью.
Ацетат аммония и безопасность
Продукт в полной мере усваивается организмом, но кислота, освобождающаяся в ходе реакции, может незначительно и неспецифически раздражать. Разрешенная к употреблению суточная доза не установлена.
Применение этой соли в технических целях требует обязательного соблюдения правил безопасности. Как и множество иных химических веществ, данное может провоцировать аллергии и обжигать кожу. Поэтому важно избегать прямого контакта с телом. Если этого не удалось достичь (уксуснокислый аммоний попал на кожу, в глаза или дыхательные пути), промойте пораженный участок водой и обратитесь к доктору.
Теперь вы знаете, что такое ацетат аммония и как с ним следует обращаться. Остались вопросы по поводу применения? Обращайтесь!
Источник
Acetyl
Это пилотный ролик из серии об органических реакциях.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Источник |







