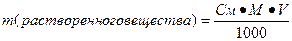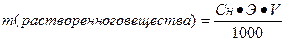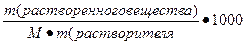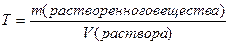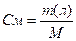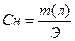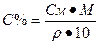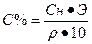Как приготовить децимолярный раствор
Концентрация растворов
Концентрацией раствора называется количество (масса или объем) растворенного вещества, содержащееся в определенном количестве (массе или объеме) раствора или растворителя. Ее выражают различными способами. В химии наиболее часто применяются следующие способы:
1. Процентная концентрация по массе — это отношение массы растворенного вещества к массе всего раствора, умноженное на 100. Если раствор состоит из компонентов А и В, то процент компонента А вычисляется по формуле:
где а и b — массовые количества каждого компонента раствора. Например, 5%-ный раствор гидроксида натрия содержит 5 г гидроксида натрия в 100 г раствора, или, что то же самое, 5 г гидроксида натрия приходится на 100 — 5 = 95 г воды. Процентная концентрация — безразмерная величина.
2. Молярная концентрация, или молярность, выражается числом молей растворенного вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один моль растворенного вещества, называется молярным. Если в 1 л раствора содержится 0,1 моль вещества, то он называется децимолярным, 0,01 моль-сантимолярным, 0,001 моль-миллимолярным. Размерность молярной концентрации-моль/л.
Молярность раствора обычно обозначается буквой М. Например, 1 М NaOH — молярный раствор гидроксида натрия, 1 л такого раствора содержит 40 г NaOH; 0,01 М NaOH — сантимолярный раствор, 1 л его содержит 0,01 моль, т.е. 0,4 г NaOH, и т.д. Чтобы приготовить, например, децимолярный раствор гидроксида натрия, надо взвесить 0,1 моль его, т. е. 4 г внести в литровую мерную колбу, на горлышке которой отмечен объем, точно равный 1 л, добавить воды до полного растворения вещества и затем раствор довести до метки (нижняя часть мениска должна касаться метки) и тщательно перемешать.
3. Моляльная концентрация, или м о-ляльность — это число молей растворенного вещества, содержащихся в 1 кг растворителя. Например, одномоляльный водный раствор серной кислоты состоит из 98 г кислоты и 1 кг воды. Если в 1 кг воды растворено 0,5/моля вещества, то такой раствор называется полумоляльным. Размерность моляльной концентрации — моль/кг. Моляльность обычно обозначается буквой m.
4. Нормальная концентрация, или нормальность, выражается числом эквивалентов вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один эквивалент (экв) растворенного вещества, называется нормальным. Если в 1 л раствора содержится 0,1 экв вещества, то он называется децинормальным, 0,01 экв-сантинормальным, 0,001 экв-миллинормальным. Нормальность обычно обозначается буквой н. (иногда N).
Так, например, 1 н. H2SO4 — нормальный раствор серной кислоты, 1 л такого раствора содержит 1 экв, т.е. 49 г H2SO4; 0,01 н. NaOH-сантинормальный раствор гидроксида натрия, 1 л его содержит 0,01 экв, т.е. 40/100 = 0,4 г NaOH, и т.д.
Нормальный раствор готовится аналогично молярному.
Источник
Как приготовить децимолярный раствор
§7.7 Концентрация раствора.
На практике часто приходится иметь дело с растворами, имеющими строго заданное содержание в них растворенного вещества . Приведем несколько примеров.
Во-первых, это приготовление различных лекарственных растворов. Если в аптеке случайно произойдет ошибка с количеством лекарства в его растворе, то последствия могут быть самыми плачевными.
Во-вторых, многие химические реакции проводят в растворах. И здесь ошибки могут приводить к печальным результатам. Например, если фотограф ошибется при растворении проявителя, то фотографии либо не проявятся, либо будут испорчены. Другой пример: если залить в аккумулятор раствор, в котором содержание серной кислоты будет меньше или больше требуемого, то аккумулятор либо не будет работать, либо выйдет из строя.
Еще один пример из лабораторной практики. Для получения бромистого калия (KBr) взяли два раствора: HBr и KOH. Из-за ошибки при приготовлении растворов гидроксид калия KOH добавили в воду в гораздо большем количестве, чем это требовалось для реакции обмена:
H Br + K OH = K Br + H 2 O
В результате полученный водный раствор KBr оказался безнадежно испорченным примесью непрореагировавшего, очень едкого гидроксида калия KOH.
Во всех перечисленных случаях было не учтено или нарушено заданное содержание вещества в растворе. Давайте разберемся в том, как правильно выражать это содержание и как правильно готовить раствор, если содержание вещества в растворе задано.
Один из способов выражения количества вещества в растворе – задание МАССОВОЙ ДОЛИ РАСТВОРЕННОГО ВЕЩЕСТВА .
Массовая доля растворенного вещества – это отношение массы растворенного вещества m 1 к общей массе раствора m, выраженное в процентах.
Пример 1. Для лечения гипертонической болезни (повышенное давление) применяют 25%-ный раствор сульфата магния MgSO 4 . Это означает, что в 100 г такого раствора содержится 25 г MgSO 4 . Здесь выделено слово “раствора”. Действительно, если мы взвесим 25 г сульфата магния и просто растворим в 100 г воды, то нужного нам раствора не получим.
Как же приготовить 25%-ный раствор? Надо взвесить на весах 25 г безводного сульфата магния и отмерить мензуркой 75 мл воды (либо взвесить на весах 75 г воды, что одно и то же). Затем сульфат магния надо высыпать в воду и перемешать до полного растворения. Получится 100 г раствора (25 г + 75 г = 100 г), в котором массовая доля сульфата магния составляет точно 25 %.
** Если для взвешивания 25 г MgSO 4 не найдется безводной соли, а в наличии окажется только более распространенный кристаллогидрат MgSO 4 . 7H 2 O, то необходимо взять больше соли. Предварительно следует рассчитать, в каком количестве MgSO 4 . 7H 2 O содержится 25 г MgSO 4 и взвесить именно это рассчитанное количество MgSO 4 ·7H 2 O. Соответственно, на приготовление такого раствора пойдет меньше воды, потому что часть ее уже имеется в кристаллогидрате.
Пример 2. Для заливки в новый автомобильный аккумулятор нужен 36%-ный раствор серной кислоты. Это означает, что в 100 г такого раствора содержится 36 г серной кислоты и 64 г воды (100 г — 36 г = 64 г.). Массовая доля серной кислоты в таком растворе составляет 36%.
Разумеется, 100 г раствора – слишком маленькое количество для автомобильного аккумулятора, поэтому приготовим 10 кг раствора. Для этого увеличим все цифры в 100 раз. Итак, нам потребуется взвесить на весах (36 г х 100) = 3600 г или 3,6 кг крепкой (безводной) серной кислоты и отмерить (64 г х 100) = 6400 г или 6,4 л дистиллированной воды.
Осторожно смешаем серную кислоту с водой (происходит сильный разогрев). Получим 10 кг 36%-ного раствора серной кислоты, который после охлаждения можно заливать в аккумулятор.
** Водитель, который не очень усердно изучал в школе химию, может легко ошибиться, взяв вместо 3,6 кг серной кислоты 3,6 л серной кислоты. В этом случае аккумулятор будет испорчен, потому что количество H 2 SO 4 в растворе окажется намного больше требуемого.
Дело в том, что серная кислота – довольно «тяжелая» жидкость, ее плотность 1,84 кг/л. Можно подсчитать, какой объем займет серная кислота массой 3,6 кг:
1 л H2 SO 4 весит 1,84 кг (плотность серной кислоты)
х л H2 SO 4 весят 3,6 кг
Отсюда х = 1 л . 3,6 кг/1,84 кг = 1,956 л – такой объем (меньше двух литров!) занимает концентрированная кислота весом 3,6 кг.
Массовую долю растворенного вещества называют также ПРОЦЕНТНОЙ КОНЦЕНТРАЦИЕЙ раствора.
Концентрация – это относительное количество растворенного вещества в растворе.
Помимо процентной концентрации, часто удобно пользоваться МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ .
Молярная концентрация С – это отношение количества растворенного вещества v (в молях) к объему раствора V в литрах.
Единица молярной концентрации – моль/л. Зная число молей вещества в 1 л раствора, легко отмерить нужное количество молей для реакции с помощью подходящей мерной посуды.
В качестве примера рассмотрим получение нерастворимого в воде хлорида серебра (AgCl) с помощью реакции обмена:
AgNO 3 + NaCl = Ag Cl (осадок) + Na NO 3
Кстати, не нужно запоминать, какие соли растворимы, а какие нерастворимы в воде. Для этого существует таблица растворимости (теперь она есть и в меню левого окна).
Допустим, в лаборатории имеется раствор AgNO 3 , концентрация которого 1 моль/л. Это означает, что в 1 л такого раствора содержится 1 моль нитрата серебра.
По уравнению реакции на 1 моль AgNO 3 нужен 1 моль NaCl. Следовательно, если мы смешаем одинаковые объемы растворов AgNO 3 и NaCl одинаковой концентрации 1 моль/л, то реакция пройдет до конца и в реакционной колбе окажется только раствор нитрата натрия (NaNO 3 ) в воде, а на дно сосуда выпадет осадок хлорида серебра AgCl. При этом исходных соединений в сосуде не останется.
Но как приготовить для реакции нужный раствор NaCl ? Для этого существуют специальные мерные колбы (рис. 7-4).
Рис. 7-4. Последовательность приготовления молярного раствора хлорида натрия (1моль/л NaCl): а) берут мерную колбу емкостью 1 л; б) помещают в колбу навеску кристаллического NaCl. в) в колбу добавляют немного дистиллированной воды, растворяют кристаллы и доливают раствор водой до метки 1 л, после чего тщательно перемешивают.
Мерная колба представляет собой сосуд с тонкой шейкой, на которой по стеклу нанесена кольцеобразная метка. Если заполнить мерную колбу жидкостью до метки, то ее объем составит ровно 1 л. Возьмем такую колбу и приступим к приготовлению нужного нам раствора NaCl.
Молекулярный вес NaCl составляет (23 + 35,5) = 58,5. Следовательно, молярная масса NaCl (масса 1 моль) равна 58,5 г. Взвесим это количество NaCl на весах и поместим кристаллы в мерную колбу. Затем добавим немного воды и растворим кристаллы, покачивая колбу. Когда вся соль растворится, дольем раствор водой до метки. Мерные колбы делают таким образом, что объем раствора достигает точно 1 л, когда водный мениск (уровень воды, слегка изогнутый силами поверхностного натяжения) касается метки своей нижней частью. После этого раствор аккуратно перемешаем.
** Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М. Например, раствор концентрации 1 М содержит 1 моль вещества на литр раствора. Такой раствор называют МОЛЯРНЫМ . Раствор концентрации 0,1 М содержит 0,1 моль вещества на литр раствора и называется ДЕЦИМОЛЯРНЫМ . Растворы концентрации 0,01 М (или 0,01 моль на литр) иногда называют САНТИМОЛЯРНЫМИ .
Итак, мы приготовили раствор NaCl , концентрация которого составляет 1 моль/л, то есть одномолярный или просто молярный раствор.
Молярные концентрации в общем виде иногда обозначают следующим образом:
C NaCl = 1 моль/л
При смешивании любых равных объемов молярных растворов AgNO 3 и NaCl всегда будет получаться только раствор NaNO 3 в воде и осадок AgCl , не содержащие примеси ни одного из исходных реагентов. Отфильтровав осадок и промыв его водой, мы получим чистую соль AgCl (она в воде практически не растворяется). Упарив отфильтрованный раствор, мы получим только чистый нитрат натрия NaNO 3 . Это не удивительно, потому что смешивая равные объемы растворов, мы берем одинаковое количество молей (или частей моля) реагирующих веществ. В них содержится одинаковое количество молекул AgNO 3 и NaCl , которые реагируют между собой без остатка.
На фотографии слева показан опыт, который мы обсуждаем. Видно, как при смешивании растворов исходных солей выпадает белый осадок AgCl.
Если бы мы взяли не молярные, а, например, 10%-ные растворы AgNO 3 и NaCl (одинаковые объемы), то в них бы содержалось разное число молекул этих веществ и одна из этих солей не израсходовалась бы полностью и осталась в растворе. Какая же из двух солей оказалась бы в избытке? Та, число молей которой больше. Это будет NaCl – соль с меньшим молекулярным весом, поскольку в одинаковой массе солей число более легких молекул (и молей) NaCl оказывается б о льшим.
Каждый способ выражения концентрации раствора удобен в зависимости от цели, которую преследует химик или технолог. Процентные концентрации более удобны в технике, медицине, экологии. Молярные концентрации чаще встречаются в лабораторной практике.
Источник
Концентрация. Способы выражения концентрации



Концентрация –показывает, сколько вещества растворено в данном растворе или растворители.
Концентрации вещества можно выразить:
I. Массовая доля (w%), процентная концентрация (С%) – показывает сколько единиц массы вещества растворено в 100 единицах массы раствора (количество грамм растворенного вещества в 100 граммах раствора).
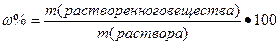
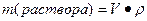
где V – объем раствора, P- плотность раствора.
Нахождение массы растворенного вещества:
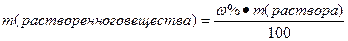
- 5% раствор поваренной соли.
Это значит, что в 100 грамм этого раствора содержится 5 грамм поваренной соли и 95 грамм воды.
- Какова массовая доля соли в растворе, если в 200 г воды растворили 50 г соли?
| Дано | Решение |
| m соли = 50 грамм m воды = 200 грамм Найти: w% ? | 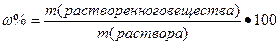 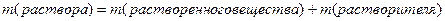
2. |
- Какие массы поваренной соли и воды надо взять для приготовления 500 г раствора с массовой долей соли в нем 4%.
- В 100 г воды растворили 31,6 г нитрата калия. Рассчитайте массовую долю растворенного вещества в растворе этой соли.
- Рассчитайте массу сахара и массу воды которые нужно взять для приготовления 600 г сиропа с массовой долей сахара в нем 10%.
- В 800 г раствора сульфата меди содержится 40 г сульфата меди. Вычислите массовую долю сульфата меди в растворе.
- Какую массу нитрата серебра надо растворить в 250 г воды для приготовления 2% — ного раствора.
II. Молярная концентрация раствора (См) – количество вещества растворенного в 1000 мл раствора (1 л) (выражается числом молей в одном литре раствора).
1М одномолярный раствор = 1 моль/л
2 М двумолярный раствор =2 моль/л
0,1 М децимолярный раствор
0,2 М двудецимолярный раствор
0,01 М сантимолярный раствор
0,001 М милимолярный раствор
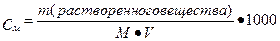
где М – молярная масса растворенного вещества, V – объем полученного раствора
или 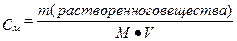
Нахождение массы растворенного вещества:
- Приготовить децимолярный раствор сульфата натрия.
m(Na2SО4)=142 
Отвешиваем 14,2 г сульфата натрия, высыпаем в мерную колбу и доливаем воды до 1 литра.
2. Приготовить 600 мл 2 м раствора карбоната натрия.
| Дано | Решение |
| V = 600 мл См =2м Найти m соли (Na2СО3) ? | 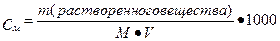 М Na2СО3= 106 г/моль m= М Na2СО3= 106 г/моль m= 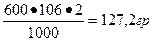 Отвесить 127,2 г соли, высыпать в мерную колбу и долить воды до метки 600. Отвесить 127,2 г соли, высыпать в мерную колбу и долить воды до метки 600. |
1. Сколько грамм тиосульфата натрия Na2S2O3 
2. 66,8 г серной кислоты растворили в 133 г воды. Определите молярную концентрацию если раствор с плотностью 1,25 гр/см 3 .
3. Вычислите молярность раствора, приготовленного в мерной колбе на 500 мл из 4,98 г КI.
4. Рассчитайте массу вещества Na2СО3, содержащегося в 200 мл 0,24 М раствора.
5. Определите молярную концентрацию вещества в растворе CuSO4, приготовленном в мерной колбе на 500 мл из 11,25 г кристаллогидрата CuSO4 
Какая масса сульфата бария ВаSO4 получится при сливании 200 мл 0,5 м раствора сульфата алюминия Al2(SO4)3 и 150 мл 2 м раствора хлорида бария ВаСl2
III. Нормальная концентрация или эквивалентная (Сн, Сэ, СN) –выражается числом эквивалентов растворенного вещества в 1 л раствора.

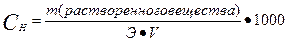
где Э – эквивалент растворенного вещества, V – объем
или 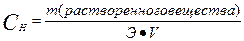
Нахождение массы растворенного вещества:
Эквивалент – реальная или условная частица вещества, которая химически равноценна одному иону водорода (для обменных реакций) или одному электрону (для окислительно – восстановительных реакций). Фактически это частица, обладающая одной единицей валентности или оперирующая одним электроном.
Эквиваленты сложных веществ находятся:
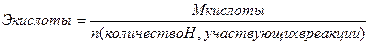
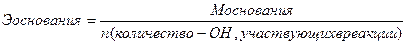
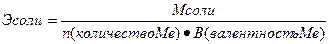
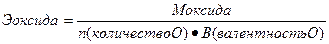
- Приготовить 400 мл сантинормального раствора сульфата натрия.
Сн=0,01 н
М(Na2SO4)=142 г/моль преобразуем формулу
Э(Na2SO4)=71
m(Na2SO4)=0,01 
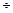
2. Определить нормальную концентрацию раствора содержащего 30 г хлорида алюминия в 500 мл раствора.
| Дано | Решение |
| m (AlCl3)=30 г V=500 мл Найти Сн-? | 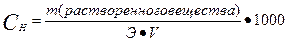 Э (AlCl3)= Э (AlCl3)= 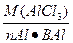 Э (AlCl3)=133,5:3=44,5 Сн= Э (AlCl3)=133,5:3=44,5 Сн= 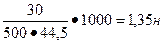 |
- Сколько грамм азотной кислоты содержится в 2 л ее 0,1 н раствора?
- Сколько гр ортофосфорной кислоты нужно для приготовления 10 мл 0,02 н раствора?
- Какой объём 0,5 н раствора можно приготовить из 24,44 г кристаллогидрата хлорида бария ВаСl2
2 H2O?
- Для нейтрализации 25 мл раствора серной кислоты потребовалось 40 мл 0,1 н раствора гидроксида натрия. Определите Сн раствора кислоты.
- Какую реакцию имеет раствор, полученный при смешивании 100 мл 0,1 н раствора серной кислоты с 50 мл 0,5 н раствора гидроксида калия? Сколько грамм образуется сульфата калия?
IV. Моляльная концентрация (Сm)– выражается числом молей растворенного вещества в 1000 гр растворителя
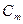
V. Титр (T)- сколько грамм растворенного вещества содержится в 1 мл раствора.
Переходы концентраций.
Переход от процентной концентрации к молярной концентрации:
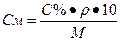
Переход от процентной концентрации к нормальной концентрации:
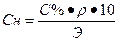
Переход от молярной концентрации к процентной концентрации:
Переход от нормальной концентрации к процентной концентрации:
1. Определить нормальную концентрацию 20 % — ного раствора серной кислоты , если ρ=1,14 г/см 3 .
| Дано | Решение |
| С%=20 % ρ (H2SO4) = 1,14 г/см 3 Найти Сн-? | 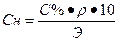 , , 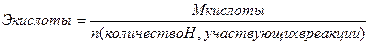 Э (H2SO4) = Э (H2SO4) = 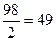 Сн = Сн = 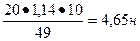 Ответ: Сн=4,65 н Ответ: Сн=4,65 н |
1. Найти молярную концентрацию 60 % — ного раствора азотной кислоты, если плотность раствора равна 1,373 г/см 3 .
2. Определить С% двунормального раствора серной кислоты с плотностью 1,063 г/см 3 .
3. 66,8 г серной кислоты плотностью = 1,25 г/см 3 растворили в 133,2 г воды. Определите С%, См, Сн .
4. Какой объём 68% — ного раствора азотной кислоты плотностью 1,4 г/см 3 требуется для приготовления 50 мл 2 н раствора?
5. Найдите молярную концентрацию вещества Na2SO4 в 12% — ном растворе с плотностью 1,11 г/мл.
Источник




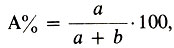



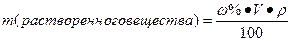
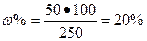 Ответ: 20 % раствор
Ответ: 20 % раствор