- Гидроксид калия: способы получения и химические свойства
- Способы получения
- Качественная реакция
- Химические свойства
- Как получить гидроксида натрия и гидроксида калия
- Изготовление.
- Здравствуйте! Как можно получить гидроксид калия, в домашних условиях? Только легкий способ.
- Гидроксид калия ГОСТ 24363-80
- Содержание
- Химические свойства
- Применение
- Производство
- Опасность
Гидроксид калия: способы получения и химические свойства
Гидроксид калия KOH — неорганическое соединение. Белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 56,11; относительная плотность для тв. и ж. состояния d = 2, 044; tпл = 404º C; tкип = 1324º C
Способы получения
1. Гидроксид калия получают электролизом раствора хлорида калия :
2KCl + 2H2O → 2KOH + H2 + Cl2
2. При взаимодействии калия, оксида калия, гидрида калия и пероксида калия с водой также образуется гидроксид калия:
2K + 2H2O → 2KOH + H2
2KH + 2H2O → 2KOH + H2
3. Карбонат калия при взаимодействии с гидроксидом кальция образует гидроксид калия:
Качественная реакция
Качественная реакция на гидроксид калия — окрашивание фенолфталеина в малиновый цвет .
Химические свойства
1. Гидроксид калия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид калия реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид калия реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид калия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид калия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и выделяется водород:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида калия:
Сера взаимодействует с гидроксидом калия только при нагревании:
6. Гидроксид калия взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2KOH + 2Al + 6Н2О = 2K[Al(OH)4] + 3Н2
7. Гидроксид калия вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом калия с образованием хлорида калия и осадка гидроксида меди (II):
2KOH + CuCl2 = Cu(OH)2↓+ 2KCl
Также с гидроксидом калия взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида калия образуются хлорид калия, аммиак и вода:
NH4Cl + KOH = NH3 + H2O + KCl
8. Гидроксид калия проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
KOH ↔ K + + OH —
9. Гидроксид калия в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4KOH → 4K + O2 + 2H2O
Источник
Как получить гидроксида натрия и гидроксида калия
Получение NaOH (Гидроксид натрия) и KOH (Гидроксид Калия).
Опишу, как получить NaOH из Na2CO3 (Кальцинировання сода). Для калия
аналогично, только вместо соды взять поташ (весовые доли будут другие).
Общие сведения.
NaOH – едкий натрий. Входит в состав чистящего средства «Крот».
Применяется при изготовлении хлората калия методом электролиза,
глицерина, а также некоторых ВВ. Других его применений в пиротехнике я, к
сожалению не знаю. На его основе можно попробовать сделать манганат
натрия, который может заменять марганцовку в некоторых составах
(например, с магнием). Лично я манганат натрия (Na2MnO4) не делал, но
думаю, что он имеет схожие с манганатом калия свойства, который здорово
жахнул в смеси с магнием.
1) Сода стиральная (Na2CO3).
2) Са(OH)2 – гашеная известь (лучше купить так называемую бордосскую смесь (медный купорос + Ca(OH)2)). Продается в садоводческих магазинах.
1) Воронка с фильтром
2) Колба или другой термостойкий сосуд.
3) Весы
4) Выпаривательный сосуд
Изготовление.
1. Отвесите 10гр Соды и 7гр Гашеной извести.
2. Растворите Соду в воде и подогрейте сосуд, чтобы вся сода растворилась.
3. Добавьте гашеную известь.
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
4. Отфильтруйте осадок (обычный мел) и выпарите раствор. 
5. Полученную гадость растолките в ступке.

Внимание!
Едкое вещество! Работайте только в перчатках!
Примечания по полученному реактиву:
Раствор NaOH надолго не оставляйте в открытой таре, а то он перейдет
обратно в соду, реагируя с углекислым газом, который входит в состав
воздуха.
Теоретические методы. (Не проверял).
Получение KOH
K2SO4 + Ca(OH)2 → CaSO4 + 2KOH.
СaSO4- гипс
Получение NaOH
Na2SO4 + Ca(OH)2 → CaSO4 + 2NaOH.
Эти методы не проверял. Теоретически все должно получится, только
конечный продукт будет чуть-чуть загрязнен гипсом, который немного
растворим в воде.
K2SO4 – продается как удобрение.
Источник
Здравствуйте! Как можно получить гидроксид калия, в домашних условиях? Только легкий способ.
На всякий случай: у меня подзарядка 4.5В, зарядное устройство отрезано и к двум проводам присоединён по одному гвоздю, один выделяет водород, другой хлор.
Хлопотно будет.
Самый лёгкий путь — по реакции K2CO3 + Ca(OH)2(насыщ. ) = CaCO3↓ + 2KOH, либо электролизом раствора KСl.
Если хотите электролиз, то для начала нужно найти нормальный источник постоянного тока. Зарядка для мобильника 4,5В — это явно не для получения ощутимых количеств щёлочи. Вообще, нужно смотреть на силу тока, а не напряжение. Найдите блок питания, дающий на выходе ну хотя бы не менее 1-3 ампер. Можно, к примеру, взять автомобильную зарядку, у них ток от 3-5 ампер и более.
Во-вторых, никаких гвоздей брать не не нужно, так как на аноде, где выделяется хлор, будет образовываться хлорид железа. А он запросто будет реагировать с образующимся гидроксидом калия, давая осадок Fe(OH)3. Поэтому нужны инертные электроды — угольные стержни из батареек, например.
Кроме того, даже с инертными электродами хлор будет реагировать с образующимся в растворе KOH, давая снова хлорид калия и гипохлорит калия. Поэтому вам нужно будет придумать, как максимально изолировать катод от анода, при этом, чтобы они не были слишком далеко друг от друга, так как сопротивление у раствора большое, и сила тока будет неизбежно падать с увеличением расстояния между электродами. .
Раствор хлорида калия готовьте насыщенный, если хотите щёлочь приличной концентрации.
Все равно, действительно, проще купить KOH, или по реакции выше.
Можно купить в хозмаге «Крот» называется (для чистки труб) . Можно электролизом раствора хлорида калия собрать.
«Крот» — это едкий натр) NaOH ) а нужен KOH )
Любое сухое средство для очистки труб берем и читаем состав) он должен состоять из 2х слов: «Состав: Гидроксид натрия». Как правило чистый стоит дороже) недавно брал пакетик ) был за 35р и за 80р ) в том что за 35р натра всего 30% было.
Самый лёгкий способ нажечь всякого хлама досок и тд собрать золу закинуть в эмалированное ведро закипятить на электроплитке с водой поставить остывать дней на 5 ато и дольше отстоится получится жёлтый раствор это то что нужно если нужен сильно концентрированный то подвыпарить будет почти 38% щелочь очень едкая можно трубы чистить или использовать для получения поташа продувая через раствор углекислый газ получим карбонат калия выпарим получим поташ
Источник
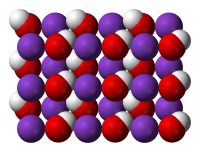
Гидроксид калия ГОСТ 24363-80
| Гидроксид калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Гидроксид калия |
| Традиционные названия | Кали едкое, каустический поташ |
| Хим. формула | KOH |
| Состояние | твёрдое |
| Молярная масса | 56,1056 г/моль |
| Плотность | 2,044−2,12 г/см³ |
| Т. плав. | 380−406 °C |
| Т. кип. | 1327 °C |
| Энтальпия образования | −425,8 кДж/моль |
| Энтальпия плавления | 7,5 кДж/моль |
| Энтальпия кипения | 128,9 кДж/моль |
| Давление пара | 1 ± 1 мм рт.ст. |
| Растворимость в воде | 117,9 г/100 мл |
| Растворимость в спирте | 38,7 (28 °C) |
| Показатель преломления | 1.409 |
| Рег. номер CAS | ГОСТ 24363-80 ГОСТ 9285-78 |
| Рег. номер CAS | 1310-58-3 |
| PubChem | 14797 |
| Рег. номер EINECS | 215-181-3 |
| SMILES | |
| Кодекс Алиментариус | E525 |
| RTECS | TT2100000 |
| ChEBI | 32035 |
| Номер ООН | 1813 |
| ChemSpider | 14113 |
| Пиктограммы СГС |  |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидроксид калия (лат. Kalii hydroxidum ) — неорганическое соединение с формулой KOH .
Тривиальные названия: едкое кали, каустический поташ, а также гидрат окиси калия, гидроокись калия, калиевая щёлочь, калиевый щёлок.
Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Содержание
Химические свойства
- Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
KOH + HCl ⟶ KCl + H2O
2KOH + H2SO4 ⟶ K2SO4 + 2H2O
- Взаимодействие с кислотными оксидами с образованием соли и воды:
2KOH + CO2 ⟶ K2CO3 + H2O 2KOH + SO3 ⟶ K2SO4 + H2O
- Взаимодействие с некоторыми непереходными металлами в растворе с образованием комплексной соли и водорода:
2Al + 2KOH + 6H2O ⟶ 2K[Al(OH)4] + 3H2↑
Гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что дает продукт высокой чистоты, не содержащий примеси хлоридов:
2KCl + 2H2O ⟶ 2KOH + H2↑ + Cl2↑ 
Применение
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы в которых он используется:
- нейтрализация кислот,
- щелочные элементы,
- катализ
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- переработка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук.
В пищевой промышленности обозначается как пищевая добавка E525. Используется как регулятор кислотности, в качестве осушителя и средства для снятия кожицы с овощей, корнеплодов и фруктов. Он также используется в качестве катализатора в некоторых реакциях.
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
Популярное средство в производстве косметической продукции, вступая в реакцию с жирными маслами расщепляется и омыливает при этом масла.
В циркониевом производстве используется для получения обесфторенного гидроксида циркония.
В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
Используется в качестве электролита в щелочных (алкалиновых) батарейках.
Также применяется в ресомации — альтернативном способе «захоронения» тел.
5 % раствор гидроксида калия используется в медицине для лечения бородавок.
В фотографии используется как компонент проявителей, тонеров, индикаторов тиосульфатов и для удаления эмульсии с фотографических материалов.
Производство
В промышленном масштабе гидроксид калия получают электролизом хлористого калия.
Возможны три варианта проведения электролиза:
- электролиз с твердым асбестовым катодом (диафрагменный метод производства),
- электролиз с полимерным катодом (мембранный метод производства),
- электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно — в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза. Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути. Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи:
- исключается стадия сжижения и испарения хлора,
- водород используется для технологического пара, исключаются газовые выбросы хлора и его соединений.
Мировым лидером в области мембранных технологий является японская компания «Асахи Касэй».
В России производство гидроксида калия осуществляется мембранным (ООО «Сода-Хлорат») методом.
Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкое кали, так и каустическую соду. Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется. При этом в случае изменений на рынке возможен безболезненный перевод электролизёров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году.
Опасность
Очень сильная щёлочь. В чистом виде действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия в глаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения.
Источник






