- Хлорид серебра, характеристика, свойства и получение, химические реакции
- Хлорид серебра, характеристика, свойства и получение, химические реакции.
- Краткая характеристика хлорида серебра:
- Физические свойства хлорида серебра:
- Получение хлорида серебра:
- Химические свойства хлорида серебра. Химические реакции хлорида серебра:
- Применение и использование хлорида серебра:
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Все способы получения хлорида серебра
- Хлорид серебра, характеристика, свойства и получение, химические реакции
- Хлорид серебра, характеристика, свойства и получение, химические реакции.
- Краткая характеристика хлорида серебра:
- Физические свойства хлорида серебра:
- Получение хлорида серебра:
- Химические свойства хлорида серебра. Химические реакции хлорида серебра:
- Применение и использование хлорида серебра:
- Справочники
- Мировая экономика
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Хлорид серебра I
- Содержание
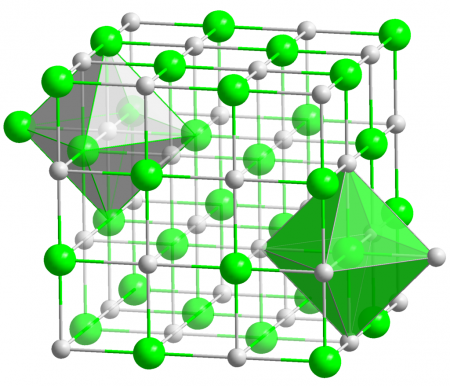
- Молекулярная и кристаллическая структура
- Физические свойства
- Получение
- Химические свойства
- Применение
- Безопасность
Хлорид серебра, характеристика, свойства и получение, химические реакции
Хлорид серебра, характеристика, свойства и получение, химические реакции.
Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра:
Хлорид серебра – неорганическое вещество белого цвета. При плавлении становится оранжево-желтым. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
В расплавленном виде хорошо пристает к стеклу , кварцу и металлам .
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) |
серебро хлористое (рус.)
хлораргирит (рус.)
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
- 1. взаимодействия нитрата серебра и хлорида калия:
В ходе реакции используется разбавленный раствор хлорида калия.
- 2. взаимодействия нитрата серебра и хлорида натрия:
В ходе реакции используется разбавленный раствор хлорида натрия.
- 3. взаимодействия нитрата серебра и хлорида кальция:
- 4. взаимодействия серебра и хлорида железа (III):
- 5. взаимодействия серебра и хлора:
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка :
2AgCl + Zn = ZnCl2 + 2Ag.
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария :
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
В результате реакции образуются хлорид калия, серебро , кислород и вода .
5. реакция взаимодействия хлорида серебра и сульфида натрия:
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
AgCl + NaI ⇄ AgI + NaCl.
В результате реакции образуются йодид серебра и хлорид натрия. Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия :
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
В результате реакции образуются серебро , хлорид натрия, оксид углерода (IV) и кислород.
8. реакция взаимодействия хлорида серебра и нитрата бария:
В результате реакции образуются хлорид бария и нитрат серебра. Реакция протекает в растворе жидкого аммиака .
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия :
В результате реакции образуются хлорид калия, серебро , кислород и вода .
10. реакция разложения хлорида серебра:
В результате реакции образуются серебро и хлор . Реакция протекает при комнатной температуре под действием светового излучения.
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов ;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.
Примечание: © Фото https://www.pexels.com, https://pixabay.com

хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (106 467)
- Экономика Второй индустриализации России (102 453)
- Программа искусственного интеллекта ЭЛИС (27 373)
- Метан, получение, свойства, химические реакции (23 490)
- Этилен (этен), получение, свойства, химические реакции (22 358)
- Природный газ, свойства, химический состав, добыча и применение (20 936)
- Крахмал, свойства, получение и применение (20 406)
- Целлюлоза, свойства, получение и применение (19 239)
- Пропилен (пропен), получение, свойства, химические реакции (18 775)
- Прямоугольный треугольник, свойства, признаки и формулы (18 593)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Все способы получения хлорида серебра
Хлорид серебра, характеристика, свойства и получение, химические реакции
Хлорид серебра, характеристика, свойства и получение, химические реакции.
Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра:
Хлорид серебра – неорганическое вещество белого цвета. При плавлении становится оранжево-желтым. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
В расплавленном виде хорошо пристает к стеклу , кварцу и металлам .
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) |
хлораргирит (рус.)
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
- 1. взаимодействия нитрата серебра и хлорида калия:
В ходе реакции используется разбавленный раствор хлорида калия.
- 2. взаимодействия нитрата серебра и хлорида натрия:
В ходе реакции используется разбавленный раствор хлорида натрия.
- 3. взаимодействия нитрата серебра и хлорида кальция:
- 4. взаимодействия серебра и хлорида железа (III):
- 5. взаимодействия серебра и хлора:
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка :
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария :
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
В результате реакции образуются хлорид калия, серебро , кислород и вода .
5. реакция взаимодействия хлорида серебра и сульфида натрия:
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
В результате реакции образуются йодид серебра и хлорид натрия. Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия :
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
В результате реакции образуются серебро , хлорид натрия, оксид углерода (IV) и кислород.
8. реакция взаимодействия хлорида серебра и нитрата бария:
В результате реакции образуются хлорид бария и нитрат серебра. Реакция протекает в растворе жидкого аммиака .
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия :
В результате реакции образуются хлорид калия, серебро , кислород и вода .
10. реакция разложения хлорида серебра:
В результате реакции образуются серебро и хлор . Реакция протекает при комнатной температуре под действием светового излучения.
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов ;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.
Примечание: © Фото https://www.pexels.com, https://pixabay.com

хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
Справочники
Мировая экономика
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Хлорид серебра I
 |
наименование
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Содержание
Молекулярная и кристаллическая структура
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Источник