Как приготовить индикатор лакмус
Приготовление растворов индикаторов
и вспомогательных реактивов
Учителю химии и студенту на педагогической практике часто приходится готовить растворы индикаторов и вспомогательных реактивов. Порой на это уходит достаточно много времени; прописи по их приготовлению не всегда подходят для школьных условий. В связи с этим предлагаем ряд простых, безопасных и доступных рецептов, которые мы с успехом применяем в школе и на практических занятиях по методике преподавания химии.
1. Приготовление раствора метилового оранжевого. Отвесьте примерно 0,1 г индикатора и растворите его в 100 мл теплой дистиллированной воды. Окраска в кислой среде – красная, в щелочной – желтая, в нейтральной – оранжевая.
2. Приготовление раствора лакмоида (резорциновый синий). Отвесьте примерно 0,5 г индикатора и растворите в 100 мл раствора этанола с массовой долей спирта равной 80-90%. Окраска в кислой среде – красная, в щелочной – синяя, в нейтральной – фиолетовая.
3. Приготовление раствора фенолфталеина. Отвесьте около 0,5 г индикатора (можно взять лекарственную форму) и растворите в 100 мл раствора этанола с массовой долей спирта равной 50-60%. Окраска в кислой среде – бесцветная, в щелочной – малиновая, в нейтральной – бесцветная.
4. Приготовление раствора крахмала. Вскипятите 100 мл воды, добавив в нее предварительно чайную ложку поваренной соли. В фарфоровой чашке разотрите немного крахмала (1-2 г) с небольшим объемом воды (10-20 мл) до получения однородной жидкой массы. Полученную смесь вылейте в кипящий раствор соли и при перемешивании доведите его вновь до кипения. Когда жидкость станет прозрачной, добавьте в колбу еще 100 мл воды и охладите. Лучше всего хранить раствор на холоду в темной склянке. Соль в растворе увеличивает срок хранения раствора крахмала, который обычно быстро портится и плесневеет. Раствор крахмала используют как индикатор для обнаружения свободного иода, в присутствии которого появляется синяя окраска.
5. Приготовление иодкрахмального раствора. К раствору крахмала (см. рецепт 4) объемом 100 мл добавьте иодид калия массой примерно 0,5 г и перемешайте до растворения соли. Полученный раствор используется для обнаружения сильных окислителей, при взаимодействии с которыми выделяется свободный иод, дающий с крахмалом синее окрашивание.
6. Приготовление раствора ацетата свинца. В 100 мл воды, подкисленной 2-3 мл уксусной кислоты (во избежание гидролиза соли) растворите 1-2 г ацетата свинца. Полученный раствор используют для качественного определения сероводорода и сульфидов, в присутствии которых образуется черный осадок сульфида свинца.
7. Приготовление индикаторных бумажек. Нарежьте фильтровальную бумагу (лучше всего подойдет бумага невысокой плотности) на полоски шириной 4-5 см и длиной 8-10 см, смочите их в одном из полученных растворов (см. рецепты 1-6) и высушите в помещении свободном от аммиака, паров кислот и других летучих веществ. После высыхания разрежьте бумажки на мелкие полоски и поместите в закрывающиеся склянки с этикетками.
8. Приготовление индикаторной бумаги для обнаружения паров ртути в воздухе. Если в помещении была разлита ртуть или разбился ртутный термометр (градусник) следует провести анализ воздуха на содержание в нем паров ртути. Качественную пробу можно выполнить с помощью специальной индикаторной бумажки. Предварительно приготовьте растворы сульфата или хлорида меди ( II ) с массовой долей соли 5%, иодида калия (10%), сульфита натрия (2%).
Нарежьте полоски фильтровальной бумаги малой плотности (черная или белая лента) длиной 8-10 см и шириной 4-5 см и окуните их на несколько секунд в раствор соли меди. Дайте избытку жидкости стечь, слегка подсушите и окуните в раствор иодида калия. Бумага побуреет вследствие выделения иода, а в порах фильтра осадится иодид меди ( I )
Вновь дайте избытку раствора стечь и подсушите бумажку. Для удаления иода опустите бумажку в раствор сульфита натрия. Как только бурая окраска исчезнет, окуните несколько раз бумажку в чистую воду (для удаления всех растворимых веществ). Приготовленную таким образом бумажку (содержит в порах CuI ) высушите и сохраните в закрытых склянках.
Анализ основан на взаимодействии паров ртути и иодида меди ( I ) с образованием комплексного соединения Cu 2 [ HgI 4 ] красного цвета. Для проведения анализа бумажки оставляют в помещении на 5-6 часов на открытом месте. Если бумага не порозовеет, то содержание ртути в воздухе не превышает предельно допустимую концентрацию. Если же бумажка окрасится в розовый цвет, то есть основание для вызова санитарной службы и проведения более точных количественных исследований.
9. Приготовление хлорной воды (раствора хлора в воде). Можно получать хлорную воду традиционным способом, пропуская газообразный хлор через воду. Однако в учебных целях проще и безопаснее готовить раствор иначе. Налейте в колбу 10-20 мл раствора бытового хлорсодержащего отбеливающего средства (Белизна), разбавьте его водой в 2 раза и добавьте (осторожно!) несколько капель концентрированной соляной кислоты. Выделяющийся хлор насыщает исходный раствор, который в результате приобретает свойства хлорной воды. Раствор используют для учебных целей при демонстрации свойств хлора.
10. Получение бромной воды (раствора брома в воде). Можно получать бромную воду традиционным способом, насыщая воду жидким бромом. Однако в учебных целях проще и безопаснее готовить раствор иначе. К раствору бромида калия или натрия (50 мл; 5%) добавьте 2-3 мл хлорной воды. Выделяющийся бром растворяется в исходном растворе, в результате он приобретает свойства бромной воды, которые можно с успехом демонстрировать в учебном эксперименте.
11-12. Получение иодной воды (раствора иода в воде). Несколько капель аптечной иодной настойки растворите в 50 мл воды до получения раствора желто-соломенного цвета.
К раствору иодида калия или натрия (50 мл; 5%) добавьте 2-3 мл хлорной воды. Выделяющийся иод растворяется в исходном растворе, в результате он приобретает свойства иодной воды, которые можно с успехом демонстрировать в учебном эксперименте.
13. Получение сероводородной воды. Можно получать сероводородную воду традиционным способом, насыщая воду газообразным сероводородом. Однако в учебных целях проще и безопаснее готовить раствор иначе. Поместите в колбу Вюрца несколько кусочков сульфида железа, залейте его разбавленным раствором (2-5%) соляной кислоты. Газоотводную трубку соедините с промывалкой (5% CuSO 4 ) для дегазации избытка сероводорода и оставьте на ночь в вытяжном шкафу. На следующий день слейте прозрачную жидкость, которая обладает свойствами сероводородной воды и вполне пригодна для учебного эксперимента.
14. Получение известковой воды (раствор гидроксида кальция в воде). Растворимость гидроксида кальция в воде составляет всего 0,165 г вещества в 100 г воды. Готовят известковую воду, используя гашеную или негашеную известь.
Однако удобнее готовить раствор из металлического кальция. Добавьте к воде объемом 500 мл в колбе кусочек кальция массой около 1 г, закройте колбу, в которой проводите реакцию, ватным тампоном, смоченным разбавленным раствором щелочи, и оставьте на несколько часов. После того, как реакция закончится, и избыток гидроксида осадится, слейте прозрачный раствор в заранее приготовленный плотно закрывающийся сосуд. Известковая вода на воздухе быстро карбонатизируется вследствие взаимодействия гидроксида кальция с углекислым газом воздуха, поэтому перед ее использованием необходимо провести соответствующую проверку.
Не забывайте снабжать каждый приготовленный реактив соответствующей этикеткой с указанием даты приготовления.
Источник
LiveInternetLiveInternet
—Рубрики
- Рукоделие-hand made (67)
- работа с бумагой (49)
- новогодние поделки (5)
- фетр (3)
- библиотека (15)
- игрушки (6)
- рисование (3)
- лепка (2)
- вышивка (1)
- логопедия (10)
- дачные идеи (10)
- выпиливание лобзиком (6)
- выращивание и уход за растениями (1)
- для детей (образование) (4)
- красота и здоровье (3)
- православие (1)
- консервирование и другие заготовки на зиму (1)
- орхидеи (0)
- орхидеи (0)
- орхидеи (0)
- кулинарные рецепты (0)
- (0)
- букеты из конфет (3)
- валяние из шерсти (67)
- винтаж (3)
- все для детей (1)
- вязание (23)
- крючок (15)
- домашний уют (2)
- игрушки (21)
- изделия из лент (9)
- Вышивка лентами (3)
- КОМПЬЮТЕР и все что связано с ним/фотошоп (8)
- ЛиРу (1)
- корабли в бутылке (1)
- Коробочки, упаковки, бумага ручной работы (24)
- КОСМЕТИКА СВОИМИ РУКАМИ (7)
- Для лица (3)
- для тела (1)
- куклы (31)
- куклы из папье-маше (3)
- Тыквоголовки (1)
- кулинарные рецепты (44)
- выпечка (12)
- домашняя кулинария (4)
- книги и журналы по кулинарии (2)
- закуски (2)
- оформление кулинарных блюд и столов (2)
- Салаты (10)
- лепка из всего (1)
- музыка (0)
- МЫЛОВАРЕНИЕ (47)
- мыло для хозяйственных целей (4)
- Плетеные изделия из газет (26)
- полезные советы (3)
- полимерная глина (10)
- путешествие по святыням и историческим местам (2)
- разное (14)
- рукоделие (64)
- бисероплетение (14)
- лоскутное шитье (1)
- Бумага. Изделия из бумаги (7)
- декупаж (2)
- изонить (1)
- казанши (4)
- Квиллинг (6)
- кожа (1)
- спицы (1)
- шитье (5)
- свечи (5)
- Скрапбукинг (3)
- соленое тесто (6)
- СТИХИ (15)
- текстильная кукла (19)
- холодный фарфор (23)
—Музыка
—Поиск по дневнику
—Подписка по e-mail
—Статистика
лакмусовая бумага (приготовление в домашних условия)х
Пятница, 30 Сентября 2011 г. 19:02 + в цитатник
А давайте сделаем лакмусовую бумагу!
Как самостоятельно сделать индикаторные полоски для определения рН
Даже человеку, совершенно далекому от собственноручного изготовления косметики, очень часто приходится сталкиваться с понятием рН – на флаконах с шампунями, баночках с кремами и другой косметической продукцией. А уж тем, кто всерьез увлекся мыловарением и кремоварением в домашних условиях, с этим рН приходится встречаться гораздо чаще.
О чем говорит рН?
Всем известная аббревиатура рН (potentialum Hydrogenium) обозначает потенциал водорода, который является мерой степени насыщения раствора ионами водорода. Шкала рН разбита на значения от 0 до 14. При значении рН=7,0 среда является нейтральной, меньше 7 – кислотной, больше 7 – щелочной.
Простота этой шкалы очень часто вводит в заблуждение – многие считают, что все ее единицы изменения одинаковы, забывая о том, что шкала рН – логарифмическая, то есть каждое последующее деление этой шкалы в 10 раз больше чем предыдущее. Поэтому даже незначительные отклонения рН возле крайних значений шкалы составляют гораздо большие изменения в щелочности или кислотности, чем отклонения возле нейтральной отметки.
В повседневной жизни рН чаще всего рассматривается как кислотно – щелочное равновесие, баланс между отрицательно заряженными ионами, которые формируют щелочь и положительно заряженными ионами, которые формируют кислоту.
Почему так важно обращать внимание на рН косметических средств?
Благодаря многочисленным рекламам, наверное, каждый человек знает, что рН нашей кожи составляет 5,5. Но исследования дерматологов показали, что рН кожи может варьировать от 3,0 до 7,0 в зависимости от топографии – кожа головы имеет значение рН 4,5-5,5; кожа тела – около 5, 5; кожа ладоней – от 6,2 до почти 7,0. Наиболее щелочную реакцию имеет кожа паховых складок и подмышечных впадин.
Также различается кислотность кожи у людей с различными ее типами – жирная кожа имеет рН в пределах от 4,0 до 5,2; нормальная – от 5,2 до 5,7; сухая – от 5,7 до 7,0.
Если постоянно пользоваться косметическим средствами, рН которых не соответствует кислотности кожи, она начинает бурно реагировать – появляется шелушение, раздражения, покраснения. Поэтому, приобретая косметические средства в магазине, а так же изготавливая их дома самостоятельно, необходимо стремиться к тому, чтобы они имели рН максимально приближенный к рН именно вашего типа кожи.
Все со школьного курса химии помнят, что существуют вещества, способные изменять свою окраску в присутствии щелочей и кислот – индикаторы. Ими пропитывают фильтровальную бумагу, которую впоследствии обмакивают в необходимый тестируемый раствор и, сравнивая с прилагаемой цветовой шкалой, определяют значение рН.
Среди множества индикаторов наиболее популярным является лакмус (красящее вещество, которое добывается из определенного вида лишайников). Конечно, лакмусовые индикаторные полоски не настолько точные и чувствительные, как специальные приборы – рН-метры (которые измеряют напряжение между электродами, опущенными в испытуемый раствор). Но, учитывая высокую стоимость рН-метров, большинство мыловаров и кремоваров в домашних условиях используют именно лакмусовые индикаторные полоски, позволяющие определить кислотность среды с точностью до единицы.
Но можно изготовить индикаторные бумажные полоски самостоятельно, быстро и без дорогостоящих компонентов. Для этого нам понадобится лишь краснокочанная капуста, вода и обычная бумага для принтеров.
Красная капуста (а также черная смородина) содержат в своем составе природные красители, способные изменять свой цвет под воздействием щелочи или кислоты.
Нарезаем капусту на кусочки, заливаем небольшим количеством чистой воды, доводим до кипения и кипятим в течение 20-30 минут.
Наша цель – получить насыщенный фиолетовый отвар, который мы процедим и поставим остывать.
В остывший отвар на 5-7 минут опускаем нарезанную на кусочки бумагу для принтеров.
Как только бумага приобретет бледно-сиреневый цвет, достаем листы и раскладываем, чтобы они просохли.
Затем наши заготовки нарезаем на тонкие длинные полоски – наши самодельные индикаторы готовы!
Осталось распечатать эталонную шкалу для сравнения цвета, и можно начинать исследования.
Сравним работу лакмусовой индикаторной бумаги и индикатора из капусты. Сначала опустим тестируемые индикаторные полоски в обычную воду из – под крана. Как видим, ни один из индикаторов не прореагировал и не изменил свой цвет.
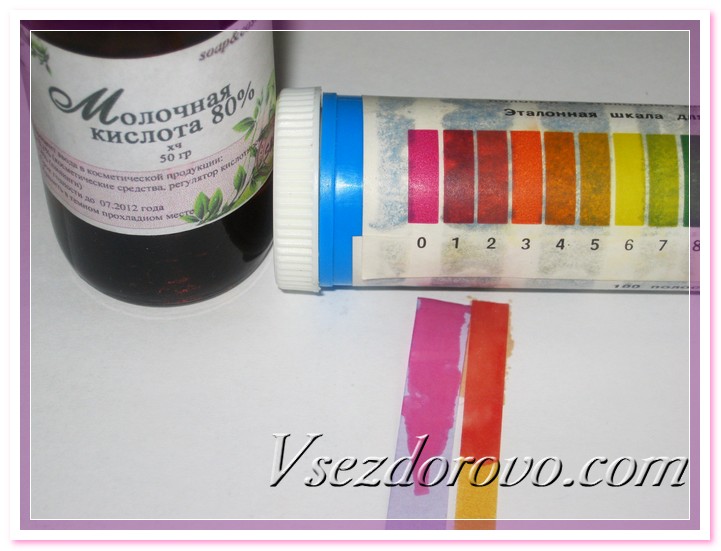
Проверяем чувствительность нашего самодельного индикатора к кислоте – опускаем бумагу в молочную кислоту. На фотографии видно, что и лакмусовая бумага, и наша индикаторная полоска показывают предельные значения кислотности шкалы.
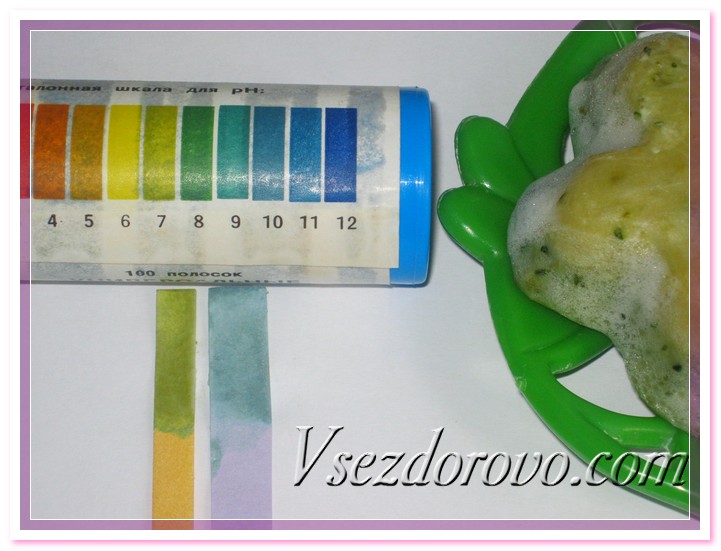
Следующее испытание – мыло ручной работы. Допустимые значения рН хорошего мыла от 8,0 до 10,0. Магазинное мыло имеет более высокую щелочность и поэтому часто вызывает сухость и разражения кожи. Лакмусовый индикатор и индикаторная бумага, изготовленная собственноручно, показывают почти одинаковые значения, в допустимых пределах.
Как видим, индикаторные полоски, изготовление при помощи красной капусты, дают чуть большую погрешность измерений, чем лакмусовая бумага. Но все-таки они четко показывают допустимые безопасные нормы исследуемых косметических средств.
Особенно необходимо применение индикаторов в кремоварении, так как очень часто активные компоненты крема могут работать только в строго определенных диапазонах рН. Поэтому при отсутствии промышленных индикаторных полосок, всегда можно воспользоваться этим простым способом и сделать бумажные индикаторные полоски самостоятельно.
Источник