- Получение азотной кислоты в домашних условиях: как обращаться с реагентами
- Где используется вещество?
- Способ 1
- Способ 2
- Особенности метода выпаривания
- Инструменты и реагенты для практического получения вещества
- Пиротехника
- Меню навигации
- Пользовательские ссылки
- Информация о пользователе
- получение концентрированной азотной к-ты
- Сообщений 1 страница 30 из 218
- Поделиться12007-03-30 15:56:11
- Растворы кислот
Получение азотной кислоты в домашних условиях: как обращаться с реагентами
Химия — увлекательная наука. Те, кто интересуются не только теорией, но и пробует свои навыки на практике, точно знают, о чем идет речь. С большинством элементов из таблицы Менделеева знаком каждый школьник. Но всем ли удалось попробовать на собственном опыте смешивать реагенты и проводить химические испытания? Даже сегодня не во всех современных школах имеется в наличии необходимое оборудование и реагенты, потому химия остается наукой открытой для самостоятельного изучения. Многие стремятся познать ее глубже, проводя исследования в домашних условиях.
Ни один самодельщик не обойдется без азотной кислоты — крайне важной в хозяйстве вещи. Достать вещество сложно: приобрести его можно только в специализированном магазине, где покупка осуществляется по подтверждающим мирное использование вещества документам. Потому если вы мастер-самоделка, достать этот компонент, скорее всего, не получится. Здесь и возникает вопрос о том, как сделать азотную кислоту в домашних условиях. Процесс вроде не отличается сложностью, тем не менее на выходе должно получиться вещество достаточного уровня чистоты и необходимой концентрации. Здесь без навыков химика-экспериментатора никак не обойтись.
Где используется вещество?
Применение азотной кислоты разумно в безопасных целях. Вещество используется в таких сферах деятельности человека:
- создание красящих пигментов;
- проявление фотопленок;
- приготовление лекарственных препаратов;
- переработка пластиковых изделий;
- использование в химии;
- удобрение садовых и огородных культур;
- производство динамита.
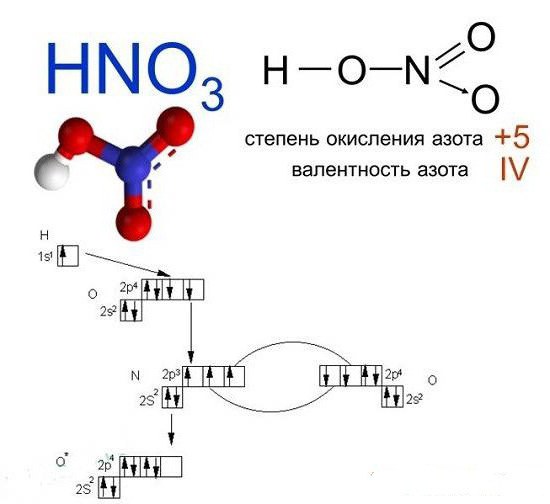
Чистая азотная кислота в неизмененном виде выглядит как жидкое вещество, которое при контакте с воздухом начинает выпускать белые пары. Замерзание его происходит уже при -42 о С, а кипение — при +80 о С. Как вывести такое вещество, как азотная кислота, своими руками в домашних условиях?
Способ 1
Дымящееся вещество получают посредством воздействия концентрата серной кислоты на натриевую (калийную) селитру (натрий (калий) нитрат). В результате реакции получается искомое вещество и гидросульфат натрия (калия). Схема реакции выглядит таким образом: NaNO3+H2SO4=>HNO3+NaHSO4. Запомните, что концентрация полученного вещества зависит от концентрации серной кислоты перед вступлением в реакцию.
Способ 2
Получение азотной кислоты в домашних условиях с меньшей концентрацией вещества происходит тем же способом, необходимо только заменить натриевую селитру нитратом аммония. Химическое уравнение выглядит так: NH4NO3+H2SO4=>(NH4)2SO4+HNO3. Заметьте, что аммиачная селитра доступнее, чем калийная или натриевая, потому большинство исследователей проводят реакцию на ее основе.
Чем выше концентрация H2SO4, тем более концентрированной будет азотная кислота. Чтобы получить сбалансированное вещество, требуется увеличить объем электролита, необходимого для проведения реакции. Чтобы достичь желаемого результата, на практике пользуются методом выпаривания, который заключается в постепенном уменьшении объема электролита примерно в 4 раза от первоначального.
Особенности метода выпаривания
На дно посуды высыпают просеянный песок и ставят резервуар с электролитом. При этом процесс кипячения регулируют вентилем газовой плиты, поддавая или уменьшая огонь. Процесс отличается длительностью, поэтому в таком деле важно терпение. Эксперты рекомендуют использовать кипелки — стеклянные или керамические трубочки, предназначенные для проведения химических опытов, в том числе и выпаривания. Они нейтрализуют образование пузырей и снижают силу кипения, предотвращая разбрызгивание вещества. В таких условиях допустимо получение азотной кислоты в домашних условиях с концентрацией около 93 %.
Инструменты и реагенты для практического получения вещества
Для проведения реакции потребуется наличие:
- концентрированного H2SO4 (>95%) — 50 мл;
- нитрата аммония, калия, натрия;
- 100 мл емкости;
- 1000 мл контейнера;
- стеклянной воронки;
- резинки;
- водяной бани;
- колотого льда (можно заменить на снег или холодную воду);
- термометра.
Получение азотной кислоты в домашних условиях, как и проведение любой другой химической реакции, требует соблюдения мер предосторожности:
- В процессе получения азотной кислоты в домашних условиях необходимо поддерживать температуру в рамках 60-70 о С. Если превысить эти границы, кислота начнет распадаться.
- Во время проведения реакции могут выделяться пары и газы, поэтому, работая с кислотами, обязательно пользуйтесь защитной маской. Руки должны быть защищены от внезапного попадания вещества на кожу, потому химики работают в резиновых перчатках. На больших химических производствах, где человек контактирует с опасными для здоровья веществами, рабочие вообще работают в специальных защитных костюмах.
Теперь вы знаете, как получить азотную кислоту в процессе проведения простой реакции. Будьте осторожны с использованием такого вещества и применяйте его только в мирных целях.
Источник
Пиротехника
Меню навигации
Пользовательские ссылки
Информация о пользователе
Вы здесь » Пиротехника » Хим.Реактивы » получение концентрированной азотной к-ты
получение концентрированной азотной к-ты
Сообщений 1 страница 30 из 218
Поделиться12007-03-30 15:56:11
- Автор: aZotNick
- Пиротехник
- Откуда: Москва
- Зарегистрирован : 2007-03-22
- Приглашений: 0
- Сообщений: 55
- Уважение: [+0/-0]
- Позитив: [+0/-0]
- Провел на форуме:
Не определено - Последний визит:
2010-10-06 20:09:36
Откровенно говоря, всё время с 8-го по 9-й класс я искал способ получения азотной кислоты в домашних условиях (пусть даже не концентрированной).
2 способа есть!
Начнём с гидролиза — в неорганике — реакции солей с водой.
Для этого лучше всего подходит аммиачная слитра. Для этого надо приготовить насыщенный раствор аммиачной селитры в ЛЕДЯНОЙ воде (в смысле — готовой к замерзанию) и постепенно добавлять его к кипятку, постоянно поддерживая температуру 95 градусов, и выше. Теоретически на стакан раствора + стакан кипятка должна получиться 15%азотная кислота.
На практике, судя по индикатору там процента 3.
Более действенный метод — электролиз той же самой аммиачной селитры.
Это дело очень тонкое. Нужен насыщенный раствор. Нельзя делать высокое напряжение! При самых нейтральных угольных стержнях подойдет 4,5 В, и то может быть много. ЦЕЛЬ — собрать оксид азота (NO2), затем растворить его в воде. Реакция идёт нормально, в итоге должна получиться азотная кислота.
Работа ювелирная, но если вспомнить практику на химии, сделать всё можно.
А теперь непосредственно про получение азотной кислоты из серной (конц.).
Материалы:
1. Нитрат натрия или нитрат калия
2. Дистиллированная вода
3. Концентрированная серная кислота
Оборудование:
1. Источник тепла
2. Реторта
3. Ванна со льдом
4. Стеклянная палочка
5. Собирательная колба
6. Соединительная трубка из кислотоустойчивого материала
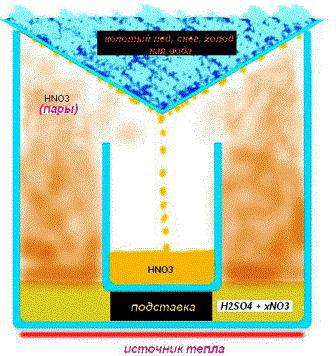
Процедура изготовления:
1. Налейте 32 мл концентрированной серной кислоты в реторту.
2. Тщательно отвесьте 58 граммов нитрата натрия, или 68 граммов нитрата калия. И медленно прибавьте его к кислоте. Если соль, не растворяется, то следует тщательно размешать раствор стеклянным стержнем до ее растворения.
3. Соедините горловину реторты с конденсирующей колбой при помощи трубки, и разместите конденсирующую колбу в ледяной ванне.
4. Медленно нагрейте реторту и продолжайте ее нагревать до тех пор, пока жидкость не начнет испарятся. Испаряющиеся пары являются парами азотной кислотой. Смесь следует нагревать до выпадения осадка или полного испарения смеси. Жидкость, которая сконденсировалась в собирательной колбе, является азотной кислотой.
Если кислота будет слишком быстро и сильно нагрета то она может разложиться. Это может привести к выделению огнеопасного и токсичного газа, который может взорваться.
Отредактировано aZotNick (2007-03-30 15:58:10)
Источник
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:

Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:

или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде
, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор H2SO4. Это значит, что в I л раствора должно содержаться:

Кислота с плотностью 1,84 г\смг содержит 95,6% H2SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):

Соответствующий объем кислоты составит:

Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора H2SO4 содержит не 0,0049 г H2SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:

Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
* Для отмеривания кислоты пользуются тщательно высушенной бюреткой с притертым краном. .
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.
Источник