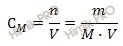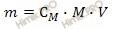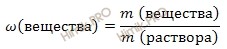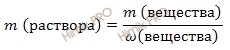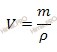Как приготовить молярный раствор азотной кислоты

 [ Ответ на тему ] [ Ответ на тему ] |

 |
| Автор | Тема: Приготовление раствора азотной кислоты 0,5 моль/дм3 | |
| komo4ek Пользователь Ранг: 70 |  11.08.2011 // 8:15:54 Правильно ли приготовлен раствор, если в 500 см3 дист. воды растворили 17,5 см3 азотной кислоты? 11.08.2011 // 8:15:54 Правильно ли приготовлен раствор, если в 500 см3 дист. воды растворили 17,5 см3 азотной кислоты? | |
| ANCHEM.RU Администрация Ранг: 246 |  | |
| varban VIP Member Ранг: 8699 |  11.08.2011 // 8:22:10 Нет. 11.08.2011 // 8:22:10 Нет. | |
| komo4ek Пользователь Ранг: 70 |  11.08.2011 // 8:33:58 А как правильно приготовить этот раствор? 11.08.2011 // 8:33:58 А как правильно приготовить этот раствор? | |
| biolight Пользователь Ранг: 500 |  11.08.2011 // 9:33:26 Редактировано 1 раз(а) 11.08.2011 // 9:33:26 Редактировано 1 раз(а) 10,4 см 3 кислоты | |
| komo4ek Пользователь Ранг: 70 |  11.08.2011 // 10:29:35 11.08.2011 // 10:29:35 Спасибо! | |
| komo4ek Пользователь Ранг: 70 |  11.08.2011 // 10:29:57 11.08.2011 // 10:29:57 Можете написать, как расчитать это? | |
| Каталог ANCHEM.RU Администрация Ранг: 246 |
| |
| IgorJan Пользователь Ранг: 49 |  11.08.2011 // 13:32:05 При приготовлении надо учитывать плотность кислоты (указана на этикетке либо измерить) или посмотреть по справочнику плотность кислоты с данной процентной концентрацией. Учитывая эти данные расчитать количество кислоты. 11.08.2011 // 13:32:05 При приготовлении надо учитывать плотность кислоты (указана на этикетке либо измерить) или посмотреть по справочнику плотность кислоты с данной процентной концентрацией. Учитывая эти данные расчитать количество кислоты. А это при использовании 65% (точнее 17,4 см3) | |
| varban VIP Member Ранг: 8699 |  11.08.2011 // 16:11:49 Редактировано 3 раз(а) 11.08.2011 // 16:11:49 Редактировано 3 раз(а)
У Вас вопрос «Приготовление раствора азотной кислоты 0,5 моль/дм3»
Я не вижу ни кубического дециметра, ни даже моля Полумолярный раствор — полмоля в одном литре. А не в 1000 + 35 ml. Так и надо сделать. В мерной колбе на поллитра нужно налить 100. 200 ml воды, затем добавить расчетное количество азотной кислоты, закрыть колбу пробкой, перемешать, долить на несколько миллилитров ниже марки, темперировать до 20 (или 25 градусов — сколько на колбе написано), довести объем до метки, еще раз перемешать, перелить в склянку для постоянного хранения и далее — в зависимости от целей — или пользоваться, или устанавливать точную концентрацию. То, что я набрал, описано в 10 раз лучше в любом учебнике и практикуме по аналитической химии. неужели сложнее прочитать?! Я бы не стал писать, но накопилось ответов. мягко говоря, неполных ответов. хотя бы потому, что ни один из них не отчеркнул основную Вашу ошибку — что мол — в литре, а не в литре + объем вещества. Не говоря уже, что точно 65% азотки не бывает. даже если в бутылке она случайно оказалась 65.00 %, то в ходе использования концентрация ее будет падать, а оксиды азота — увеличиваться. И когда останется на донышке, будет уже 63 или 64 там процентная. А 100% — тем более | |
| varban VIP Member Ранг: 8699 |  11.08.2011 // 16:27:00 11.08.2011 // 16:27:00
Да, надо учитывать действительную концентрацию. Если нужен раствор более точной концентрации, нужно титровать. А если к тому же нужно, чтобы было возможно меньше оксидов азота, нужно охладить воду, на которой готовят раствор. | |
| AlexUnder Пользователь Ранг: 1616 |  11.08.2011 // 21:21:19 Напишите — для чего Вам этот раствор — и Вам дадут ответ — как его готовить. Это важно. 11.08.2011 // 21:21:19 Напишите — для чего Вам этот раствор — и Вам дадут ответ — как его готовить. Это важно. | |
| biolight Пользователь Ранг: 500 |  12.08.2011 // 10:18:38 12.08.2011 // 10:18:38
99% вроде как «дымящаяся» даже обзывают. Или это миф? |
| Ответов в этой теме: 23 Источник Химик.ПРО – решение задач по химии бесплатноКакой объем раствора азотной кислоты (HNO3) концентрированного с массовой долей равной 60 % и плотностью раствора 1,37 г/см 3 необходимо взять для приготовления 800 см 3 раствора с молярной концентрацией вещества, равной 2 моль/л? Решение задачиНайдем сколько концентрированной азотной кислоты (HNO3) (в граммах) потребуется для приготовления 800 см 3 (или 0,8 л объем раствора азотной кислоты) раствора с молярной концентрацией 2 моль/л. Для расчета будем использовать формулу нахождения молярной концентрации раствора: CM – молярная концентрация раствора; n – химическое количество растворенного вещества; M – молярная масса растворенного вещества; m – масса растворенного вещества; V – объем раствора азотной кислоты.
Из вышеуказанной формулы выразим и рассчитаем массу растворенного вещества: Учитывая, что молярная масса азотной кислоты (HNO3) равна 63 г/моль (смотри таблицу Менделеева), получаем: m (HNO3 (конц.)) = 2 моль/л ∙ 63 г/моль ∙ 0,8 л = 100,8 (г). Используя формулу нахождения массовой доли растворенного вещества: выразим массу раствора азотной кислоты (HNO3): m (раствора HNO3 (конц.)) = 100,8 г/ 0,6 = 168 (г). Если раствор 60-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,6. Вычислим объем раствора азотной кислоты (HNO3) концентрированного, который потребуется для приготовления 0,8 л раствора с молярной концентрацией 2 моль/л. Будем использовать формулу, устанавливающую связь между объемом раствора азотной кислоты и массой раствора: Получаем, объем раствора азотной кислоты: V (раствора HNO3 (конц.)) = 168 г /1,37 г/мл = 122,63 (мл). Ответ:объем раствора азотной кислоты концентрированного 122,63 миллилитра. Источник Как приготовить 1М азотную кислоту?Если можно то с расчетами пожалуйста. Если смешать, как советовали, 1 моль чистой (100%-ной) азотной кислоты (это 63 г, 41,7 мл, ее концентрация 24 М) и 1 моль воды (18 мл), то концентрация полученного раствора не будет равна 1 М! Для получения 1 М раствора в 1 литре его должен содержаться 1 моль азотной кислоты. Для получения такого раствора необходимо знать концентрацию кислоты, которую вам нужно будет разбавлять. Без этого приготовить 1 М раствор невозможно. Кстати, 100%-ную азотную кислоту вы вряд ли достанете, и мало кто из химиков вообще ее видел. Продажная кислота имеет концентрация немногим больше 60%. Кислота с концентрацией 60 масс.% (или 13 М) имеет плотность 1,37. 1 М кислота довольно сильно разбавлена, поэтому можно считать, что ее плотность близка к 1. Это упрощает расчеты. Если есть концентрированная кислота с известной концентрацией, нужно рассчитать с помощью таблиц *в них приводится плотность растворов разной концентрации), в каком ее объеме будет 1 моль в расчете на чистую кислоту, вылить этот объем в мерную колбу на 1 л и разбавить чистой водой до метки. Для того, чтобы приготовить 1М азотной кислоты, проще взять 1 моль азотной и 1 л воды. Массу одного моля азотной можно рассчитать так: 63-это молекулярная и молярная масса азотной, если я не ошибаюсь, а 1- количество вещества. Получается, надо в чистую колбу добавить 63 г азотной (с помощью весов определите, не забудьте вычесть вес емкости, в которой находится азотная), а затем добавить 1 л воды (можно измерить с помощью мерных цилиндров, например). Если такой раствор занимает слишком много места, то просто переводите литры в мл, г в мг и считайте с ними. Само понятие «кислота» можно разобрать с нескольких позиций. Для начала рассмотрим на примерах школьных определений. В 8 классе нам говорили что Кислота это сложное вещество, молекулы которого состоятиз атомов водорода и кислотного остатка. Ближе к концу 8 класса, а также в 11 классе нам говорили, что Кислота это электролит, который при диссоциации образует катионы водорода и анионы кислотного остатка. Как правило кислотные остатки образуют элементы неметаллов. Если же углубиться в этом вопросе, то можно рассмотреть это определение при помощи теории кислот и оснований. Для наглядности мы рассмотрим не только кислоты. Краткое изложение теории можно найти в таблице приложенной ниже. H₂SO₄+ 2NaOH = Na₂SO₄+ 2H₂O 2H⁺ + SO₄²⁻ + 2Na⁺ + 2OH⁻ = 2Na⁺ + SO₄²⁻ + 2H₂O HCl + KOH = KCl + H₂O H⁺ + Cl⁻ + K⁺ + OH⁻ = K⁺ + Cl⁻ + H₂O
Zn(OH)₂ + 2NaOH = Na₂[Zn(OH)₄] Zn(OH)₂ + 2Na⁺ + 2OH⁻ = 2Na⁺ + Zn(OH)₄²⁻ Zn(OH)₂ + 2OH⁻ = Zn(OH)₄²⁻ Cr(OH)₃ + 3KOH = K₃[Cr(OH)₆] Cr(OH)₃ + 3K⁺ + 3OH⁻ = 3K⁺ + Cr(OH)₆³⁻ Cr(OH)₃ + 3OH⁻ = Cr(OH)₆³⁻ В настоящий момент это точно неизвестно из-за отсутствия способа измерения силы самых сильных кислот. Пока претендентов 3: смесь фтороводорода и пентафторида сурьмы (магическая кислота), которая имеет кислотность Гаммета около -20; и две карборановые кислоты — H(CHB11Cl11) и H(CHB11F11), которые протонируют все настолько сильно, что для них не удается подобрать инертный растворитель для измерения кислотности. Вроде как сильнее H(CHB11F11). Она вытесняет водород из гексана, как и магическая кислота. Источник |