Как приготовить мясопептонный бульон
Рецепт 61. Мясопептонный агар. МПА применяют для выращивания неприхотливых микроорганизмов и как основу специальных сред для культивирования более требовательных микробов (сывороточного, кровяного, асцитического агара и др.)
Пептон — 10,0-20,0 г
Натрия хлорид — 5,0 г
Агар — 10,0-20,0 г
Вода мясная — 1000 мл
Смесь пептона, хлорида натрия и мясной воды кипятят на слабом огне при постоянном помешивании до полного растворения ингредиентов. Бульон фильтруют, устанавливают pH и добавляют измельченный агар (в зависимости от качества агара и назначения среды). Затем среду кипятят на слабом огне при постоянном помешивании до полного растворения агара. При помутнении среды ее просветляют одним из известных способов. Приготовленную среду разливают в пробирки или во флаконы, стерилизуют в автоклаве при 121 °С в течение 20 мин.
Рецепт 62. Питательный бульон (HiMedia, Nutrient Broth, Cat. M002):
Пептон — 5,0 г
Натрия хлорид (NaCl) — 5,0 г
Экстракт говяжий — 1,5 г
Экстракт дрожжевой — 1,5 г
pH 7,4(±0,2)
Суспендируют 13 г сухой смеси в 1000 мл дистиллированной воды. Кипятят до полного растворения внесенных ингредиентов. Стерилизуют при 121 °С в течение 15 мин.
Среду используют для выращивания неприхотливых микробов. Добавление крови, сыворотки и других ингредиентов делает ее пригодной для роста требовательных микроорганизмов.
Рецепт 63. Питательный бульон (HiMedia, Nutrient agar, Cat. M001). Питательный агар рекомендуют использовать для выращивания широкого спектра микроорганизмов, не требующих специальных питательных добавок.
Пептон — 5,0 г
Натрия хлорид — 5,0 г
Экстракт говяжий — 1,5 г
Экстракт дрожжевой — 1,5 г
Агар — 15,0 г
pH 7,4 (±0,2)
Суспендируют 28 г сухой смеси в 1000 мл дистиллированной воды. Кипятят при постоянном помешивании до полного растворения внесенных ингредиентов. Стерилизуют при 121 °С в течение 15 мин.
Редактор: Искандер Милевски. Дата публикации: 13.09.2019
Источник
Приготовление питательных сред
Мясо-пептонный бульон (МПБ). Для приготовления мясо-пептонных сред используют мясной бульон, который получают следующим образом: 500 г мелко изрубленного свежего мяса без костей, жира и сухожилий заливают в эмалированной кастрюле 1 л водопроводной воды, нагретой до 50°С, и оставляют настаиваться 12 ч при комнатной температуре или 1 ч при 50—55°С. Мясо отжимают, экстракт процеживают через марлю со слоем ваты, кипятят 30 мин для свертывания коллоидных белков и фильтруют дважды (первый раз через марлю с ватой, второй — через бумажный фильтр). Фильтрат доливают водой до 1 л, разливают в колбы, закрывают ватными пробками и стерилизуют при 120°С 20 мин (пробки колб закрывают сверху колпачками из бумаги). Ватные пробки должны быть плотными, так как они служат фильтром, препятствующим проникновению бактерий из воздуха после стерилизации.
Мясной бульон может быть использован в любое время для приготовления соответствующих сред. Если их готовят сразу, то предварительная стерилизация мясного бульона не требуется.
Нередко в лабораторных условиях мясной настой кипятят вместе с мясом, затем мясо отжимают. При этом бульон получается хорошего качества. При потребности в мясном бульоне особо высокой питательности во время настаивания мяса с водой добавляют немного пепсина и подкисляют бульон соляной кислотой. Пепсин способствует дополнительной гидролизации белковых соединений мяса, и в результате количество доступных бактериям питательных веществ возрастает. Мясо можно заменить мясным экстрактом (5 г на 1 л среды).
Для приготовления МПБ к 1 л мясного бульона добавляют 5—10 г пептона (первый продукт гидролиза белка) для повышения калорийности среды и 5 г поваренной соли для создания осмотической активности. Среду нагревают до растворения пептона, постоянно помешивая.
Затем устанавливают нейтральную или слабощелочную реакцию среды, приливая 20%-ный раствор Na2CO3 до посинения влажной красной лакмусовой бумажки. Дли проверки рН среды удобно использовать индикатор бромтимолблау: 1—2 капли его смешивают в фарфоровой чашке с каплей бульона. В нейтральной среде бромтимолблау — бутылочно-зеленый, в кислой — желтый, в щелочной — синий.
После установления рН среду снова кипятят 5—10 мин, и белки, свернувшиеся при изменении реакции среды, отфильтровывают через бумажный фильтр без осветления бульона или осветлив его белком. Для этого свежий яичный белок взбивают с двойным по объему количеством воды и смешивают с охлажденным до 50 °С бульоном. Смесь кипятят, помешивая, на слабом огне 10 мин, затем фильтруют. Прозрачный мясо-пептонный бульон разливают в пробирки, закрывают ватными пробками и стерилизуют при 120 °С 20 мин.
Мясо-пептонный агар (МПА). К 1 л МПБ добавляют 15— 20 г агара. Среду нагревают до растворения агара (температура его плавления — 100 °С, затвердевания — 40 °С), устанавливают слабощелочную реакцию среды 20%-ным раствором Na2CO3 и через воронку разливают в пробирки (приблизительно по 10 мл агара столбиком для последующего разлива по чашкам Петри и по 5 мл для получения скошенного агара — косяков).
При разливе агара необходимо следить за тем, чтобы края пробирок оставались сухими, иначе пробки прилипнут к стеклу. Пробирки со средой стерилизуют в автоклаве при 120 °С 20 мин.
Мясо-пептонная желатина (МПЖ).В 1 л МПБ помешают 100—150 г желатины. Температура плавления желатины зависит от ее содержания в среде: в случае 10%-ной концентрации в среде она плавится при 24 °С; в случае 15%-ной — при 25 °С. В летнее время среды готовят, добавляя 15% желатины.
После растворения желатины при осторожном нагревании устанавливают слабощелочную реакцию среды (как для МПБ и МПА), кипятят 5 мин, затем охлаждают до 40—50 °С. Взбитый, с небольшим количеством воды яичный белок вливают в охлажденную желатиновую среду, хорошо взбалтывают и снова нагревают. Среда после выпадения белков в осадок становится прозрачной. Ее фильтруют в горячем виде через бумажный фильтр, разливают в пробирки и стерилизуют в кипятильнике Коха текучим паром, прогревая среду 3 раза по 30 мин каждые 24 ч.
Картофельный агар. Нарезают ломтиками 200 г очищенного и промытого водой картофеля, заливают 1 л водопроводной воды, варят 30 мин. Отвар фильтруют через вату и добавляют воду до первоначального объема. К полученной жидкости прибавляют 2% агара, кипятят до его расплавления и устанавливают нейтральную реакцию среды (рН = 7). Среду стерилизуют 20 мин при 1 атм 1 .
Пивное сусло и сусло-агар. Зерна ячменя замачивают в холодной воде и проращивают при 35 °С. После того как ростки станут вдвое длиннее зерен, последние высушивают до воздушно-сухого состояния (можно при слабом подогревании), получая солод. Для приготовления сусла солод крупно размалывают и смешивают с водой (250 г солода на 1 л воды). Для лучшего выделения фермента амилазы смесь подогревают при 57 °С до исчезновения реакции на крахмал (синего окрашивания с иодом). Пробы на осахаривание крахмала проводят в фарфоровой чашке в капле жидкости.
Сусло процеживают через вату, затем фильтруют через бумажный фильтр. Такое сусло содержит 10—20% сахара. Точное его содержание определяют по плотности раствора при помощи сахариметра. Сусло разбавляют водой до концентрации сахара 6—8% и стерилизуют 30 мин при 115 °С и давлении 0,5 атм. Готовое сусло можно получить на пивоваренном заводе.
Для приготовления сусло-агара к пивному суслу добавляют 2,5—3% агара, кипятят до расплавления, фильтруют через вату и стерилизуют при тех же условиях, как и пивное сусло.
Обезжиренное молоко. Для приготовления питательных сред используют снятое молоко, так называемый обрат, так как жир в молоке неблагоприятно влияет на рост некоторых микроорганизмов. Обрат получают сепарированием молока, нагретого до 34 °С. Можно удалять жир и при отстаивании молока.
При стерилизации следует помнить о том, что молоко нельзя длительное время выдерживать в автоклаве, так как лактоза (молочный сахар), содержащаяся в молоке, может карамелизоваться.

Обезжиренное молоко разливают в стерильные пробирки и выдерживают при 115 °С (давление 0,5 атм) 10 мин. Перед стерилизацией кислотность обрата не должна превышать 22° Тернера, иначе молоко свернется. После стерилизации его выдерживают 3 сут в термостате при 30°С. чтобы спровоцировать развитие спорообразующих и других стойких к нагреванию форм. Через 3 сут пробирки с молоком просматривают и те, в которых развились микроорганизмы, выбраковывают.
При стерилизации в автоклаве иногда возможно побурение молока вследствие карамелизации молочного сахара и пептонизании казеина. При длительной стерилизации на дно пробирки выпадает осадок казеина, который может частично пептонизироваться. Перегретoe побуревшее молоко в качестве среды использовать нельзя.
Дрожжевые среды. Дрожжевая вода. 50—100 г сухих дрожжей разводят в 1 л воды, кипятят 10 мин, фильтруют через бумажный фильтр и стерилизуют текучим паром по 30 мин в течение 3 дней ежедневно.
Дрожжевой автолизат. 200 г прессованных дрожжей разводят в 1 л воды; добавляют 2 г Na2HPO4, каплями I н. раствор NaOH (до рH 6,1) и 5 мл хлороформа, выдерживают при 37 °С 2 сут, доводят раствором NaOH до рН 7,4, кипятят 30 мин. фильтруют через бумажный фильтр, разливают в посуду и стерилизуют при 115 °С 30 мин.
Дрожжевой экстракт. 1 кг прессованных дрожжей разводят в 1 л воды, смесь кипятят 1 ч, трижды отфильтровывают через бумажный фильтр и стерилизуют при 115 °С 30 мин.
Бобовый отвар. 50 г фасоли (лучше белой) заливают 1 л водопроводной воды и варят до готовности так, чтобы бобы не разварились. Полученный отвар фильтруют через вату, добавляют к нему 10 г сахара и доводят до первоначального объема. Устанавливают слабощелочную реакцию среды, разливают в колбы и стерилизуют в автоклаве 30 мин при давлении пара 1,5 атм.
1 По системе СИ давление принято выражать в паскалях (Па): 1 атм = 1,01325 х 10 5 Па = 0,1 МПа.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Простые питательные среды
Мясопептонный бульон и мясопептонный агар являются пригодными для большинства бактерий наиболее простыми питательными средами. Исходным материалом для приготовления этих и ряда других питательных сред служит мясная вода, представляющая собой желтоватую прозрачную жидкость с кислой реакцией. Мясная вода содержит растворимые белковые вещества (альбумины), экстрактивные вещества и некоторые соли.
Мясная вода и концентрированный мясопептонный бульон (по ГОСТу 10444-63)
Мясо говяжье или конское после удаления костей, жира и сухожилий пропускают через мясорубку, и фарш заливают холодной водопроводной водой, вливая на каждые 500 г мясного фарша 1 л воды. После перемешивания смесь медленно нагревают до кипения и умеренное кипение поддерживают в течение 1,5 ч. Небольшое количество смеси фарша с водой (до 5 л) можно кипятить на открытом огне, часто помешивая, чтобы не произошло пригорания мелких частичек мяса.
Большое количество лучше кипятить в котлах с паровой рубашкой. Готовность мясной воды определяют фильтрованием небольшого количества ее в пробирку через бумажный фильтр. Если фильтрат прозрачен, мясная вода готова. Если же фильтрат получается мутным, то варку следует производить до тех пор, пока не получится вполне прозрачный фильтрат. После окончания варки жидкость отцеживают через полотно или вдвое сложенную марлю, отжимают из вареного мяса весь сок и полученную жидкость доводят кипяченой водой до первоначального объема. Добавления большого количества воды обычно не требуется, так как в результате варки в мясную воду переходит много сока из мяса. Только при слишком длительной варке и очень бурном кипении наблюдается большое выпаривание жидкости.
Полученную мясную воду разливают в стеклянные пол-литровые банки, закатывают и стерилизуют в автоклаве 20 мин при температуре 120 °С. Из заготовленной таким образом мясной воды по мере надобности приготовляют необходимые питательные среды.
Чтобы получить концентрированный мясопептонный бульон (МПБ), к 1 л мясной воды прибавляют 10 г пептона1 и 5 г хлористого натрия. Доводят реакцию среды до pH 7,0-7,2, кипятят, фильтруют через бумажный фильтр, разливают в чистые пробирки и, закрыв ватными пробками, стерилизуют в автоклаве 20 мин при температуре 120 °С.
Разведенный мясопептонный бульон
Приготовление мясной воды производится так же, как и для концентрированного бульона, но вместо 500 г мясного фарша берется 250 г его на 1 л воды. Можно заготовленную концентрированную мясную воду развести вдвое водой. К 1 л разведенной мясной воды добавляют 5 г пептона, 2,5 г хлористого натрия, устанавливают pH 7,0-7,2, а далее поступают так же, как при приготовлении концентрированного мясопептонного бульона.
Рыбопептонный бульон
На заводах, вырабатывающих рыбные консервы, вместо мясной воды для приготовления сред можно пользоваться рыбной водой. Рыбную воду следует готовить из крупной тощей рыбы. Лучше всего для этой цели подходит судак, треска или щука. Освобожденную от костей и жира рыбу пропускают через мясорубку и заливают холодной водопроводной водой из расчета 1 л воды на 500 г рыбного фарша. Все дальнейшие операции приготовления рыбной воды аналогичны операциям приготовления мясной воды.
Рыбная вода используется для приготовления рыбопептонного бульона. На 1 л рыбной воды прибавляют 10 г пептона, 5 г поваренной соли, нейтрализуют до pH 7,0-7,2 и стерилизуют так же, как мясопептонный бульон.
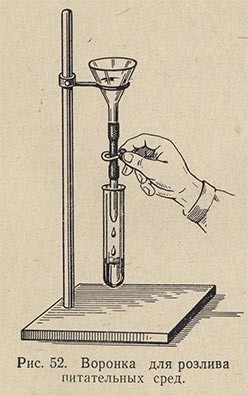
Розлив бульона в пробирки (перед стерилизацией) производится через стеклянную воронку, на конец которой надета резиновая трубка с наконечником и зажимом Мора (рис. 52). Стеклянный наконечник следует несколько погружать при розливе в пробирку, чтобы края пробирки не смачивались бульоном, иначе ватная пробка присохнет к стеклу и может прорасти микроорганизмами.
Установление реакции питательных сред
При микробиологических исследованиях постоянно приходится учитывать кислотные и щелочные свойства питательных сред. Активная кислотность питательного субстрата имеет, как уже указывалось, большое значение в жизненных процессах микробов: она влияет на их рост, морфологические и физиологические свойства. Для большинства бактерий необходима среда с pH 7,2-7,4, для дрожжей и плесеней — с pH 4,5-5,5.
Питательные среды, приготовляемые для выявления биохимических свойств микробов, должны иметь оптимальную, строго определенную для данного микроба реакцию. Установить pH приготовленной среды в микробиологической лаборатории можно либо электрометрическим, либо колориметрическим методами. Электрометрически pH определяют с помощью лабораторного рН-метра (например, ЛП-58 — рис. 53) или иономера (КФВ-И1 — рис. 54).
Чтобы измерить величину pH исследуемой питательной среды с помощью иономера, в прилагаемый к нему стаканчик наливают около 40 мл этой среды, погружают в нее патрон с хлор-серебряным полуэлементом и присоединяют электродное устройство. Стрелки гальванометра отклоняются и показывают значение величины pH.
При использовании лабораторного рН-метра (ЛП-58) удобнее применять стеклянный и каломельный электроды. Шарик стеклянного электрода имеет очень тонкие стенки — 0,03-0,05 мм, поэтому при работе с ним нужно соблюдать осторожность. Перед применением стеклянный электрод следует не менее 1-2 ч выдерживать в дистиллированной воде, а при частой эксплуатации нужно постоянно хранить его в дистиллированной воде, периодически заменяя ее свежей.
Перед измерением pH стеклянным электродом производят корректировку шкалы pH по буферному раствору. Величина pH буферного раствора должна быть близка к pH исследуемого раствора. Температурный компенсатор прибора устанавливают на температуру буферного раствора и настраивают усилитель и потенциометрическую часть прибора по нормальному элементу. Затем, промыв дистиллированной водой электроды и измерительный сосуд, наполняют его исследуемой средой и производят измерение pH среды; устанавливая температурный компенсатор на температуру среды и нажимая кнопку для включения прибора на фронтальной доске рН-метра, замечают показания стрелки гальванометра на шкале pH. Подробно правила пользования, настройки и ухода за приборами описываются в инструкциях, прилагаемых к приборам. Длительность анализа 3-5 мин. Результаты достаточно точны.
Электрометрически с помощью рН-метра и иономера, очень удобно проверять pH готовых сред. А так как при изготовлении питательных субстратов для бактериологических анализов приходится не только фиксировать имеющийся уровень pH среды, но и доводить реакцию до определенного его значения, то в практике оказался более удобным колориметрический метод.
В основу колориметрического метода положено свойство индикаторов менять свою окраску с изменением концентрации ионов H- растворов. Для каждого индикатора характерен свой диапазон pH, в пределах которого меняется его цвет. Согласно ГОСТу 10444-63 для установления pH питательных сред применяют 0,04%-ный раствор бромтимолового синего. Диапазон бромтимолового синего 6,0-7,6. В кислых средах он приобретает желтую окраску, в щелочных — синюю. При pH 7,1 дает салатово-зеленую окраску.
Для определения реакции среды или консервов после развития в них микроорганизмов применяют 0,04%-ный раствор бромкрезолпурпура. Бромкрезолпурпур изменяет окраску в диапазоне pH 5,2-6,3. В кислых средах он бледно-желтый, в нейтральных — красно-фиолетовый, а при pH 6,3 дает зеленую с пурпурным оттенком окраску.
Индикаторы готовят следующим образом: 0,1 г соответствующего индикатора, взвешенного на аналитических весах, растирают в ступке (желательно агатовой) с 1/20 н. раствором едкого натра. Для растворения 0,1 г бромтимолового синего берут 3,2 мл 1/20 н. раствора NaOH; для растворения 0,1 г бромкрезолпурпура — 3,7 мл 1/20 н. раствора щелочи. К полученному щелочному раствору добавляют 250 мл дистиллированной воды и получают 0,04%-ный раствор индикатора. Приготовленный раствор индикатора следует хранить на холоду в стеклянных сосудах с притертой пробкой.
Перед стерилизацией pH среды доводят до необходимого уровня (7,0-7,2). Для этого в большую колбу (2-3 л) вливают 1,5 л приготовляемой питательной среды. Из бюретки в нее начинают приливать по каплям 10%-ный раствор двууглекислой соды или слабый раствор щелочи (например, 0,1 н. раствор едкого натра), все время проверяя реакцию среды по индикатору (в данном случае по бромтимоловому синему). Для этого на белую фарфоровую плитку (можно даже кафельную) наносят несколько капель среды, в которые добавляют каплю индикатора. Если бромтимоловый синий при этом даст желтую окраску, то приливание соды или щелочи нужно продолжать до тех пор, пока среда от капли индикатора не окрасится в салатово-зеленый цвет. Если в капле исследуемой среды при внесении индикатора появляется зелено-синий тон, то щелочной раствор при титровании прилит в избытке и в колбу со средой следует добавить свежую, еще не титрованную питательную среду и опять проверить реакцию.
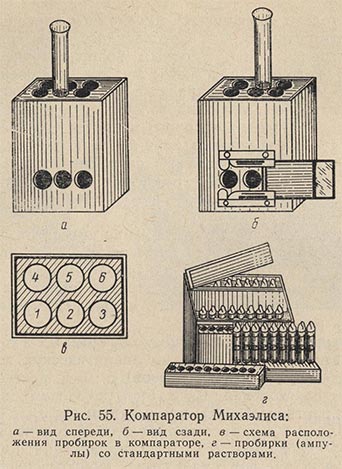
Прекрасно зарекомендовал себя на практике метод определения pH (пш) с помощью компаратора и стандартной шкалы Михаэлиса. Этот метод является достаточно точным — реакция среды определяется до 0,1 единицы pH. Для определения pH среды с помощью прибора Михаэлиса необходимо предварительно проверить реакцию среды с помощью лакмусовой бумажки, чтобы знать, каким индикатором и каким рядом ампул из прибора Михаэлиса следует воспользоваться. Так как для большинства питательных сред необходима нейтральная и слабощелочная реакция (pH 7,0-7,2), то из прибора нужно брать индикатор метанитрофенол и ряд ампул с pH 6,8-8,2. При стерилизации pH субстрата обычно снижается на 0,2 единицы, поэтому для создания оптимальных условий для роста микроорганизмов перед стерилизацией приготовляемая среда должна иметь pH 7,2-7,4.
После проверки реакции среды по лакмусу и подбора индикатора берут компаратор, устанавливают в него, пробирки и стандартные ампулы с соответствующим pH (рис. 55). Во вторую пробирку первого ряда (№ 2) в компараторе вливают 2 мл исследуемой питательной среды; сюда же добавляют 4 мл дистиллированной воды и 1 мл 0,3%-ного раствора избранного индикатора (обычно, как уже сказано, метанитрофенола). В две крайние пробирки первого ряда № 1 и 3 вливается по 2 мл питательной среды и по 5 мл дистиллированной воды. В среднюю пробирку второго ряда № 5 помещают только 7 мл дистиллированной воды. В два крайних гнезда второго ряда компаратора № 4 и 6 вставляются ампулы со стандартным раствором с показателями pH, в интервале между которыми устанавливается реакция среды.
Рассматривая пробирки на свет через нижнее отверстие в компараторе на фоне белой матовой пластинки, сравнивают окраску исследуемой жидкости с окраской индикатора. Если окраска в пробирке со средой совпадает с окраской индикатора в одной из ампул, то величина pH среды будет равна значению pH данной стандартной ампулы. Если же цвет исследуемой среды (во второй пробирке) окажется более светлым, чем в стандартной ампуле, то в пробирку со средой по каплям добавляют 10%-ный раствор двууглекислой соды или 0,1 н. раствор едкого натра, используя для этой цели микробюретку. Приливание нейтрализующих растворов по каплям продолжают до тех пор, пока цвет в пробирке не сравняется с цветом в одной из ампул. По количеству миллилитров соды или щелочи, израсходованной на нейтрализацию 2 мл среды (помещенных в пробирку № 2), нетрудно подсчитать, какое количество миллилитров нейтрализующего раствора потребуется для установления уровня pH во всем объеме приготовляемой питательной среды.
В очень кислых средах величину pH определяют с помощью индикатора пара-нитрофенола. Растворы применяемых индикаторов готовят следующим образом.
1. 0,3 г мета-нитрофенола растворяют в 100 мл дистиллированной воды (интервал значений pH от 6,8 до 8,4).
2. 0,1 г пара-нитрофенола растворяют в 100 мл дистиллированной воды (интервал значений pH от 5,4 до 7,0).
Установить приблизительное значение pH среды можно также с помощью универсального индикатора. Для этого в фарфоровую чашку наливают 2-3 мл исследуемой среды и приливают 2-3 капли универсального индикатора. Размешав смесь стеклянной палочкой, сравнивают ее цвет с окраской полос на цветной бумажной шкале. pH исследуемой среды будет такой же, какой указан у равноокрашенной полоски цветной шкалы. Степень точности определения pH универсальным индикатором около 0,5.
Приготовление мясопептонного агара (МПА)
Агар (по-малайски «желе») — сложное органическое вещество, получаемое из морских водорослей. По химическому составу он представляет собой смесь углеводов, относящихся к полисахаридам — производным галактозы — и обладающих желирующей способностью. Добавленный к жидкой среде агар придает ей такую плотность, что расплавление ее наступает лишь при температуре кипения. Плавится агар в воде примерно при 80-86 °С, затвердевает при 36-40 °С. Благодаря этому на агаровых средах можно выращивать культуры микробов при любой температуре, допускающей их жизнь.
Мясопептонный агар готовят из концентрированного мясопептонного бульона. В большую эрленмейеровскую колбу из тугоплавкового стекла емкостью до 2 л, снабженную ватной пробкой, вливают концентрированный мясопептонный бульон, добавляют от 2 до 4% (в зависимости от сорта) мелко нарезанного агара и, не закрывая пробкой, ставят на слабый огонь для расплавления.
Мясопептонный бульон нужно брать с реакцией среды 7,4, потому что при стерилизации pH снизится на 0,2. Реакцию мясопептонного агара можно установить после того, как произойдет полное расплавление. Если агар хорошего качества и не дает осадка, то после установления pH его кипятят 12-15 мин, фильтруют через вату и, разлив в колбы или пробирки (в зависимости от надобности), стерилизуют в автоклаве 20 мин при 120 °С.
Если агар недостаточно очищен, он может дать осадок. В этом случае до стерилизации мясопептонный агар следует осветлить. Для этого к расплавленному и охлажденному до 50 °С мясопептонному агару прибавляют яичный белок, смешанный с 30 мл воды и взбитый до состояния пены. На 1 л среды берут белок одного куриного яйца. Агар тщательно взбалтывают с введенным белком и ставят в автоклав на 10 мин при 120°С. Во время кипения белок свертывается и увлекает с собой все взвешенные частицы. После автоклавирования агар фильтруют через ватно-марлевый фильтр. Для этого берут стеклянную воронку большого диаметра, натягивают на нее марлю, а сверху кладут тонкий слой ваты. Фильтровать кипящий агар нужно быстро и фильтрат до застывания разлить в пробирки по 5-10 мл. Стерилизацию среды проводят в автоклаве, как указано выше.
После стерилизации пробирки со средой, содержащие по 5 мл агара, ставят в наклонное положение, так чтобы агар не касался пробки. После застывания получают «косой» (или скошенный) агар. Пробирки с 10 мл агара помещают в штатив и дают застыть, получая среду, разлитую на «высокий столбик». Косой агар хранить более 4-7 дней не рекомендуется, так как он высыхает.
Мясопептонный агар — основная питательная среда, используемая при бактериологических анализах в микробиологических лабораториях. Его используют как в виде «простого агара», так: и после добавления углеводов, приготовляя сложные дифференциально-диагностические среды.
Источник