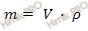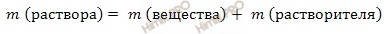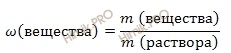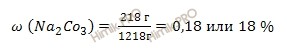Карбонат натрия: способы получения и химические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
1.1. Карбонат натрия при 900–1000º C реагирует с углеродом . При этом образуется натрий и угарный газ:
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
2.4. Карбонат натрия реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната натрия с плавиковой кислотой приводит к образованию фторида натрия, воды и углекислого газа:
2.5. Концентрированный раствор карбоната натрия взаимодействует с оксидом серы . При этом образуются карбонат натрия и углекислый газ:
Источник
Химик.ПРО – решение задач по химии бесплатно
Какова массовая доля карбоната натрия (Na2CO3) в насыщенном при 20 0 С растворе, если растворимость его при этой температуре 218 г/л?
Принимая плотность воды равной 1 г/см 3 , найдем, что масса 1 л воды равна 1000 г:
Учитывая, что масса насыщенного при 20 0 С раствора карбоната натрия (Na2CO3) в расчете на 1000 г воды равна:
Напомню, что насыщенный раствор – это раствор, в котором данное вещество при данной температуре в данном объеме не может больше растворяться.
m (раствора карбоната натрия (Na2CO3)) = 218 г + 1000 г = 1218 (г).
Найдем массовую долю карбоната натрия (Na2CO3) в растворе, используя формулу нахождения массовой доли вещества в растворе:
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Ответ: массовая доля карбоната натрия (Na2CO3) в насыщенном растворе = 0,18 или 18 %.
Источник
Опыт 3. Приготовление раствора карбоната натрия заданной концентрации разбавлением концентрированного раствора
В работе следует приготовить определенный объем раствора карбоната натрия Na2CO3 заданной концентрации (объем и концентрацию указывает преподаватель) из более концентрированного раствора. Концентрацию исходного раствора находят по его плотности, которую определяют с помощью ареометра.
Ареометр – стеклянный поплавок, имеющий вверху шкалу, градуированную в единицах плотности. Действие ареометра основано на законе Архимеда. Для определения плотности ареометр опускают в раствор и по нижнему краю мениска жидкости отсчитывают показание. Концентрацию исследуемого раствора находят, пользуясь табличными данными о плотности в зависимости от концентрации раствора. Плотность водных растворов карбоната натрия приведена в таблице.
Таблица. Плотность водных растворов Na2CO3 при 20 0 С
| С,% (масс.) | r, г/см 3 | С,% (масс.) | r, г/см 3 |
| 1,0086 | 1,0816 | ||
| 1,0490 | 1,1029 | ||
| 1,0398 | 1,1244 | ||
| 1,0606 | 1,1463 |
Если в таблице нет значения плотности, точно соответствующего показанию ареометра, концентрацию находят интерполяцией. Например, измеренная плотность раствора карбоната натрия равна 1,070 г/см 3 . В таблице имеются значения:
Концентрация, % (масс.) r, г/см 3
Полученное значение 1,070 г/см 3 отличается от плотности 6%-ного раствора на 1,070-1,0606 = 0,0094 г/см 3 . Составляем пропорцию
Таким образом, концентрация раствора карбоната натрия с плотностью 1,070 г/см 3 равна 6+0,90 = 6,90 %.
Выполнение работы. В лабораторном журнале записывают форму протокола опыта, в которую в ходе работы вносят получаемые данные:
Объем заданного раствора –
Концентрация заданного раствора –
Плотность исходного раствора –
Концентрация исходного раствора –
Плотность приготовленного раствора (рассчитанная) –
Для приготовления заданного раствора взято:
Плотность приготовленного раствора (измеренная) –
В мерный цилиндр наливают исходный раствор карбоната натрия и ареометром определяют его плотность. По таблице находят концентрацию исходного раствора (в % (масс.)). Если найденная плотность не точно соответствует приведенной в таблице, концентрацию находят (с точностью до 0,1%) интерполяцией.
Рассчитывают, сколько миллилитров исходного раствора и воды следует взять для приготовления указанного объема заданного раствора. Для этого нужно найти следующие данные: плотность раствора заданной концентрации (по табл. 2); массу заданного раствора; массу сухого Na2CO3, содержащегося в заданном растворе; массу исходного раствора, содержащего данное количество Na2CO3; объем исходного раствора; массу воды, которую нужно добавить к исходному раствору (она равна разности масс исходного и заданного растворов).
В мерный цилиндр наливают рассчитанные объемы дистиллированной воды и исходного раствора, сливают их в химический стакан и тщательно перемешивают. Приготовленный раствор наливают в мерный цилиндр и определяют ареометром его плотность. Сравнивают найденное значение плотности с рассчитанным. Если различие составляет более 0,003 г/см 3 , то это показывает, что в расчете допущена ошибка. Ее нужно найти, исправить и снова приготовить раствор.
Опыт 4. Приготовление раствора промежуточной концентрации из растворов большей и меньшей концентрации.
Для того чтобы приготовить раствор определенной концентрации разбавлением более концентрированного раствора или смешением растворов большей и меньшей концентрации. В этих случаях удобно применять правило смешения.
Пример. Приготовить 100 г 14%-ного раствора NaCl из 22%-ного (r=1,168 г/мл) и 10%-ного (r=1,073 г/мл) растворов этой соли. Соотношение массовых частей исходных растворов находят по правилу смешения
Из схемы видно, что если взять 8 г 10%-ного и 4г 22%-ного растворов, то будет получено 12 г 14%-ного раствора. Составляют пропорцию:
на 12г 14%-ного раствора нужно 8 г 10%-ного и 4г 22%-ного
Отсюда х = 100*8/12 = 66,7 г, у = 100*4/12 = 33,3 г
Разделив массы растворов на их плотности, получим: для приготовления 100 г 14%-ного раствора требуется 62 мл 10%-ного и 28,5 мл 22%-ного раствора.
Получают задание, например: приготовить 150 г 8%-ного раствора CaCl2 из 5 и 12%-ного растворов. По правилу смешения находят массы исходных растворов и рассчитывают их объемы. Эти объемы отмеривают цилиндрами и смешивают в стакане. Определяют плотность полученного раствора с помощью ареометра и по табл. Приложения находят его процентную концентрацию. В случае необходимости используют метод интерполяции. Сравнивают найденную концентрацию с заданной. Данные опыта и результаты записывают по форме:
Процентные концентрации исходных растворов и их плотности:
Концентрация конечного раствора, %
Масса или объем конечного раствора, г или мл
Объемы исходных растворов, мл
Плотность конечного раствора, измерения:
Концентрация, соответствующая найденной плотности
Задания:
1) приготовить 200 мл 20%-ного раствора H2SO4 из 96%-ного раствора той же кислоты;
2) 150 мл 10%-ного раствора HCl из 36%-ного раствора HCl;

3) 200 мл 5%-ного раствора карбоната натрия из 10%-ного раствора.
Опыт 5. Определение концентрации раствора по показателю преломления.
Приборы и реактивы. Рефрактометр, стандартные растворы, исследуемые растворы.
Выполнение работы. Ознакомиться с правилами работы на рефрактометре. Перед выполнением работы проверить шкалу рефрактометра по стандартному веществу (дистиллированной воде). Перед началом работы поверхности призм осторожно протереть мягкой салфеткой, не нажимая, чтобы не повредить полированную поверхность измерительной призмы. Перед измерением произвести определение нулевой точки.
Приготовить ряд растворов (1-10%) сахара (сульфата меди). Нанести на нижнюю измерительную призму каплю исследуемой жидкости. Закрыть верхнюю призму. Нанести световой пучок зеркалом на окно нижней призмы. Перемещать рукоятку с окуляром до тех пор, пока визирная линия не совместится с границей полей. Добиться резкого изображения границы полей с вращением маховичка на рукоятке окуляра. Измерить показатель преломления растворов с известной концентрацией и по полученным данным построить калибровочный график. Измерить показатель преломления раствора неизвестной концентрации при той же температуре и графической экстраполяцией найти концентрацию исследуемого раствора.
Опыт 6. Явление тургора и плазмолиза в системах с полупроницаемыми перегородками.
Приборы и реактивы: Хлорид или нитрат натрия NaCl (или NaNO3), свежесрезанные листья растений.
Выполнение работы. В шесть пробирок налить примерно на ¾ их высоты раствор хлорида натрия (или нитрата натрия) следующих концентраций: 0(чистая вода), 0,01, 0,1, 1,0, 3,0, 4,0 моль/л. В каждую из этих пробирок поместить по свежесрезанному листу растения, погрузить его черенком в раствор. Листья должны быть одинаковые, здоровые.
Примерно через сутки в части пробирок листья остались без изменения, как до начала опыта. В другой части пробирок листья привяли (состояние плазмолиза), причем, чем выше концентрация хлорида натрия в растворе, тем больше угнетение (увядание) листьев. Сделать вывод.
Опыт 7. Рост «искусственной клетки» Траубе и древовидных образований.
Приборы и реактивы: Гексацианоферрат калия (крист) K4 [Fe(CN)6], сульфат меди CuSO4, 5%, конторский клей или 50% раствор силиката натрия, 2 сосуда с плоскопараллельными стенками на 100 мл, проекционный фонарь.
Выполнение работы. В сосуд емкостью 100 мл налить почти доверху 5% раствор сульфата меди и бросить в него несколько кристалликов гексацианоферрата калия. Через некоторое время в сосуде появятся причудливые образования.
Объяснение. Кристаллы гексацианоферрата калия, растворяясь в растворе, вступают во взаимодействие с сульфатом меди
Получаемая в результате этой реакции пленка гексацианоферрата меди (II) обволакивает кристаллы желтой кровяной соли вместе с прилегающим к ней раствором, образуется искусственная клетка, способная к дальнейшему росту, так как образовавшаяся пленка обладает полупроницаемостью. Молекулы воды, проникая во внутрь клетки увеличивают ее объем, в результате чего, пленка в конце концов разрывается и содержимое ее (раствор желтой кровяной соли) выливается наружу. Но тут весь процесс вновь повторяется, так как в результате описанной выше реакции снова образуется пленка гексацианоферрата меди, но уже в новых границах – клетка как бы растет, образуя своеобразные отростки и разветвления.
Опыт 8. Получение искусственных полупроницаемых мембран.
Приборы и реактивы. Большие пробирки (или стаканы на 50-100мл), штатив, силикат натрия, соли крист: хлорид железа, хлорид марганца, хлорид магния, сульфат меди, дихлорид меди, сульфат никеля, дихлорид никеля, дихлорид кобальта, хлорид кадмия.
Выполнение работы. Разбавить в 10 раз конторский силикатный клей, или приготовить 30% раствор силиката натрия. В пробирки или цилиндры почти доверху налить раствор силиката натрия. В каждый из них бросить по несколько кристаликов одной из указанных солей (или приготовленный раствор налить в сосуд с плоскопараллельными стенками емкостью 50-100 мл и бросить в него крупные кристаллы солей). Через некоторое время в сосуде из кристаллов вырастут образования, похожие на водоросли. Хлорид железа дает сильно ветвистые образования, хлорид магния — толстые палочки с конусообразной верхушкой, хлорид марганца и сульфат никеля образуют пучки тонких прямых и ветвистых нитей. Картина напоминает подводную растительность.
Объяснение. На поверхности кристалла в результате реакции обмена образуются нерастворимые силикаты и концентрированный раствор хлорида (или сульфата) натрия под пленкой нерастворимой соли. Благодаря разности осмотических давлений, менее концентрированный раствор силиката, проникает через пленку, в результате чего объем раствора под ней увеличивается и пленка лопается. Раствор соли, из которой состоит кристалл, выходит через разрыв в пленке и процесс нерастворимого силиката повторяется. Т. о, за счет прохождения описанных реакций пленка как бы растет, образуя характерные образования различной формы. Для усиления впечатления, после того как водоросли перестанут расти, рекомендуется добавить в сосуд несколько кристаллов дихромат калия, которые придают желтовато зеленую окраску.
Источник