- Приготовление основного раствора
- Большая Энциклопедия Нефти и Газа
- Железоаммонийные квасцы
- Получение и исследование свойств железоаммонийных квасцов
- Получение квасцов путем смешения горячих эквимолярных водных растворов сульфатов соответствующих металлов. Образование комплексных солей. Физико-химические свойства железоаммонийных квасцов. Методы получения и очистки солей, формы и способы применения.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- Экология СПРАВОЧНИК
- Информация
- Квасцы железоаммонийные
Приготовление основного раствора
Сколько граммов железоаммонийных квасцов необходимо взять для приготовления 1 литра раствора с массовой концентрацией железа 0,1 мг/мл?
М(Fe) = 55,85 г/моль
Вычислить массу навески mн?
mн= 0,1 . 482,18 / 55,85 = 0,8634 г.
Методика приготовления раствора
0,8634 г железоаммонийных квасцов взвешивают на аналитических весах, количественно переносят в мерную колбу 1 литр, добавляют 10 мл концентрированной Н2SО4, растворяют, объём в мерной колбе доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
Приготовление рабочего раствора
В мерной колбе 500 мл приготовить рабочий раствор с массовой концентрацией железа 0,01 мг/мл из основного раствора с массовой концентрацией железа 0,1 мг/мл.
Вычислить объём основного раствора?
V = 0,01 . 500 / 0,1 = 50,00 мл
Методика приготовления рабочего раствора
50,00 мл основного раствора отмеряют пипеткой, переносят в мерную колбу 500 мл, разбавляют дистиллированной водой до метки, закрывают пробкой, перемешивают.
Приготовление серии стандартных растворов
В мерные колбы 100,00 мл по бюретке отмеряют рабочий раствор: 0 мл; 1,00 мл; 2,00 мл; 4,00 мл; 10,00 мл; 20,00 мл; 40,00 мл; 60,00 мл. В каждую мерную колбу добавляют дистиллированную воду примерно до 80 мл, затем с помощью пипеток добавляют 2 мл NH4Cl, 2 мл сульфосалициловой кислоты, 2 мл раствора аммиака (рН = 8 – 10). Объём доводят в мерных колбах до метки, закрывают пробкой, перемешивают.
Вычисление концентрации приготовленных стандартных растворов:
2) 0,01 . 1,00 / 100,00 = 0,0001 мг/мл = 0,1 мг/л.
3) 0,01 . 2,00 / 100,00 = 0,0002 мг/ мл = 0,2 мг/л.
4) 0,01 . 4,00 / 100,00 = 0,0004 мг/мл = 0,4 мг/л.
5) 0,01 . 10,00 / 100,00 = 0,001 мг/мл = 1,0 мг/л.
6) 0,01 . 20,00 / 100,00 = 0,002 мг/мл = 2,0 мг/л.
7) 0,01 . 40,00 / 100,00 = 0,004 мг/мл = 4,0 мг/л.
8) 0,01 . 60,00 / 100,00 = 0,006 мг/мл = 6,0 мг/л.
Подготовка пробы анализируемой воды
100,00 мл анализируемой воды отмеряют мерной колбой, переносят в коническую колбу или стакан, добавляют 0,5 мл концентрированной азотной кислоты (для окисления Fe 2+ в Fe 3+ ) и упаривают до малого объёма. Затем разбавляют дистиллированной водой и количественно переносят в мерную колбу 100,00 мл Дистиллированной водой объём раствора доводят примерно до 80 мл. Далее с помощью пипеток приливают 2 мл NН4Сl, 2 мл сульфосалициловой кислоты, 2 мл раствора аммиака (рН = 8 – 10). Объём доводят дистиллированной водой до метки, закрывают пробкой, перемешивают.
Выбор условий определения
Условия определения выбирают через 10 минут.
а) Выбор светофильтра
Для практического выбора светофильтра берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) этого раствора на всех светофильтрах по отношению к холостому раствору. По полученным данным строят график в координатах: абсорбционность (А) — длина волны (l) падающего света.
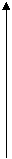 |
А
 |
Для анализа выбирают тот светофильтр, который дает максимальное значение абсорбционности (А).
Для выбора кюветы (толщины поглощающего слоя) берут стандартный раствор максимальной концентрации. Измеряют абсорбционность (А) на выбранном светофильтре во всех кюветах по отношению к холостому раствору. Абсорбционность должна быть близкой к единице.
Дата добавления: 2018-05-12 ; просмотров: 851 ; Мы поможем в написании вашей работы!
Источник
Большая Энциклопедия Нефти и Газа
Железоаммонийные квасцы
Стандартный раствор приготовляют обычно из железоаммонийных квасцов . [31]
К насыщенному на холоду раствору железоаммонийных квасцов приливают по каплям азотную кислоту до исчезновения бурой окраски раствора. [32]
Как при титровании с применением железоаммонийных квасцов , так и при непосредственном титровании растворов урана ( IV), восстановленных в свинцовом редукторе, при определении около 1 мг урана ошибка составляет 2 % ( отн. [33]
К насыщенному на холоду раствору железоаммонийных квасцов приливают по каплям азотную кислоту до исчезновения бурой окраски раствора. [34]
Готовят следующим образом: 40 г железоаммонийных квасцов растворяют при нагревании в 80 мл дистиллированной воды. Раствору дают отстояться и добавляют концентрированной азотной кислоты почти до полного обесцвечивания. [35]
Нами предварительно было проведено изучение растворимости железоаммонийных квасцов в растворах серной кислоты при разных температурах, поскольку такого рода данные в литературе отсутствуют. [36]
При изучении фракционирования микропримесей при кристаллизации железоаммонийных квасцов из водносернокислотных растворов установлено, что в этом процессе достигается 100-кратный эффект очистки отфильтрованных и промытых кристаллов от примесей Со2, Zn2 и Na, а примесь Сг захватывается кристаллической решеткой железоаммонийных квасцов, при этом величина коэффициента сокристаллизации близка к единице. [37]
В результате обработки негативов подкисленным раствором железоаммонийных квасцов малые плотности негатива почти не ослабляются, но плотности выше средних подвергаются заметному ослаблению. [38]
Стандартный раствор: 8 635 г железоаммонийных квасцов помещают и мерную колбу емкостью 1 л и растворяют в воде. К раствору прибавляют 25 мл серной кислоты, доводят объем раствора до I л и тщательно перемешивают. Раствор В годен 1 день. [39]
Готовят следующим образом: к раствору железоаммонийных квасцов прибавляют по каплям азотную кислоту уд. [40]
Тогда отмечают количество миллилитров эталонного раствора железоаммонийных квасцов , израсходованное на титрование дистиллированной воды. [41]
Концентрацию раствора устанавливают титрованием стандартного раствора чистых железоаммонийных квасцов по методике, описанной ниже при определении железа. Концентрацию устанавливают также иодомет-рически. Из бюретки вводят в колбу определенный объем 2 — 10 — 2 M раствора К2Сг2О7 или КЮ3 ( 30 0 мл), добавляют 5 мл 5 М серной кислоты, разбавляют водой до 50 — 60 мл, вводят по 15 мл 10 % — ного раствора иоди-да калия и 40 % — ного раствора роданида аммония. Выделившийся иод титруют устанавливаемым раствором Hg2 ( N03) 2 до слабо-желтой окраски. Далее медленно заканчивают титрование в присутствии крахмала. [42]
Концентрацию раствора устанавливают титрованием стандартного раствора чистых железоаммонийных квасцов по методике, описанной ниже при определении железа. Концентрацию устанавливают также иодомет-рически. Из бюретки вводят в колбу определенный объем 2 — Ю-2 М раствора К2Сг2О7 или Кфз ( 30 0 мл), добавляют 5 мл 5 М серной кислоты, разбавляют водой до 50 — 60 мл, вводят по 15 мл Ю % — ного раствора иоди-да калия и 40 % — ного раствора роданида аммония. Выделившийся иод титруют устанавливаемым раствором. [43]
Для приготовления его 6 0397 г химически чистых железоаммонийных квасцов NH4Fe ( SO4) 2 12Н2О растворяют в 100 мл дистиллированной воды, подкисленной 30 мл 10 % — ного раствора соляной кислоты, и разбавляют водой до 1 л в мерной колбе. Титр раствора устанавливают весовым методом ( см. стр. Для его получения 10 мл раствора I из бюретки переносят в мерную колбу емкостью 100 мл и разбавляют дистиллированной водой до метки. Его получают, перенося 10 мл раствора II из бюретки в мерную колбу емкостью 100 мл и разбавляя его дистиллированной водой до метки. [44]
Типовой раствор железа: 0 864 г железоаммонийных квасцов растворяют в мерной колбе емкостью 1 л в небольшом коли — ( естве воды. К раствору приливают 4 мл серной кислоты уд. Перед проведением анализа 20 мл раствора А в мерной колбе шзбавляют водой до 100 мл. [45]
Источник
Получение и исследование свойств железоаммонийных квасцов
Получение квасцов путем смешения горячих эквимолярных водных растворов сульфатов соответствующих металлов. Образование комплексных солей. Физико-химические свойства железоаммонийных квасцов. Методы получения и очистки солей, формы и способы применения.
| Рубрика | Химия |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 22.05.2014 |
| Размер файла | 61,5 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Министерство образования и науки Российской Федерации
Южно-Уральский государственный университет
Кафедра неорганической химии
Курсовая работа по неорганической химии
Получение и исследование свойств железоаммонийных квасцов
Руководитель: Антошкина Елизавета Григорьевна
Студент группы: Шайхвалеева Светлана Ямгутдиновна
1. Физико-химические свойства
2. Методы получения и очистки
Квасцы — двойные соли (двойными называют соли, образованные двумя разными катионами с одним и тем же анионом), кристаллогидраты сульфатов трёх- и одновалентных металлов общей формулы M+2SO4·M3+2 (SO4)3·24H2O (часто записывается как M+M 3+(SO4)2·12H2O), где M+— один из щелочных металлов (литий, натрий, калий, рубидий или цезий), а M3+ — один из трехвалентных металлов (обычно алюминий, хром или железо(III)). Ион аммония NH4+ может также выступать в роли M+. [2]
Квасцы могут быть получены смешением горячих эквимолярных водных растворов сульфатов соответствующих металлов, при охлаждении таких растворов из них кристаллизуются квасцы.
Раньше этот термин относился только к алюмокалиевым квасцам. Их получали из природных минералов, из которых наиболее пригодным для этого был алунит. Природный алунит обычно находили в виде бесцветных кристаллов, которые римляне называли словом alumen (родительный падеж от aluminis). От этого слова произошло и современное название элемента алюминия. Полученные из алунита квасцы имели сладковатокислый, вяжущий вкус, откуда идёт их название в славянских языках; например, кислота по-польски — kwas; отсюда и русское слово «закваска» вещество, вызывающее кислое брожение. квасцы сульфат эквимолярный
Ко времени возникновения химии практические познания людей уже были и велики и многообразны: умели плавить металлы и стекла, даже окрашенные, похожие на драгоценные камни; изготовлять мыло; во все цвета красить ткани, применяя квасцы и железный купорос в качестве закрепителя; знали много лекарств как природных, так и искусственных; умели использовать процессы брожения, приготовляя хлеб, вино. [3]
К комплексным солям очень близко примыкают так называемые двойные соли, например железоаммонийные квасцы: NH4Fe(SO4)2·12H2O или (NH4)2SO4·Fe2(SO4)3·24H2O. Подобно двойным солям, комплексные соли часто образуются из двух простых солей и могут быть изображены формулами, аналогичными формулам двойных солей. Например, комплексная соль K[Ag(CN)2] соответствует двойной соли AgCN·KCN.
Основное различие между двойными и комплексными солями заключается в том, что двойные соли при диссоциации дают все те ионы, которые находились в растворах простых солей, из которых они были образованы, а комплексные соли диссоциируют с образованием комплексных ионов.
Однако резкой границы между этими солями не существует, т.к. комплексные ионы в свою очередь могут подвергаться диссоциации. В зависимости от величины диссоциации различают более стойкие и менее стойкие комплексные ионы. Например, раствор комплексной соли K4[Fe(CN)6] не дает ни одной реакции, характерной для цианид-ионов или ионов железа, следовательно, диссоциация иона [Fe(CN)6]4- настолько мала, что практически ее можно считать несуществующей, а раствор соли K[MgCl3] дает все реакции ионов магния и хлора. На этом основании K[MgCl3] обычно считают двойной солью с формулой KCl·MgCl2.
Двойные соли — это те же комплексные соединения, но с очень малостойкой внутренней координационной сферой. В растворе любой двойной соли всегда имеются в большем или меньшем количестве комплексные ионы. [4]
Источник
Экология СПРАВОЧНИК
Информация
Квасцы железоаммонийные
Квасцы железоаммонийные, ч, 4,5%-ный раствор. Растворяют 4,5 г квас нов в 60—70 мл воды, прибавляют по каплям хлороводородную кислоту до получения прозрачного раствора, избегая избытка. Объем раствора доводят1 до 100 мл водой.[ . ]
Железоаммонийные квасцы (NH SC • Fe2(SO.i)3• 24Н20, 0,25 н. раствор. 61 г железоаммонийных квасцов вносят в колбу, добавляют 100 мл воды и 310 мл азотной кислоты. Раствор фильтруют через воронку с пористой стеклянной пластинкой № 4 в мерную колбу емкостью 500 мл и доливают водой до метки.[ . ]
Растворяют 2,5 г железоаммонийных квасцов в 100 мл раствора хлорной кислоты (3:2).[ . ]
Железоаммонийные квасцы, ГОСТ 4205—7/, 0,25 н. раствор. Растворяют 60,3 г в 100 мл дистиллированной воды и 320 мл концентрированной азотной кислоты, отфильтровывают и доводят объем водой до 500 мл.[ . ]
Железоаммонийные квасцы, ГОСТ 4205—68. 2 г не-выветрившейся соли растворить, в воде, добавить 0,5 мл крепкой серной кислоты и довести водой до 100 мл. Раствор годен свыше года.[ . ]
Растворяют 10 г NH4Fe(S04)2-12Н20 в 88,5 мл дистиллированной воды и прибавляют 1,5 мл 2%-ной серной кислоты.[ . ]
Железоаммонийные квасцы. Растворяют 100 г соли в 1 л дистиллированной воды, прибавив несколько миллилитров азотной кислоты.[ . ]
Железоаммонийные квасцы, раствор. К насыщенному на холоду раствору железоаммонийных квасцов приливают по, каплям азотную кислоту .до исчезновения бурой окраски раствора.[ . ]
Железоаммонийные квасцы. 61 г железоаммонийных квасцов растворяют в 100 мл дистиллированной воды, добавляют 310 мл азотной кислоты (¡1 = 1,14), Полученный раствор отфильтровывают под вакуумом и объем доводят до 500 мл водой.[ . ]
Квасцы железоаммонийные по нормативно-техническому документу.[ . ]
Квасцы железоаммонийные ч. д. а., насыщенный раствор.[ . ]
При титровании железоаммонийными квасцами в коническую колбу емкостью 250 мл вносят пипеткой 50 мл щелочного раствора, туда же добавляют из бюретки 5 мл раствора бихромата калия (90 г/л) и осторожно при помешивании добавляют 10 мл серной кислоты (уд. вес 1,84). Смесь кипятят 5 мин, охлаждают, разбавляют 100 мл дистиллированной воды и оттитровы-вают избыток бихромата калия раствором железоаммонийных квасцов (159,9 г/л) с 2%-ным раствором железосинеродистого калия в качестве индикатора. Конец титрования отмечают при переходе окраски индикатора от светло-желтой к голубой.[ . ]
Навеску 8,635 г железоаммонийных квасцов (FeNH4(S04)2 х12Н20) помещают в стакан вместимостью 100 см3, растворяют в 50 см3 8%-го раствора серной кислоты, количественно переносят в мерную колбу объемом 1000 см3 и доводят до метки бидистиллированной водой. Полученный раствор имеет концентрацию 1000 мкг/см3 железа.[ . ]
Затем добавляют 100 мл концентрированной азотной кислоты и снова перемешивают. Раствору дают отстояться и сливают прозрачную жидкость над осадком.[ . ]
Салицилат железа, 1 мл раствора железоаммонийных квасцов довести раствором салициловой кислоты до 100 мл. Раствор устойчив при хорошей укупорке и хранении в темноте до 6 месяцев.[ . ]
Ж е л е з o(Fe3+)a м м о н и й сульфат (железоаммонийные квасцы). 30,5 г соли растворяют в 50 мл дистиллированной воды, добавляют 155 мл концентрированной азотной кислоты. Раствор фильтруют под разрежением, создаваемым водоструйным насосом, и доводят объем до 250 мл водой.[ . ]
Железо (Ре3+) аммоний сульфат (квасцы железоаммонийные), х. ч.[ . ]
Стандартный раствор соли железа. Растворяют 0,8634 г железоаммонийных квасцов в дистиллированной воде, к раствору добавляют 10 мл серной кислоты пл. 1,84 г/см3 и разбавляют в мерной колбе до 1 л; отобрав 100 мл полученного раствора, разбавляют водой в мерной колбе снова до 1 л. Получается раствор, в 1 мл которого содержится 0,01 мг железа.[ . ]
Если определение производят в цилиндрах Генера, эталонный раствор железоаммонийных квасцов добавляют в тот цилиндр, в котором находится дистиллированная вода (этот процесс ведут до тех пор, пока окраска жидкостей в обоих цилиндрах не станет примерно одинаковой). После этого выравнивают окраску, уменьшая толщину слоя жидкости в том цилиндре, где она более интенсивна.[ . ]
Соль железа, стандартные растворы. Основной раствор. Растворяют 0,8634 г железоаммонийных квасцов ч. д, a. FeNH SO • 12НгО в дистиллированной воде, прибавив 2 мл концентрированной хлористоводородной кислоты, и разбавляют водой до 1 л. В 1 мл этого раствора содержится 0,100 мг железа.[ . ]
Применяемые растворы. 1. Стандартный раствор железа готовят из железокалиевых или железоаммонийных квасцов. Выбирают светлые фиолетовые кристаллы (но не бесцветные), отвешивают 0,4500 г железокалиевых квасцов Ре2(804)3- К2804 х X 24Н20 или 0,4315 г железоаммонийных квасцов и растворяют в небольшом количестве дистиллированной воды в мерной колбе объемом 500 мл. Для работы готовят растворы необходимой концентрации разбавлением основного раствора.[ . ]
Исходный стандартный раствор железа, содержащий 0,1 мг/мл железа. Растворяют в мерной колбе вместимостью 100 мл 0,0864 г железоаммонийных квасцов РеМН4(504)2-2Н20 в 80 мл воды, добавляют 1 мл концентрированной серной кислоты и доводят до метки водой.[ . ]
Для анализа готовят следующие растворы: I — 40 г CuS04 • 5Н20 в 1 л воды, II — 200 г сегнетовой соли и 150 г tNaOH в 1 л воды и III — 100 г железоаммонийных квасцов и 200 г H2S04 (уд. вес 1,84) в 1 л воды.[ . ]
Щелочной раствор с осадком нагревают до кипения, при этом роданид меди разлагается. Для лучшей коагуляции осажденных: окисей меди можно добавить несколько капель раствора железоаммонийных квасцов. Горячий раствор фильтруют через плотный фильтр (синяя лента) и осадок основательно промывают горячей дистиллированной водой. Сохраненный ранее фильтр, обработанный раствором карбоната натрия, помещают в стакан, добавляют к нему 25 мл раствора карбоната натрия, размельчают фильтр палочкой и смесь короткое время кипятят. Потом раствор фильтруют через фильтр, которым пользовались при отделения окисей меди. Фильтраты соединяют, подкисляют их добавлением 10 мл раствора азотной кислоты и перемешивают. По охлаждении прибавляют 1,5 мл раствора железоаммонийных квасцов и красный раствор титруют 0,05 н. раствором нитрата серебра до обесцвечивания.[ . ]
Проведение анализа. Из каждого поглотительного сосуда берут по 2 мл исследуемого раствора в отдельные пробирки. Добавляют по 0,5 мл 5% раствора едкого кали, по 0,5 мл концентрированной азотной кислоты, по 1 мл дистиллированной воды, по 0,2 мл раствора железоаммонийных квасцов и по 0,1 мл раствора роданида ртути. После добавления каждого реактива растворы перемешивают. Через 10 мин измеряют оптическую плотность растворов на спектрофотометре при 460 нм в кювете с толщиной слоя 10 мм или фотоколориметре с синим светофильтром. В тех же условиях готовят шкалу стандартов (табл. 36).[ . ]
Выделившийся осадок хлорида серебра отфильтровывают, собирая фильтрат в коническую колбу, и тщательно промывают фарфоровую чашку, часовое стекло и осадок на фильтре разбавленной (1:9) азотной кислотой, присоединяя промывные воды к фильтрату. Затем приливают к фильтрату 1—2 мл раствора железоаммонийных квасцов и титруют роданидом, как при установке титра (см. выше).[ . ]
Анализ осуществляется следующим образом. В коническую колбу емкостью 150 ял вливают отмеренные мерными цилиндрами 20 мл раствора I и 20 мл раствора II и хорошо перемешивают. Затем отмеривают пипеткой 20 мл анализируемого раствора сахара (гидролизата) и вливают их в колбу с меднощелочным раствором. Туда же бросают небольшое количестов прокаленного волокнистого асбеста. Раствор слегка перемешивают и ставят на включенную электроплитку. С момента появления первого пузырька кипятят ровно 3 мин (по песочным часам), после чего колбу снимают с плитки и содержимое колбы фильтруют с помощью водоструйного насоса через стеклянный фильтр. Затем фильтр с осадком, покрытым водой, быстро переставляют на чистую отсосную склянку и осадок обрабатывают 20 мл (отмерить мерным цилиндром) раствора железоаммонийных квасцов без отсоса. После растворения осадка подключают водоструйный насос, отсасывают раствор и асбест промывают 25 мл 2 н. H2S04. Собранный раствор титруют 0,08 н. раствором перманганата калия до появления устойчивой розовой окраски.[ . ]
Источник