- Буферные растворы и их приготовление
- Натрий-фосфатный буфер
- Содержание
- Применение
- Приготовление
- Солевой раствор с фосфатным буфером — Phosphate-buffered saline
- СОДЕРЖАНИЕ
- Приложения
- Подготовка
- Приготовление буферных растворов
- Почему точность взвешивания так важна для качества буферного раствора?
- Buffer Preparation
- Видео: приготовление буферного раствора — простота, удобство и точность
- Перейдите в один из следующих разделов, чтобы узнать больше:
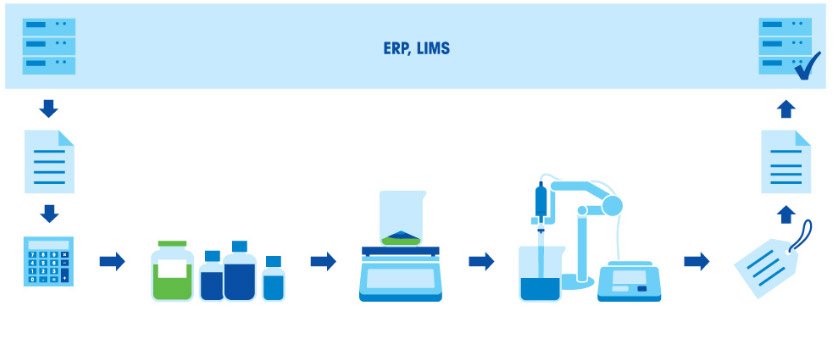
- Как готовить буферные растворы? Стандартная процедура
Буферные растворы и их приготовление
 |  | |
 | Гистохимия: методы Гистохимические методы: введение Буферные растворы и их приготовление Выявление нуклеиновых кислот Выявление (суммарное) белков Гистохимические методы для полисахаридов и протеидов Окрашивание жиров и липидов Металлы, анионы, экзогенные пигменты Гистохимия ферментов Гистохимия нервной системы |  |
 |  |
 |  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
Для приготовления 1 литра однократного натрий-фосфатного буфера используют: [2]
Десять литров стокового раствора десятикратного PBS можно приготовить растворив 800 г NaCl, 20 г KCl, 144 г Na2HPO4 и 24 г KH2PO4 в восьми литрах дистиллированной воды, доведя далее объём до десяти литров. рН получившегося раствора будет примерно 6,8, но после разведения до однократного PBS станет равным 7,4. После приготовления раствора следует проверить значение рН при помощи рН-метра. При необходимости, можно скорректировать рН при помощи соляной кислоты или гидроксида натрия. Наиболее простым способом приготовления натрий-фосфатного буфера является использование коммерчески доступных таблетированных препаратов. Такие таблетки разводят дистиллированной водой до заданного объема и получают раствор заданной концентрации. Для клеточных культур раствор должен быть разлит на аликвоты и стерилизован автоклавированием (20 минут при 121 °C, в режиме жидкость). Стерилизация не является необходимой, в зависимости от особенностей использования. Возможно хранение натрий-фосфатного буфера при комнатной температуре, однако для предотвращения размножения бактерий длительное хранение нестерильного буфера рекомендуют осуществлять в холодильнике. Соли в концентрированных стоковых растворах при охлаждении могут выпадать в осадок, поэтому перед применением рекомендуют нагреть концентрированный раствор до комнатной температуры и дождаться полного растворения осадка. Источник Солевой раствор с фосфатным буфером — Phosphate-buffered salineСолевой раствор с фосфатным буфером (сокращенно PBS ) — это буферный раствор, обычно используемый в биологических исследованиях . Это представляет собой водный раствор на основе соли , содержащий вторичный кислый фосфат натрия , хлорид натрия и, в некоторых составах, хлорид калия и дигидрофосфат калия . Буфер помогает поддерживать постоянный pH. В осмолярности концентрация и ионов в растворах совпадает с телом человека ( изотонического ). СОДЕРЖАНИЕПриложенияPBS имеет множество применений, потому что он изотоничен и нетоксичен для большинства клеток. Эти виды использования включают разбавление веществ и ополаскивание контейнеров для клеток. PBS с ЭДТА также используется для отделения прикрепленных и слипшихся клеток. Однако нельзя добавлять двухвалентные металлы, такие как цинк , так как это приведет к выпадению осадка. Для таких приложений рекомендуются буферы Гуда . Было показано, что PBS является приемлемой альтернативой вирусной транспортной среде в отношении транспорта и хранения РНК-вирусов, таких как SARS-CoV-2. ПодготовкаСуществует множество различных способов приготовления растворов PBS (один из них — фосфатно-солевой буфер Дульбекко (DPBS), состав которого отличается от состава стандартного PBS). Некоторые составы не содержат калий и магний, в то время как другие содержат кальций и / или магний (в зависимости от того, используется ли буфер для живой или фиксированной ткани: последний не требует KCl или MgCl 2 ).
Начните с 800 мл дистиллированной воды, чтобы растворить все соли. Добавьте дистиллированную воду до общего объема 1 литр. Полученный 1 × PBS будет иметь конечную концентрацию 157 мМ Na + , 140 мМ Cl — , 4,45 мМ K + , 10,1 мМ HPO 4 2- , 1,76 мМ H 2 PO 4 — и pH 7,96. Добавьте 2,84 мМ HCl, чтобы сдвинуть буфер до 7,3 мМ HPO 4 2- и 4,6 мМ H 2 PO 4 — для конечного pH 7,4 и концентрации Cl — 142 мМ.
PH PBS составляет 7,4. При приготовлении буферных растворов рекомендуется всегда измерять pH напрямую с помощью pH-метра. При необходимости pH можно отрегулировать с помощью соляной кислоты или гидроксида натрия. PBS также может быть приготовлен с использованием коммерческих таблеток или пакетов с буфером PBS. Если раствор используется для культивирования клеток, его можно разделить на аликвоты и стерилизовать автоклавированием или фильтрацией . Стерилизация может не потребоваться в зависимости от ее использования. PBS можно хранить при комнатной температуре или в холодильнике. Однако концентрированные исходные растворы могут выпадать в осадок при охлаждении, и перед использованием их следует хранить при комнатной температуре до полного растворения осадка. Источник Приготовление буферных растворовПочему точность взвешивания так важна для качества буферного раствора?Приготовление буферных растворов — распространенная процедура в химических и биохимических лабораториях. Буферный раствор — это смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Буферные растворы позволяют поддерживать стабильный уровень pH другого раствора, смешанного с буферным. Если в раствор попадает небольшое количество другой кислоты или щелочи или они образуются в ходе химической реакции, буферный раствор не допустит изменения значения pH всего раствора. Поэтому буферы очень полезны в разных задачах, где требуется поддержание стабильного уровня pH. Другие названия буферных растворов — также pH-буферы, водород-ионные буферы или просто буферы. Например, в крови человека содержатся естественные буферы для поддержания рН в диапазоне от 7,35 до 7,45 — именно при таком уровне могут нормально действовать энзимы. Поскольку активность энзимов зависит от pH, при проведении биохимических анализов необходимо поддержание этого параметра на постоянном уровне. Буферные растворы применяются в шампунях для предотвращения раздражения кожи, в детских лосьонах для противодействия росту бактерий, а также в растворах для контактных линз, чтобы уровень pH жидкости оставался совместимым с уровнем рН глаз. Приготовление буферного раствора состоит из нескольких этапов: взвешивание компонентов, растворение компонентов, корректировка pH и дополнение до заданного объема. Поскольку итоговое значение pH в буфере зависит от соотношения кислоты и основания, чрезвычайно важно взвешивать компоненты с высокой точностью. Все используемое оборудование (весы, пипетки и рН-метр) должно быть правильно откалибровано и иметь достаточную точность. Buffer PreparationВидео: приготовление буферного раствора — простота, удобство и точностьДля приготовления буферного раствора нужны время и особая тщательность, иначе раствор не будет действовать так, как требуется. Если качество продукции или биохимических анализов зависит от качества буферных растворов, ошибки при приготовлении буферов недопустимы. Посмотрите видео и узнайте, как можно сэкономить время и силы, если готовить буферные растворы с помощью технических весов и рН-метров МЕТТЛЕР ТОЛЕДО. Перейдите в один из следующих разделов, чтобы узнать больше:Как готовить буферные растворы? Стандартная процедураПриготовление буферного раствора состоит из нескольких этапов: расчет концентрации и количества компонентов в соответствии с назначением и нужным объемом раствора; взвешивание компонентов; растворение компонентов; корректировка pH; дополнение до заданного объема; маркировка и документирование; использование раствора или его сохранение для применения в будущем.
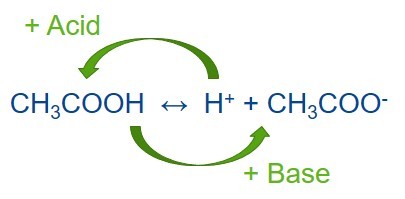
Буферный раствор — это раствор, сохраняющий свой показатель pH при добавлении небольшого количества кислоты или основания. Буферный раствор состоит из слабой кислоты и сопряженного с ней основания. Постоянный уровень pH в буферном растворе поддерживается благодаря поглощению протонов, которые высвобождаются в ходе реакции, или высвобождению протонов, если в ходе реакции они поглощаются. К созданию буферных растворов привело открытие того, что частично нейтрализованные растворы слабых кислот или оснований не меняют pH при добавлении к ним небольшого количества сильной кислоты или основания. Сопряженное основание — это кислота, потерявшая протон. Сопряженная кислота — это основание, которое приобрело протон. Так устанавливается равновесие между диссоциированной и недиссоциированной формами. Ацетат натрия также диссоциирует в воде с образованием такого же ацетат-иона: Водный раствор смеси уксусной кислоты и ацетата натрия поэтому может поглощать ионы H + , добавляемые с кислотой, присоединяя ионы водорода к ацетатному основанию и образуя уксусную кислоту. Когда же в раствор попадают ионы OH — из-за добавления щелочи, они соединяются с молекулами кислоты (H + ) и образуют воду. Таким образом система пытается восстановить равновесие, и pH раствора остается на одном уровне. Так проявляется буферное действие раствора. Что происходит после добавления кислоты в буферный раствор? Когда к равновесной смеси слабой кислоты и ее сопряженного основания добавляется сильная кислота (с большим количеством H+), точка равновесия смещается влево в соответствии с принципом Ле Шателье. Что происходит после добавления основания в буферный раствор? Аналогичным образом, если в смесь добавляется сильное основание, то концентрация ионов водорода снижается меньше, чем ожидалось с учетом количества добавляемого основания. Это происходит потому, что точка равновесия смещается вправо, чтобы компенсировать потерю H + в реакции с основанием. Разновидности буферных растворов Буферные растворы, состоящие из слабой кислоты и ее сопряженного основания, считаются кислыми и имеют рН 7. Примером щелочного буфера может служить водный раствор гидроксида аммония (слабое основание) и хлорида аммония (сопряженная кислота), имеющий рН 9,25. На что следует обращать внимание при приготовлении буферного раствора Буферы работают наиболее эффективно, если их pH примерно равен pH исследуемой системы или раствора. При изучении энзимов в биологии человека необходима система, соответствующая pH крови (7,35–7,45), в противном случае энзимы будут функционировать неправильно. Если у буферной системы pH выходит за пределы требуемого диапазона, это также отрицательно повлияет на анализ. Поэтому необходимо знать, как приготовить буферные растворы с заданным pH. Это можно сделать несколькими способами:
Сначала кристаллическая кислота или основание растворяется в объеме воды, равном примерно 60–70 % от требуемого конечного объема буферного раствора. Показатель pH проверяется, а затем корректируется. Если используется кристаллическая кислота, то для коррекции pH применяют основание, не выделяющее ионы, способные нарушить параметры исследуемой системы. Если используется кристаллическое основание, то рН корректируется с помощью подходящей кислоты. После достижения требуемого pH в буферный раствор можно долить воду, чтобы получить нужный объем. Смешивание с раствором кислоты или основания Уравнение Гендерсона — Гассельбаха. где pKa — константа диссоциации слабой кислоты; Если в точке равновесия концентрации сопряженного основания и кислоты одинаковы, то pH равно константе диссоциации. В этой точке буферный раствор обладает максимальной буферной емкостью. Преимущества универсальных буферных растворов Дополнительные советы по приготовлению и использованию буферных растворов
Источник |