Нитрат ртути I
| Нитрат ртути I | |
|---|---|
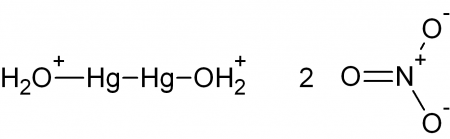 | |
| Систематическое наименование | Нитрат ртути I |
| Хим. формула | Hg2(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 525.2 г/моль |
| Плотность | 4,79 г/см³ |
| Температура | |
| • плавления | 70 °C |
| Энтальпия | |
| • образования | -868 кДж/моль |
| Рег. номер CAS | [7782-86-7] |
| PubChem | 51346573 |
| Рег. номер EINECS | 233-886-4 |
| SMILES | |
| ChemSpider | 9493944 и 21493988 |
| Токсичность | Чрезвычайно токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат ртути I — химическое соединение, существует только в виде димера Hg2(NO3)2 .
Синонимы: динитрат диртути, ртуть азотнокислая закисная.
Содержание
Физические и химические свойства
В чистом виде — бесцветные кристаллы, в воде гидролизуются, растворимы в сероуглероде и азотной кислоте. Растворы обладают сильными восстановительными свойствами. Для предотвращения частичного окисления кислородом воздуха, в растворы нитрата ртути добавляют свободную ртуть.
Образует кристаллогидрат Hg2(NO3)2•2H2O. На воздухе теряет кристаллогидратную воду.
Неустойчив, при добавлении щелочи к раствору соли образуется чёрный осадок:
Разлагается при температуре 70-150°C:
Концентрированный раствор соли гидролизуется водой с образованием осадка основной соли:
Реагирует с разбавленной хлороводородной кислотой:
Окисляется горячей концентрированной азотной кислотой:
Может также окислиться разбавленной азотной кислотой в присутствии кислорода:
Выпадение желтого осадка ртути при реакции с медью:
Hg2(NO3)2 + C u → 2 H g ↓ + C u ( N O 3 ) 2
Реагирует с насыщенным раствором сероводорода:
Выпадает осадок дийодида диртути при добавлении йодида калия:
На холоду реагирует с гидрокарбонатом калия:
Получение
Соль может быть получена из металлической ртути при действии разбавленной азотной кислоты на холоду:
А также при добавлении жидкой ртути к нитрату ртути:
Производство
В СССР выпускался химический реактив Ртуть I азотнокислая 2-водная нескольких квалификаций по ГОСТ 4521-78.
Применение
- В химическом анализе в меркуриметрических методах объёмного анализа.
- Чернение латуни
- Компонент глазурей
- Компонент пиротехнических составов
Токсикология и физиологические свойства
Как и многие другие соединения ртути, нитрат ртути I Hg2(NO3)2 (ртуть азотнокислая, закисная, динитрат диртути, нитрат диртути 2+) — это очень токсичное вещество. Сильнейший неорганический яд. В высоких концентрациях вредно влияет на центральную нервную систему.
Источник
Нитрат ртути(I)
| Нитрат ртути(I) | |
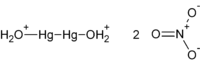 | |
| Общие | |
|---|---|
| Систематическое наименование | Нитрат ртути(I) |
| Химическая формула | Hg2(NO3)2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кристаллы |
| Отн. молек. масса | 525.2 а. е. м. |
| Молярная масса | 525.2 г/моль |
| Плотность | 4,79 (для гидрата при 4 °C), г/см³ |
| Термические свойства | |
| Температура плавления | 70 (для гидрата) °C |
| Классификация | |
| Рег. номер CAS | [7782-86-7] |
Нитрат ртути(I) — химическое соединение, существует только в виде димера Hg2(NO3)2.
Синонимы: динитрат диртути, ртуть азотнокислая закисная.
Содержание
Свойства
В чистом виде — бесцветные кристаллы, в воде гидролизуются, растворимы в сероуглероде и азотной кислоте. Растворы обладают сильными восстановительными свойствами. Для предотвращения частичного окисления кислородом воздуха, в растворы нитрата ртути добавляют свободную ртуть.
Образует кристаллогидрат Hg2(NO3)2·2H2O. На воздухе теряет кристаллогидратную воду.
При разбавлении нитрата ртути водой на холоде медленно, а при нагревании быстрее, выпадает лимонно-желтый осадок основной соли Hg2OH(NO3).
Неустойчив, при добавлении щелочи к раствору соли образуется черный осадок:
Получение
Может быть получена по реакциям обмена или из металлической ртути при действии азотной кислоты и нагревании не выше 45 °C.
Производство
В СССР выпускался химический реактив Ртуть (I) азотнокислая 2-водная нескольких квалификаций по ГОСТ 4521-78.
Применение
- В химическом анализе в меркуриметрических методах объёмного анализа.
- Чернение латуни
- Компонент глазурей
- Компонент пиротехнических составов
Безопасность обращения
См. также
Литература
Химическая энциклопедия: В 5 т. / Н. С. Зефиров (гл. ред.) и др. — М .: Большая Российская энцикл, 1995. — Т. 4. — С. 279. — 639 с. — 20 000 экз. — ISBN 5—85270—092—4
Источник
Как приготовить нитрат ртути
Цель: повторить и обобщить сведения о свойствах, способах получения и применении ртути и её соединений.
Оборудование: Периодическая система химических элементов Д.И. Менделеева (приведена в электронном учебном пособии).
Реактивы: нитрата ртути (II), раствор гидроксида калия, раствор йодида калия
Посуда и приборы: стаканы на 100 мл (2 шт.), стеклянная палочка, пипетка, магнитная мешалка.
Содержание урока соответствует части IV.8 электронного учебного пособия.
Знакомство с химией ртути и её соединений следует начать с исторической справки. Ртуть – это металл, известный с древнейших времен. В Древнем Египте металлическую ртуть и киноварь использовали еще в III тысячелетии до нашей эры. Индусы знали ртуть во II–I вв. до н.э., знали о ней и в Древнем Риме.
Охарактеризовать положение ртути в Периодической системе химических элементов Д.И. Менделеева. Ртуть расположена в 12 группе Периодической системы химических элементов Д.И. Менделеева. В шестом периоде ртуть является последним d-элементом, его валентные электроны 5d 10 6s 2 . В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d 10 является очень устойчивой. В соединениях для ртути характерны степени окисления +1 и +2.
Остановиться на распространенности ртути в земной коре: ртуть принадлежит к числу редких и рассеянных элементов. Иногда встречается самородная ртуть, в виде озер или амальгам с золотом, серебром и палладием. Основной минерал ртути – киноварь HgS.
При изучении физических свойств ртути отметить, что это серебристо-белый, единственный жидкий при нормальных условиях металл, очень токсичен. Самая тяжелая из всех жидкостей, её плотность 13,6 г/см 3 . Плохо проводит тепло и электрический ток. Пары ртути при высоких температурах излучают голубовато-зеленый цвет, богатый ультрафиолетовыми лучами. Многие металлы хорошо растворяются в ртути, образуя сплавы – амальгамы.
При изучении химических свойств ртути обратить внимание, что ртуть, в отличие от цинка, малоактивный металл, в сухом воздухе устойчива, подобно благородным металлам. Способна реагировать с кислородом, серой, галогенами и фосфором, с водородом, азотом, бором, кремнием, углеродом ртуть не взаимодействует. В электрохимическом ряду напряжений металлов ртуть находится после водорода; с водой, щелочами и неокисляющими кислотами не взаимодействует. Растворяется в разбавленной и концентрированной азотной кислоте и концентрированной серной кислоте, образуя соли ртути и продукты восстановления кислот. Ртуть взаимодействует с солями ртути (II) с образованием солей ртути (I). Другие металлы, из-за малой активности, вытеснять из растворов не может.
Рассмотреть способы получения ртути. Ртуть получают пирометаллургическим методом из ртутного концентрата, содержащего преимущественно сульфид ртути (II) или при восстановлении её из сульфида более активным металлом.
Рассмотреть свойства соединений ртути. Ртуть образует два ряда соединений: соединения ртути (I) и соединения ртути (II). Ртуть – единственный металл, способный образовывать устойчивый двухатомный катион 


Продемонстрировать реакцию получения оксида ртути (II). В стакан налить раствор нитрата ртути (II), поставить стакан на магнитную мешалку и включить перемешивание. Небольшими порциями прилить щелочь до выпадения осадка оксида ртути (II):
Обратить внимание учащихся, что гидроксид ртути (II) не образуется.
Познакомить учащихся с комплексными соединениями ртути. Для ртути (II) характерно образование устойчивых комплексных соединений. Возможно образование устойчивых аквакомплексов, аммиачных, цианидных, йодидных и сульфидных комплексов.
Продемонстрировать получение йодидного комплекса ртути (II). В стакан налить раствор нитрата ртути (II), поставить стакан на магнитную мешалку и включить перемешивание. Небольшими порциями (из пипетки по каплям) прилить раствор йодида калия до выпадения осадка ярко-оранжевого осадка йодида ртути (II):
продолжить приливание раствора йодида калия до растворения осадка и образования прозрачного светло-желтого раствора тетрайодомеркурата (II) калия:
Для ртути (I) образование устойчивых комплексных соединений не характерно.
Обратить особое внимание на токсичность ртути и её соединений, на правила обращения с ртутью.
Рассмотреть основные области применения ртути и её соединений.
После изучения материала предложить учащимся самостоятельно познакомиться с примерами решения задач и выполнить задания для самостоятельного решения (приведены в электронном учебном пособии).
Источник
Нитрат ртути.
10 Jul 2017 в 19:26
10 Jul 2017 в 19:26 #1
3 термометра с 2гр ртути каждый. Итого 6гр ртути.
Смешиваю с 200мл азотной кислоты. Ставлю эту смесь в водяную баню — 90 град. Проходит реакция.
После окончание выделения бурого дыма (оксида азота) фильтрую что получится. Должно выйти примерно грамм 10 нитрата ртути. Белые кристаллы.
10 Jul 2017 в 19:27 #2
Не сложные схемы заработка, лучше майнить
10 Jul 2017 в 19:28 #3
Ты это у себя в гараже делаешь?
10 Jul 2017 в 19:28 #4
Не сложные схемы заработка, лучше майнить
А что такое майнить?
Ты это у себя в гараже делаешь?
В ванной под вытяжкой)
10 Jul 2017 в 19:30 #5
Будь ты проклят, загуглил и теперь ко мне стучатся люди в красном.
10 Jul 2017 в 19:32 #6
Будь ты проклят, загуглил и теперь ко мне стучатся люди в красном.
В красном? Ш***и в красных пеньюарах чтоль?
10 Jul 2017 в 19:35 #7
9, 67 г но офк зависит от концентрации азотной к-ты, то есть может получится меньше
10 Jul 2017 в 19:37 #8
Что ты собираешься с ним делать ?
10 Jul 2017 в 19:37 #9
3 термометра с 2гр ртути каждый. Итого 6гр ртути.
Смешиваю с 200мл азотной кислоты. Ставлю эту смесь в водяную баню — 90 град. Проходит реакция.
После окончание выделения бурого дыма (оксида азота) фильтрую что получится. Должно выйти примерно грамм 10 нитрата ртути. Белые кристаллы.
10 Jul 2017 в 19:43 #10
ТС пытается химичить со ртутью — ядовитым жидким металлом, наверняка в домашних условиях и будучи не уверен в результате
Удачи там парами подышать
Да, чуть не забыл, паря — это сайт по дотке и аниме, а не химия.первыйкурс.ру, ты немного не в ту сторону завернул
10 Jul 2017 в 19:44 #11
Что ты собираешься с ним делать ?
Конечно же варить синие кристаллы
Будь ты проклят, теперь я должен денег Гусу.
Источник


