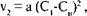- Как приготовить пересыщенный раствор с сахаром — Наука — 2021
- подсказки
- Предупреждения
- Как приготовить пересыщенный раствор сахара
- Как приготовить пересыщенный раствор сахара
- Пересыщенные растворы сахарозы
- ТЕХНОЛОГИЯ КОНДИТЕРСКОГО ПРОИЗВОДСТВА
- ОТДЕЛКА, РАСФАСОВКА И УПАКОВКА МУЧНЫХ КОНДИТЕРСКИХ ИЗДЕЛИЙ
- ПРОИЗВОДСТВО ВАФЕЛЬ
- ВЫПЕЧКА И ОХЛАЖДЕНИЕ ИЗДЕЛИЙ
- Продажа шагающий экскаватор 20/90
Как приготовить пересыщенный раствор с сахаром — Наука — 2021
«Пересыщенный» раствор содержит больше растворенного вещества, чем должно, в зависимости от растворимости соединения. В случае сахара, химическое название которого «сахароза», около 211 граммов растворяется в 100 миллилитрах воды. Первый ключ к приготовлению пересыщенных растворов заключается в температуре воды. Растворимость зависит от температуры; больше сахара будет растворяться в горячей воде, чем в холодной. Второй ключ к приготовлению пересыщенных растворов заключается в предотвращении кристаллизации (затвердевания) избыточного сахара при охлаждении раствора. Как правило, быстрое охлаждение приводит к пересыщенным растворам, тогда как медленное охлаждение способствует кристаллизации.
Принесите 8 унций воды почти до кипения в 2-Qt. кастрюля Это составляет около 240 миллилитров воды, которая, согласно растворимости сахарозы, должна растворять около 500 граммов (18 унций) сахара.
Добавьте 16 унций. (1 фунт) сахара на сковороду и размешайте до полного растворения. Продолжайте добавлять сахар в раствор около 1 унции. (2 ст. Ложки) за один раз, пока сахар не растворится в горячей воде.
Перенесите раствор (медленно) в чистый стакан и поместите стакан в морозильную камеру примерно на 15 минут. Если в кастрюле присутствует нерастворенный сахар, не переносите его в стакан; любой кристаллический сахар обеспечивает «семя» для дополнительного кристаллизации сахара.
Налейте перенасыщенный раствор в миску или сковороду, содержащую кристаллический сахар. Это должно вызвать почти мгновенную кристаллизацию сахара из раствора. Альтернативно, разбрызгивание нескольких кристаллов сахара в стакан, содержащий раствор, должно также вызвать быструю кристаллизацию.
подсказки
Если пересыщенный раствор кристаллизуется при охлаждении (если при извлечении его из морозильной камеры это белое твердое вещество), попробуйте использовать другое стекло, предпочтительно с очень гладкими стенками. Царапины на стекле также действуют как «затравочные» кристаллы, вызывая кристаллизацию.
Предупреждения
Этот эксперимент включает кипящую воду; Будьте осторожны при обращении с кастрюлями и другими контейнерами.
Источник
Как приготовить пересыщенный раствор сахара
Вылейте кристаллы сахара в воду и размешайте, и сахар растворится. Продолжайте наливать и перемешивать, и в определенный момент больше не будет растворяться, и кристаллы упадут на дно стакана. В этот момент решение называется насыщенным. Но подождите — вы можете заставить больше кристаллов сахара растворяться, нагревая воду. Когда вы достигли точки насыщения, и больше сахара растворяется, вы получаете перенасыщенный раствор. Вы можете сделать это с солью, сахаром, кристаллами ацетата натрия и всем остальным, что растворяется в воде. На самом деле, вам даже не нужна вода для создания пересыщенного раствора. Вы можете сделать это с помощью спирта, растворителя или любого другого растворителя. Однако проще всего делать это с водой, потому что вода — лучший растворитель в мире.
Что такое насыщенный раствор?
Вода является одним из самых интересных и важных химических соединений, которые есть. Каждая молекула воды состоит из двух положительно заряженных атомов водорода и отрицательно заряженного атома кислорода. Атомы водорода располагаются на гораздо большем атоме кислорода, чтобы создать чистую полярность от одной стороны молекулы к другой. Из-за этого молекулы воды образуют связи друг с другом в процессе, называемом водородной связью.
Когда вы вводите растворенное вещество, такое как сахар или соль, молекулы воды притягиваются к растворенным атомам и молекулам сильнее, чем они притягиваются друг к другу. Они окружают молекулы растворенного вещества, и, поскольку они делают, растворенное вещество постепенно распадается. Составляющие его атомы и молекулы уходят, каждый из которых окружен молекулами воды, и растворенное вещество растворяется. Если вы продолжаете помешивать в большем количестве растворенного вещества, у вас, в конце концов, кончаются молекулы воды, чтобы выполнить эту работу, и в этот момент раствор насыщается.
Как сделать пересыщенный раствор
Способ сделать пересыщенный раствор состоит в том, чтобы добавить тепло, но небольшое нагревание не справится с работой. Вы должны нагреть воду близко к точке кипения. Когда вода становится такой горячей, молекулы воды имеют больше свободы для перемещения, и между ними появляется больше места для растворенных молекул. Вы можете продолжать помешивать в соли, сахаре или любом другом растворенном веществе, и оно будет продолжать растворяться, даже если точка насыщения достигнута. Уберите тепло и дайте раствору постепенно остыть, и раствор останется растворенным, по крайней мере, на некоторое время. По сути, это перенасыщенное определение. Пересыщенный раствор крайне нестабилен, и могут происходить странные вещи.
Горячий лед, горная леденец и кристаллическая формация
Вы когда-нибудь слышали о горячем льде? Его получают из пересыщенного раствора воды и кристаллов ацетата натрия. Когда вы вводите один кристалл ацетата натрия в такой раствор, это как триггер, который инициирует внезапную реакцию, в результате которой весь избыток ацетата натрия в растворе быстро кристаллизуется. Это экзотермический процесс, при котором выделяется тепло, поэтому в процессе реакции образуются ледяные кристаллы, но также выделяется тепло, отсюда и название горячий лед. Чтобы увидеть драматическую демонстрацию образования кристаллов, медленно наливайте перенасыщенный раствор в несколько нерастворенных кристаллов. Кристаллизация происходит так быстро, что кристаллическая башня образуется, когда вы льете.
Аналогичный процесс происходит, когда вы нагреваете воду до температуры кипения, добавляете сахар, дайте раствору остыть и суспендируете в растворе нитку. Сахар постепенно слипается в нити и образует большой кристалл, который вы можете наслаждаться как леденец. Слово для мудрых: наслаждайтесь леденцами в умеренных количествах и обязательно почистите зубы. Сахар способствует образованию полостей.
Источник
Как приготовить пересыщенный раствор сахара
§7.6. Растворы. Как происходит растворение. Насыщенные растворы
Если в сосуд с водой поместить кристаллы поваренной соли, сахара или перманганата калия (марганцовки), то мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода, в которую были добавлены кристаллы, приобретает новые свойства: у нее появляется соленый или сладкий вкус (в случае марганцовки появляется малиновая окраска), изменяется плотность, температура замерзания и т.д. Полученные жидкости уже нельзя назвать водой, даже если они неотличимы от воды по внешнему виду (как в случае с солью и сахаром). Это – растворы .
Растворы не отстаиваются и сохраняются все время однородными. Если раствор профильтровать через самый плотный фильтр, то ни соль, ни сахар, ни марганцовокислый калий не удается отделить от воды. Следовательно, эти вещества в воде раздроблены до наиболее мелких частиц – молекул или ионов.
Растворами называются гомогенные (т.е. однородные) смеси переменного состава из двух или более веществ. Наиболее распространенное агрегатное состояние растворов – жидкое.
Под переменным составом раствора понимают то простое обстоятельство, что соотношение смешанных друг с другом веществ может непрерывно изменяться в определенных пределах. Например, раствор соли можно разбавлять чистой водой или, наоборот, упаривать, но полученные при этом жидкости в любом случае будут называться растворами соли. Приведнное выше определение не охватывает всех свойств растворов, поэтому в конце параграфа мы его уточним.
Любой раствор состоит из растворителя и растворенного вещества:
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.
Не всегда обязательно вода является растворителем – существуют и неводные растворы. Однако когда речь идет о водных растворах, воду считают растворителем и в тех случаях, когда ее меньше. Например, говорят о 96%-ном растворе этилового спирта в воде, а не о 4 %-ном растворе воды в спирте.
** Существуют растворы не только жидкие, но и твердые. В твердых растворах частицы одного вещества хаотично распределены среди частиц какого-нибудь другого, но обязательно твердого вещества. Например, водород охотно растворяется в некоторых металлах (платине, палладии), и это пример твердого раствора. Смеси газов (например, воздух) не называют растворами. Дело в том, что важным свойством растворов является заметное взаимодействие между частицами растворителя и растворенных веществ, а в газах такое взаимодействие практически отсутствует.
Давайте разберемся в том, как происходит растворение веществ. Для этого понаблюдаем, как растворяется добавленный в чай сахар. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро.
Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды межмолекулярные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя (рис. 7-2).
Рис. 7-2. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки). Между молекулами сахара и воды возникают межмолекулярные связи, благодаря которым молекулы сахара отрываются от поверхности кристалла. Молекулы воды, не связанные с молекулами сахара, на рисунке не показаны.
Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря тепловому движению. Это явление называется диффузией . Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не диффундировавших в раствор молекул сахара. Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными или другими межмолекулярными связями. Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему. При растворении перманганата калия диффузию частиц в растворе можно наблюдать визуально благодаря интенсивной малиновой окраске этого вещества.
Растворение веществ можно сравнить с перетаскиванием мебели. Представьте, что на время ремонта школьные столы (или парты) составили в спортзале в строгом порядке аккуратным штабелем. Этот упорядоченный штабель является моделью кристаллического вещества, а каждый стол – как бы «молекулой» такого вещества. После окончания ремонта учеников попросили помочь перетащить столы. В спортзал вбежала ватага учеников (эта ватага не что иное, как растворитель, а каждый ученик – молекула растворителя), кто-то залез наверх, кто-то тянет столы снизу – короче, работа закипела. Очень скоро столы, каждый из которых несут где двое, а где четверо ребят, оказываются в разных концах школы, а от штабеля в спортзале не остается и следа.
Количество молекул, способных перейти в раствор, часто ограничено. Молекулы вещества не только покидают кристалл, но и вновь присоединяются к кристаллу из раствора. Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
Например, при комнатной температуре мы не можем растворить в 100 мл воды более 200 г сахара или более 35,9 г поваренной соли. В таких случаях говорят, что раствор стал насыщенным .
Раствор, в котором данное вещество при данной температуре уже больше не растворяется, называется НАСЫЩЕННЫМ.
В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества.
** Если вернуться к примеру со школьными столами, то там тоже возможно образование «насыщенного раствора». Это может произойти в том случае, если столов окажется слишком много и для них в классах уже не будет хватать места. В этом случае часть учеников будет просто-напросто вынуждена вернуться и поставить столы в тот же штабель, откуда они были взяты. Таким образом, количество мебели в спортзале перестанет уменьшаться. Разумеется, ученики гораздо умнее молекул воды и не станут дальше делать бесполезную работу. В реальном растворе, где есть тепловое движение молекул, молекулы продолжают “трудиться”, транспортируя частицы растворенного вещества из кристалла в раствор и обратно.
Такая ситуация называется ДИНАМИЧЕСКИМ равновесием (равновесием в движении). В связи с этим можно дополнить определение насыщенного раствора:
Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворенного вещества.
Следовательно, никакое самое сильное перемешивание не помогает растворить в насыщенном растворе дополнительные порции вещества. Однако, если повысить температуру, то раствор вновь может стать ненасыщенным и растворить еще определенную порцию кристаллов.
Мы говорим: «сахар растворяется в воде хорошо» или «мел плохо растворяется в воде». Но можно и количественно оценить способность того или иного вещества к растворению или, другими словами, растворимость вещества.
РАСТВОРИМОСТЬЮ называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе.
Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым . Если растворяется менее 1 г вещества – вещество малорастворимо . Наконец, вещество считают практически нерастворимым , если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает. Даже когда мы наливаем воду в стеклянный сосуд, очень небольшая часть молекул стекла неизбежно переходит в раствор.
Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости .
В целом растворимость разных веществ определяется многими сложными причинами, некоторые из которых до сих пор не ясны. Поэтому трудно предсказать растворимость какого-либо вещества по его химической формуле или агрегатному состоянию.
В качестве примера приведем растворимость (в граммах вещества на 100 г воды при комнатной температуре) нескольких веществ: твердых, жидких и газообразных, среди которых многие имеют похожие химические формулы (таблица 7-2).
Таблица 7-2. Растворимость некоторых веществ в воде при комнатной температуре.
Источник
Пересыщенные растворы сахарозы
В зависимости от концентрации сахарозы (при постоянной температуре) растворы могут быть ненасыщенными, насыщенными и пересыщенными. Они представляют собой однофазное вещество, отличающееся по концентрации и структуре. В ненасыщенном растворе молекулы сахарозы наиболее полно гидратированы и удалены друг от друга. В пересыщенном степень гидратации снижается, молекулы сахарозы более тесно расположены друг к другу, поэтому под действием сил межмолекулярного взаимодействия возможно образование ассоциатов из многих молекул.
Если в ненасыщенный раствор добавлять кристаллы сахарозы, то они будут растворяться. В насыщенном растворе между твердой и жидкой фазами устанавливается динамическое равновесие. В таком растворе процессы растворения и кристаллизации протекают с одинаковыми скоростями, поэтому количество растворенного вещества остается при данной температуре постоянным.
Раствор, содержащий растворенного вещества больше, чем в насыщенном, называется пересыщенным. Последний можно получить несколькими способами. Наиболее часто используют выпаривание при постоянной температуре растворителя или охлаждение насыщенного раствора. Так как при понижении температуры растворимость многих веществ, в том числе и сахарозы, снижается, то раствор из ненасыщенного переходит в пересыщенное состояние. И наконец, в насыщенный раствор можно добавить вещество, снижающее растворимость сахарозы, например, спирт, который связывает молекулы воды, вытесняя при этом молекулы сахарозы из раствора.
Степень пересыщения измеряется коэффициентом пересыщения, под которым понимается число, показывающее, во сколько раз в данном растворе на единицу массы’воды приходится растворенного вещества больше, чем в насыщенном при той же температуре:
где а — коэффициент пересыщения; Н — количество растворенного вещества на единицу массы воды в исследуемом растворе; Hj — количество растворенного вещества на единицу массы воды в насыщенном растворе при той же температуре.
Для пересыщенных растворов, очевидно, будем иметь а> 1, для насыщенных — а= 1, для ненасыщенных — а гк будут только расти, т. е. становятся центрами кристаллизации. Зародышам радиусом гк соответствует изменение избыточной энергии системы ДЕк, эквивалентное работе ДФк изотермического образования центра новой фазы, которая по Гиббсу выражается уравнением
зародышей новой фазы
ДФк = 1 / 3 о F. (IV-15)
Находясь в равновесии с жидкой фазой, кристаллический зародыш при данном его объеме V2 должен обладать минимальной свободной поверхностной энергией. Это условие определяет кристаллическую форму зародыша. Если допустить, что форма зародыша сферическая, для п получим выражение
n = 4jtr3/3V2. (IV-16)
Подставляя значения п и F в уравнение (IV-14), получим
ДЕ = 4 л г3 / 3V2 (р., — ц2) + 4лг2 о. (IV-17)
Приравнивая производную от ДЕ по г к нулю и определяя гк для центра кристаллизации в пересыщенном растворе, получим
где V, = M / p; M — масса, p — плотность кристаллического зародыша. Подставляя значение г. из формулы (IV-18) в уравнение (IV-15), получим для образования центра новой фазы выражение
ДФК = 16яо3М2 /3p2R2T2 ln(C/.CH)2 (IV-19)
Из уравнений (IV-18) и (IV-19) видно, что с увеличением пересыщения и температуры раствора гк и ДФк уменьшаются, что облегчает образование центров кристаллизации. Чем выше коэффициент пересыщения, тем меньшие по величине зародыши становятся центрами новой фазы.
Согласно теории флуктуаций, развитой Эйнштейном, вероятность образования зародышей новой фазы W зависит от величины работы по уравнению
W = |/ ехр(-ДФ / RT), (IV-20)
где |/ — предэкспоненциальный множитель.
Если допустить, что скорость образования центров кристаллизации пропорциональна вероятности их возникновения, то
I = лг ехр(-ДФк / RT). (IV-21)
После подстановки значения ДФк из уравнения (IV-19) получим
I = Ч» ехр(-16тш3М2 /3p2R3T3 1п(С /,СН )2 (IV-22)
Пересьпценные растворы обладают определенной вязкостью, что замедляет обмен молекулами растворенного вещества на поверхности зародышей и, следовательно, уменьшает скорость образования центров кристаллизации. По Я. И. Френкелю, вероятность перехода молекул в кристаллический зародыш пропорциональна выражению exp(-AU/RT), в котором AU — некоторая энергия активации, являющаяся функцией вязкости раствора по уравнению
тр А ели, кт. (IV-23)
Тогда коэффициенту в уравнении (IV-20)
\г = у, exp(-AU/RT), а уравнение для скорости образования центров кристаллизации примет
Образование зародышей новой фазы протекает по времени и является нестационарным процессом. Под действием тепловых флуктуаций в каждый момент времени распределение зародышей изменяется по размерам. Поэтому не все зародыши, достигшие величины пк-1, станут центрами кри — сталлизации. Часть из них, потеряв по одной или две молекулы, перейдут в более низкий класс пк-2, пк-3 и т. д. Поэтому фактическая скорость образования центров новой фазы будет меньше, чем вычисленная по уравнению (IV-24). Для учета нестационарного режима возникновения центров новой фазы коэффициент \г, в уравнении (IV-24), по Я. Б. Зельдовичу, примет вид
V, = |Д, ехр(-тр/т), (IV-25)
где тр — время релаксации, т. е. время, в течение которого скорость процесса уменьшается в е раз.
окончательно для скорости образования центров кристаллизации запишем
VT • е-Вп’,/т’,|п(с/сн)2 _ (IV-26)
Образовавшиеся центры кристаллизации продолжают расти за счет присоединения к решетке новых молекул. Этот процесс протекает самопроизвольно, так как сопровождается уменьшением избыточной свободной энергии системы (см. рис. IV-3). Скорость присоединения молекул пропорциональна энергии их осаждения. Присоединение в первую очередь произойдет там, где при осаждении молекулы выделится максимум энергии. Поэтому при росте кристалла прежде всего должно быть закончено построение уже имеющегося нарастающего слоя до ребра, ограничивающего данную грань. Затем возникает и до конца достраивается ближайший параллельный монослой. Скорость роста кристаллов выражается скоростью линейного перемещения грани в направлении, перпендикулярном поверхности растущей грани, или приростом массы кристаллов на единицу поверхности за единицу времени.
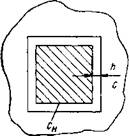
Рис. IV-4. Схема кристалла сахарозы Рис. IV-5. Зависимость скорости роста в пересыщенном растворе при его росте кристалла от частоты перемешивания его
в пересыщенном растворе
Сложная зависимость скорости роста кристаллов от различных факторов привела к разработке большого числа теорий роста: диффузионной, физико-химической, кинетической и флуктуационной. Рассмотрим наиболее простую, диффузионную теорию, разработанную А. Нойесом, Ф. Уитни и И. И. Андреевым.
Согласно этой теории растущий кристалл окружен неподвижным слоем прилипшего к нему раствора толщиной h (рис. IV-4). Непосредственно у самой грани кристалла концентрация раствора равна концентрации насыщения С. На расстоянии h от граней кристалла раствор пересыщен, его концентрация С. Вследствие разности концентраций (С-Сн) молекулы сахара диффундируют через неподвижный слой раствора h и, достигнув граней кристалла, выкристаллизовываются на них.
Таким образом, у граней кристалла концентрация раствора не изменяется и остается равной Сп. Следовательно, скорость кристаллизации определяется скоростью диффузии молекул сахара и подчиняется уравнению Фика, решение которого в данном случае имеет вид
G = D (С-Сн) F т / h, (IV-27)
где G — количество продиффундировавшего сахара; D — коэффициент диффузии.
Скоростью кристаллизации v называется количество вещества, которое выкристаллизовывалось на 1 м2 поверхности F кристаллов за 1 мин. Подставляя значения F и т в уравнение (IV-27), получим
v = D (С-С,) / h. (IV-28)
Коэффициент диффузии, по Эйнштейну, зависит от термодинамической температуры Т и вязкости среды Г):
где к,- постоянная величина.
Подставляя значение D из уравнения (IV-29) в формулу (IV-28), получим
Уравнение (IV-30) дает возможность установить влияние ряда факторов на скорость роста кристаллов.
Однако диффузионная теория не смогла полностью объяснить сложного процесса роста кристаллов. Было установлено, что при интенсивном перемешивании растущих кристаллов в пересыщенном растворе скорость кристаллизации резко увеличивается, достигает некоторого максимального значения и при дальнейшем повышении частоты перемешивания остается постоянной. Величина максимальной скорости кристаллизации при зтих условиях пропорциональна не (С-См), а (С-Си)2 (рис. IV-5). Очевидно, при энергичном перемешивании неподвижная пленка раствора вокруг кристалла утончается (h
0), и явлением диффузии здесь можно пренебречь.
Видимо, процесс кристаллизации в действительности протекает в две стадии: первая — диффузия молекул сахара из окружающей среды к граням кристалла через неподвижный слой раствора толщиной h; вторая — переход молекул сахара, достигших граней кристалла, из растворенного в кристаллическое состояние.
Чтобы вызвать переход вещества из одного агрегатного состояния в другое, требуется некоторая движущая сила. Такой движущей силой может быть разность концентраций. Поэтому необходимо допустить, что у самих граней кристалла раствор должен быть несколько пересыщен и иметь концентрацию С <. Тогда скорость перехода молекул сахара будет пропорциональна (Cj-CJ2.
Следовательно, скорость первой стадии кристаллизации (диффузия молекул через неподвижный слой раствора) может быть выражена уже известным уравнением
а скорость перехода вещества из жидкого состояния в твердое
где а — постоянный коэффициент.
Для установившегося процесса роста кристаллов эти скорости должны быть равны, т. е. v: = v2 = v. Если из двух последних уравнений исключить неизвестную нам концентрацию С,, а (С-С ) обозначить через ДС, то получим
v = D/h[AC + D/2a — -/D/ah(AC + D/4ah)]. (IV-33)
В сильно вязких растворах коэффициент D — очень малая величина, поэтому D/a—>0. Подставляя D/a=0 в уравнение (IV-33), получим
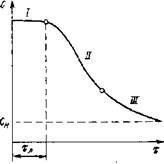
При получении помадных масс в пересыщенном сахаро-паточном сиропе протекает во времени суммарный процесс кристаллизации — образование центров новой фазы и их рост до видимых кристаллов. Поэтому концентрация сахарозы С в сиропе постепенно уменьшается и к концу процесса приближается к равновесной при данной температуре концентрации Сп. Кинетика такого процесса выражается S-образной кривой, типичной для других автокаталитических процессов.
Рнс. IV-6. Изменение концентрации раствора во времени
Кривая С(т) имеет три участка (рис. IV-6), на которых характер зависимости С от т резко отличен. Первый участок представляет собой линию, параллельную оси абсцисс. Некоторое время концентрация пересыщенного раствора (при а
ТЕХНОЛОГИЯ КОНДИТЕРСКОГО ПРОИЗВОДСТВА
ОТДЕЛКА, РАСФАСОВКА И УПАКОВКА МУЧНЫХ КОНДИТЕРСКИХ ИЗДЕЛИЙ
Значительная часть мучных кондитерских изделий после охлаждения и выстойки подвергается внешней отделке кремами, цукатами, начинками, сиропами и т. п. Поверхность некоторых изделий покрывают шоколадной глазурью. При отделке преследуют цель не …
ПРОИЗВОДСТВО ВАФЕЛЬ
Приготовление начинок для вафель Вафли — это кондитерские изделия, состоящие из трех (или более) вафельных листов, прослоенных начинкой. Для прослойки используются жировые, фруктово-ягодные, пралиновые, помадные и другие начинки. Вкусовые достоинства …
ВЫПЕЧКА И ОХЛАЖДЕНИЕ ИЗДЕЛИЙ
Выпечка изделий Выпечка мучных кондитерских изделий является сложным и ответственным этапом технологического процесса. При выпечке тестовых заготовок происходят физико-химические и коллоидные изменения в тесте, предопределяющие качество готовых изделий. Поэтому для …
Продажа шагающий экскаватор 20/90
Цена договорная
Используются в горнодобывающей промышленности при добыче полезных ископаемых (уголь, сланцы, руды черных и
цветных металлов, золото, сырье для химической промышленности, огнеупоров и др.) открытым способом. Их назначение – вскрышные работы с укладкой породы в выработанное пространство или на борт карьера. Экскаваторы способны
перемещать горную массу на большие расстояния. При разработке пород повышенной прочности требуется частичное или
сплошное рыхление взрыванием.
Вместимость ковша, м3 20
Длина стрелы, м 90
Угол наклона стрелы, град 32
Концевая нагрузка (max.) тс 63
Продолжительность рабочего цикла (грунт первой категории), с 60
Высота выгрузки, м 38,5
Глубина копания, м 42,5
Радиус выгрузки, м 83
Просвет под задней частью платформы, м 1,61
Диаметр опорной базы, м 14,5
Удельное давление на грунт при работе и передвижении, МПа 0,105/0,24
Размеры башмака (длина и ширина), м 13 х 2,5
Рабочая масса, т 1690
Мощность механизма подъема, кВт 2х1120
Мощность механизма поворота, кВт 4х250
Мощность механизма тяги, кВт 2х1120
Мощность механизма хода, кВт 2х400
Мощность сетевого двигателя, кВ 2х1600
Напряжение питающей сети, кВ 6
Более детальную информацию можете получить по телефону (063)0416788
Источник