PRP-терапия как альтернативный метод в практике трихолога
Записано по материалам выступления Паховомой Е.В. на XIII заседании Общества трихологов.
На сегодняшний день PRP-терапия у всех на слуху. Много вопросов задают пациенты, которые находят информацию в интернете. Интересуются и коллеги, спрашивают: что это за метод? Какие у него возможности? Стоит ли этим заниматься в трихологии?
Мы постараемся обобщить имеющуюся информацию о PRP – терапии, еще раз конкретизировать сам термин «PRP – терапия», почему ее так назвали, какие ее возможности используются в медицине, и каким образом мы можем использовать это в нашей, трихологической, практике.
На сегодняшний день вопросы исследования и использования аутологичных продуктов являются актуальными, поскольку это дает возможность контролировать процесс регенерации ткани. До некоторых пор, эти исследования носили больше эпизодический, локальный характер. Они не были широко представлены в клинической практике.
История
PRP – терапия — это один из аутологичных продуктов, применяется в лечении ряда заболеваний. Первыми начали применять в своей практике обогащённую плазму врачи-хирурги. Затем исследования и опыт применения появился и у челюстно-лицевых хирургов. Проводились и ортопедические работы с использованием этого метода. Далее, данную методику стали применять при реабилитации спортсменов в случаях получения травм.
PRP — терапия приобрела популярность в этом направлении, поскольку благодаря этой схеме лечения регенерация травмированных мышц, связок и сухожилий проходила гораздо успешнее. Последние несколько лет PRP — терапия стала интересовать и врачей других специализаций, в частности косметологов.
PRP (platelet-rich plasma) – плазма, обогащенная тромбоцитами. В цельной крови среднее количество тромбоцитарных клеток – 150 000-300 000 на микролитр плазмы. Так, в богатой плазме количество тромбоцитарных клеток может быть более 1 000 000 на 1 микролитр плазмы.
Почему именно тромбоциты?
В тромбоцитах содержатся факторы роста. Основные клетки – мишени этих факторов – это клетки кровеносных сосудов, фибробласты и стволовые мезенхимальные клетки. Основные функции, которые они выполняют – это дифференцировка, клеточный рост, синтез и т.д. Смотрим на таблицу.
| fpm_start( "true" ); | » style=»border: 1px dashed rgb(172, 172, 172);»> | |
| » style=»border: 1px dashed rgb(172, 172, 172);»> Клетки кровеносных сосудов, внешние клетки кожи, фибробласты и многие другие типы клеток | » style=»border: 1px dashed rgb(172, 172, 172);»> | » style=»border: 1px dashed rgb(172, 172, 172);»> Сильный клеточный рост, рекруитмент, рост кровеносных сосудов, грануляция, секреция факторов роста, формирование матрикса коллагена и кости с участием костных морфогенетических белков (BMP) |
| » style=»border: 1px dashed rgb(172, 172, 172);»> Ткань кровеносных сосудов, внешние клетки кожи, фибробласты, моноциты, класс TGF, включая BMP, остеобласты — высший уровень TGF-βr | » style=»border: 1px dashed rgb(172, 172, 172);»> | » style=»border: 1px dashed rgb(172, 172, 172);»> Клеточный рост, дифференциация, рекруитмент, синтез коллагена с участием PDGF |
| » style=»border: 1px dashed rgb(172, 172, 172);»> Клетки кровеносных сосудов | » style=»border: 1px dashed rgb(172, 172, 172);»> | » style=»border: 1px dashed rgb(172, 172, 172);»> Клеточный рост, клеточная миграция, рост кровеносных сосудов |
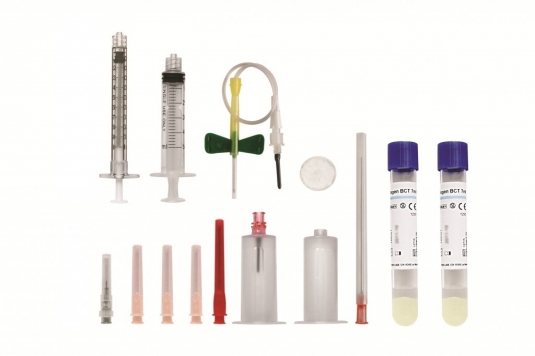
 Антикоагулянты, используемые при получении PRPГепарин, EDTA – необратимо ингибируют способность тромбоцитов к агрегации. Цитрат натрия, ACD-А — в отличие от антикоагулянтов, указанных выше, ингибируют агрегацию тромбоцитов обратимо, при этом не повреждается клеточная мембрана. Количество тромбоцитов в PRPСитуация рассмотрена на примере одного из пациентов. Изначальное количество тромбоцитов было не большое – 190 000 на 1 микролитр плазмы. После первого центрифугирования с использованием пробирки и разделительного геля, в верхней части пробирки осталось количество тромбоцитов в 2-2,5 раза превышающее изначальное значение. Если мы не используем разделительный гель, в нижнем слое плазмы тромбоцитов в 7,9 раз больше. Выяснилось и то, что в PPP тоже остается какая-то часть тромбоцитов. В верхней части эритроцитарного слоя содержится, так называемый, лейкоцитарный слой, потому что лейкоциты тоже легче эритроцитов. Выяснили, что этот лейкоцитарный слой также содержит какое-то количество тромбоцитов. И разработчики метода задумались: — Если мы хотим получить концентрированную PRP, то зачем нам терять это драгоценное количество клеток. Оказалось, что если сбросить основную эритроцитарную массу, и, оставив небольшое количество эритроцитов с лейкоцитами и тромбоцитами, прокрутить на центрифуге второй раз, то количество тромбоцитов в плазме увеличивается еще больше. — Что будет, если активировать процесс свертывания в плазме? Это увеличит концентрацию факторов роста и цитокинов в PRP? Для решения этой проблемы были проведены эксперименты с добавлением ионов кальция или аутологичного тромбина (разные методики предполагают разные способы активации плазмы). Было решено подсчитать количество факторов роста в плазме в случае активации процессов свертывания. Обнаружено, что уровень некоторых факторов роста увеличивается почти в 140 раз. Также были попытки активировать и бедную плазму, потому что и там есть часть тромбоцитов. Выяснилось, что при активации бедной плазмы, количество факторов роста в плазме также увеличивается в несколько раз. Как факторы роста влияют на пролиферацию клеток?В эксперименте in vitro стволовые клетки и фибробласты кожи человека были обработаны факторами роста из обогащённой плазмы. Полученные данные показали, что пролиферация стволовых клеток и фибробластов заметно усилилась в присутствии активной PRP. Выводы1. При центрифугировании количество тромбоцитов гораздо больше, чем в цельной крови. Насколько больше – зависит от методики, которая применяется при изготовлении плазмы. 2. Активация плазмы приводит к увеличению количественного содержания в ней факторов роста. 3. Добавление факторов роста из PRP in vitro усилили пролиферацию стволовых клеток и фибробластов. Применение PRPВ последнее время в медицине, кроме хирургического направления, PRP стали использовать в: офтальмологии, стоматологии и ветеринарии. Кроме того, появилось такое направление, как лечение боли высокими концентрациями PRP. Метод PRP стали использовать и в эстетической медицине. Мировые производители наборов для приготовления PRP: Мы кратко представим страны – производителей одноразовых наборов (китов) для приготовления активной плазмы. — Южная Корея – 4 компании предлагают наборы для PRP — США — изготавливают отдельные наборы для лечения людей и специальные наборы для ветеринарии Однако на российском рынке выбор меньше. В России зарегистрированы следующие компании-производители : Суть метода в том, что кроме одноразовых стерильных пробирок предлагается разделительный гель. В качестве антикоагулянта используется гепарин. Предполагается однократное центрифугирование. Чтобы получить хорошую концентрацию тромбоцитов, нам необходимо взять 3-4 пробирки крови у пациента. Долгое время «Плазмолифтинг» был монополистом в этой области. На российском рынке появился швейцарский изготовитель REGEN LAB (зарегистрирован на территории России в 2011 году). Также предлагаются наборы – киты, в которых используются одноразовые пробирки с разделительным гелем. Применяется однократное центрифугирование, но так как в качестве антикоагулянта используется цитрат, теоретически мы можем активировать плазму. И такое активирование в методе предполагается. Компания предлагает методику активирования аутологичным тромбином, однако, эта методика пока используется только в эстетической медицине — для омоложения кожи. В трихологии это пока не применяется. Еще один бренд представляет подобные наборы – это финский бренд Glo Fin и они представляют «GLO PRP» У китов этого производителя есть ряд отличительных особенностей, которые очень важны. Они не используют пробирки с разделительным гелем. В набор входит стерильный шприц, в который происходит забор крови и туда же добавляется антикоагулянт — цитрат натрия. Поршень у шприца выкручивается, и шприц превращается в пробирку. В этом же шприце происходит прокручивание на центрифуге. На шприц надевается насадка, и основная эритроцитарная масса сбрасывается в этот контейнер, который отсоединяется и сбрасывается в емкость с дезрастровом. В шприце остается плазма и лейкоцитарный слой, который, как мы помним, содержит дополнительное количество тромбоцитов. Дальше надевается еще одна герметичная насадка. Проходит стадия второго центрифугирования, в процессе которого эритроциты окончательно оседают внизу. Набор не предполагает использование игл. Сброс или забор активной плазмы происходит с помощью специальной соединительной шприцевой муфты, подсоединенной непосредственно к шприцу, из которого уже делается инъекция пациенту. С помощью такого набора мы можем отобрать нижний слой и получить очень высокую концентрацию факторов роста в PRP. Это важно для эстетической медицины, для лечения боли, так как концентрация тромбоцитов при этом в 8 раз выше. Мы можем отобрать второй миллилитр крови, зная, что там будет концентрация в 4-5 раз больше. Мы можем взять бедную плазму, тоже ее активировать и получить дополнительный материал для пациента. PRP в трихологииЧто же мы вправе ожидать от PRP — терапии в лечении алопеции? Наши итальянские коллеги применяли PRP у пациентов с диагнозом АГА, с разными степенями по Гамильтону — Норвуду. В своем институте они занимались аутотрансплантацией волос и пару лет назад заинтересовались PRP – терапией. У них под наблюдением было более 80 пациентов, которым была проведена эта процедура и около 60 из них имели динамическое наблюдение в течение 2х лет, которое показало, что в большинстве случаев не наблюдается регресса (как при использовании миноксидила) . Американцы показывали опыт лечения пациентов PRP с диагнозом гнездная алопеция. Опыты они получили положительные. После PRP-терапии происходило зарастание очагов облысения в течение года. Также был использован метод сочетания пересадки и PRP. Так как передняя краевая линия роста волос лобной части очень плохо поддается наружной терапии, предлагается делать аутотрансплантацию волос именно сюда, а на теменную область, где есть поредение волос делать PRP-терапию. Эффективность метода удовлетворяет и врача, и пациента. При таком методе пациент значительно экономит свои финансы. Однако, 25% пациентов после применения PRP не увидели результата «в зеркале», (для оценки эффективности использовалась только макросъемка). Оставшиеся 75% пациентов имели клинически видимый положительный результат. На мой взгляд, если бы они делали трихоскопию и трихограмму, а не только макросъемку, возможно, у этих 25 % пациентов обнаружились бы какие-то изменения, которые не видны «в зеркале». Источник Плазма богатая тромбоцитами (PRP)Curr Rev Musculoskelet Med DOI Журнал Humana Press 2008 В Европе и Соединенных Штатах растет распространенность использования аутологичных продуктов крови в целях ускорения исцеление при различных травмах и повреждениях. Недавно стало известно больше о конкретных факторах роста, которые играют решающую роль в процессе исцеления. С приобретением этих знаний, проявляется энтузиазм в применении концентрированных тромбоцитов, которые выпускают феноменальный объем фактора роста, чтобы стимулировать восстановление незаживающих травм. За 20 лет применения аутологичной PRP, методика была безопасной и применение было задокументировано во многих областях, в том числе, ортопедии, спортивной медицине, стоматологии, оториноларингологии, нейрохирургии, офтальмологии, урологии, как ранозаживляющее средство, косметическое, кардиоторакальной и челюстно-лицевой хирургии. Эта статья знакомит читателя с PRP-терапией и обзорами текущей литературы по этой новой методики лечения. Как результат, PRP является перспективной альтернативой хирургии по продвижению безопасного и естественного исцеления. Однако, есть несколько контролируемых исследований и, в основном, эпизодические или отчеты о частных случаях. Кроме того, размеры выборки, часто небольшие и ограничивают обобщение результатов. В последнее время появляются издания, рассказывающие о благотворном влиянии PRP при хронических незаживающих повреждениях сухожилий, в том числе боковой эпикондилит и подошвенный фасциит и дегенерация хряща (Мишра и Павелко, Американский Жернал Спортивной Медицины 10 (10):1-5, 2006; Барретт и Эрредж, Лечение Заболеваний Стоп Сегодня 17:37-42, 2004). Однако, по мере увеличения клинического применения, увеличивается количество контролируемых исследований, необходимых для дальнейшего развития и понимания этой методики. В Европе, а в последнее время и в Соединенных Штатах, положительный тренд создает спрос на использование аутологичных продуктов крови в стремлении облегчить исцеление при различных травмах и заболеваниях. В последние годы научные исследования и технологии предоставили новый взгляд на понимание процесса заживления ран. Изначально существовала версия, что тромбоциты необходимо исключительно для инициации процесса свертывания крови. Однако, мы выяснили, что тромбоциты выделяют множество биологически активных белков, ответственных за привлечение макрофагов, мезенхимальных стволовых клеток и остеобластов, которые не только способствует удалению некротических тканей, а также усиливают регенерацию и заживление тканей. Травмы мягких тканей, сухожилий и связок составляют 45% всех травм опорно-двигательного аппарата в США [4, 5]. Неизменная популярность спортивных мероприятий привела к «эпидемии» заболеваний опорно-двигательного аппарата, акцентировав внимание на сухожилия. Кроме того, современные методы визуализации, в том числе магнитно-резонансная томография и УЗИ опорно-двигательного аппарата предоставили медикам знания для последующего изучения этих травм. Кровь состоит из плазмы, красных кровяных телец (эритроцитов), белых кровяных телец (лейкоцитов) и тромбоцитов. Плазма — это жидкая составляющая крови, состоящая в основном из воды и выступающая в качестве транспортера для клеток. Плазма также содержит фибриноген — белок, который действует как сеть и «ловит» тромбоциты на пораженном месте в виде сгустка. Красные кровяные тельца помогают забрать кислород из легких и доставить его в другие клетки организма, в то же время удаляя углекислый газ. Лейкоциты (белые кровяные тельца) борются с инфекцией, фагоцитируют микроорганизмы. Тромбоциты отвечают за гемостаз, строительство новой соединительной ткани, и реваскуляризацию. Как правило, кровь содержит 93% эритроцитов, 6% тромбоцитов, и 1% лейкоцитов [6]. Преимущество PRP состоит в изменении процентного соотношения компонентов в крови — снижении эритроцитов до 5%, которые менее полезны в процессе заживления и регенерации, и повышении тромбоцитов до 94%, чтобы стимулировать восстановление [6]. Тромбоциты — это небольшие дисковидные клетки крови, создаваемые костным мозгом, с периодом жизни в 7-10 дней. Внутри тромбоцитов много внутриклеточных структур, содержащих гликоген, лизосомы и два типа гранул. Альфа-гранулы содержат факторы свертывания крови и факторы роста, которые, в конечном счете, и необходимы для запуска лечебного процесса. Как правило, в состоянии покоя, тромбоцитам требуется раздражитель для включения в процесс заживления раны и гемостаза [7]. После активации тромбина, тромбоциты принимают различные формы и развивают ответвления, называемые псевдоподии, которые распространяются через поврежденную ткань. Этот процесс называется агрегацией, то есть объединение отдельных тромбоцитов в единую систему. В конечном итоге, гранулы, содержащиеся в тромбоцитах, выпускают факторы роста, которые стимулируют воспалительный процесс и исцеление [7]. PRP (Platelet Rich Plasma) определяется как объем фракции плазмы аутологичной крови, обладающий концентрацией тромбоцитов выше базовых показателей [8, 9]. Нормальная концентрация тромбоцитов составляет 200 000 тромбоцитов/мл. Исследования показали, что клиническую эффективность можно ожидать с минимальным увеличением базового показателя в 4 раза (1 млн тромбоцитов/мл) [6]. В последнее время появилась возможность значительного изменения концентрации тромбоцитов, что напрямую зависит от используемого оборудования. Использование аутологичной PRP впервые было зафиксировано в 1987 году доктором Феррари М[10] после операции на открытом сердце, когда было необходимо избежать переливания больших объемов крови. С этого времени применение аутологичной PRP было использовано и задокументировано во многих областях, в том числе в ортопедии, спортивной медицине, стоматологии, ЛОР, нейрохирургии, офтальмологии, урологии и при заживлении ран, а также в косметологии, кардиоторакальной и челюстно-лицевой хирургии. Исследования показывают, что PRP может положительно повлиять на уменьшение воспалительного процесса, восстановление послеоперационной потери крови, подавление инфекции и на заживление мягких тканей. Ссылки на источники Mishra A, Pavelko T. Treatment of chronic elbow tendinosis with buffered platelet-rich plasma. Am J Sports Med. 2006;10(10):1–5. Barrett S, Erredge S. Growth factors for chronic plantar fascitis. Podiatry Today. 2004;17:37–42. Woolf AD, Pfleyer B. Burdon of major musculoskeletal conditions. Bull World Health Organ. 2003;81:646–56. Anitua M, Sa´nchez E, Nurden A, Nurden P, Orive G, And´ıa I. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 2006;24(5):227–34. Praemer AF. Musculoskeletal conditions in the United States. 2nd ed.Rosemont:AmericanAcademyofOrthopaedicSurgeons;1999. Marx R, Garg A. Dental and craniofacial applications of platelet-rich plasma. Carol Stream: Quintessence Publishing Co, Inc.; 2005. Everts P, Knape J, Weirich G, Schonberger J, Hoffman J, Overdevest E, et al. Platelet-rich plasma and platelet gel: a review. JECT. 2006;38:174–87. Pietrzak W, Eppley B. Scientific foundations platelet rich plasma: biology and new technology. J Craniofac Surg. 2005;16(6):1043– 54. Marx RE. Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant Dent. 2001;10:225–8. Ferrari M, Zia S, Valbonesi M. A new technique for hemodilu-tion, preparation of autologous platelet-rich plasma and intraoperative blood salvage in cardiac surgery. Int J Artif Organs. 1987;10:47–50. Antitua E, Andia I, Sanchez M, Azofra J, Del Mar Zalduendo M, De La Fuente M, et al. Autologous preparations rich in growth factors promote proliferation and induce VEGF and HGF productions by human tendon cells in culture. J Orthop Res. 2005;23:281–6. Fenwick SA, Hazlelman BL, Riley GP. The vasulature and its role in the damaged and healing tendon. Arthritis Res. 2002;4: 252–60. Hayem G. Tenology: a new frontier. Joint, Bone, Spine. Rev Rhum. 2001;68:19–25. Jobe F, Ciccotti M. Lateral and medial epicondylitis of the elbow. J Am Acad Orthop Surg. 1994;2:1–8. Edwards SG, Calandruccio JH. Autologous blood injections for refractory lateral epicondylitis. Am J Hand Surg. 2003;28(2): 272–8. Antiua E, Sanchez M, Nurden A, Zalduendo M, De La Fuente M, Prive G, et al. Autologous fibrin matrices: a potential source of biological mediators that modulate tendon cell activities. J Bio-med Mater Res Pt A. 2006;77(2):285–93. Kader D, Sakena A, Movin T, Magulli N. Achilles tendinopathy: some aspects of basic science and clinical management. Br J Sports Med. 2002;36:239–49. Smidt N, Assendelft W, Arola H, et al. Effectiveness of physiotherapy for lateral epicondylitis: a systemic review. Ann Med. 2003;35:51–62. Werner S, Grose R. Regulation of wound healing by growth factors and cytokines. Physiol Rev. 2003;83:835–70. Kirker-Head CA. Potential applications and delivery strategies for bone morphogenetic proteins. Adv Drug Deliv Rev. 2000;43:65–92. Froum SJ, Wallace S, Tarnow DP, Cho SC. Effect of platelet-rich plasma on bone growth and osseointegration in human maxillary sinus grafts: three bilateral case reports. Int J Periodontics Restorative Dent. 2002;22:45–53. Raghoebar GM, Schortinghuis J, Liem R, Ruben J, Van der Wal J, Vissink A. Does platelet-rich plasma promote remodeling of autologous bone grafts used for the augmentation of the maxillary sinus floor? Clin Oral Implants Res. 2005;16:349–56. Molloy T, Wang Y, Murrell G. The roles of growth factors in tendon and ligament healing. Sports Med. 2003;33(5):381–94. Ranly D, Lohmann C, Andreacchio D, Boyan B, Schwartz Z. Platelet-rich plasma inhibits demineralized bone matrix-induced bone formation in nude mice. J Bone Joint Surg. 2007;89: 139–46. Eppley B, Woodell J, Higgins J. Platelet Quantification and growth factor analysis from platelet-rich plasma: Implications for wound healing. Plast Reconstr Surg. 2004;114(6):1502–7. Zehnder JL, Leung LLK. Development of antibodies to thrombin and factor V with recurrent bleeding in a patient exposed to topical bovine thrombim. Blood. 1990;76:2011–6. Kajikawa Y, Morihara T, Sakamoto H, Matsuda K, Oshima Y, Yoshida A, et al. Platelet-rich plasma enhances the initial mobilization of circulation-derived cells for tendon healing. J Cell Physiol. 2008;215(3):837–45. Taylor M, Norman T, Clovis N, Blaha D. The response of rabbit patellar tendons after autologous blood injection. Med Sci Sports Exerc. 2002;34(1):70–3. Berghoff W, Pietrzak W, Rhodes R. Platelet-rich plasma application during closure following total knee arthroplasty. Orthopedics. 2006;29(7):590–8. Gardner MJ, Demetrakopoulos D, Klepchick P, Mooar P. The efficacy of autologous platelet gel in pain control and blood loss in total knee arthroplasty: an analysis of the haemoglobin, narcotic requirement and range of motion. Int Orthop. 2006;31:309–13. Everts P, Devilee R, Mahoney C, Eeftinck-Schattenenkerk M, Knape J, Van Zundert A. Platelet gel and fibrin sealant reduce allogeneic blood transfusions in total knee arthroplasty. Acta Anaesthesiol Scand. 2006;50:593–9. Crovetti G, Martinelli G, Issi M, Barone M, Guizzardi M, Campanati B, et al. Platelet gel for healing cutaneous chronic wounds. Transfus Apher Sci. 2004;30:145–51. McAleer JP, Kaplan E, Persich G. Efficacy of concentrated autologous platelet-derived growth factors in chronic lower-extremity wounds. J Am Podiatr Med Assoc. 2006;96(6):482–8. Ghandi A, Dumas C, O’Connor J, Parsons J, Lin S. The effects of local platelet rich plasma delivery on diabetic bone fracture healing. Bone. 2006;38:540–6. Beam HA, Parsons JR, Lin SS. The effects of blood glucose control upon fracture healing in the BB Wistar rat with diabetes mellitus. J Orthop Res. 2002;20:1210–6. Hee HT, Majd ME, Holt RT, Myers L. Do autologous growth factors enhance transforaminal lumbar interbody fusion? Eur Spine J. 2003;12(12):400–7. Carreon LY, Glassman SD, Anekstein Y, Puno RM. Platelet gel (AGF) fails to increase fusion rates in instrumented posterolateral fusions. Spine. 2005;30(9):E243–6. discussion E247. Jenis LG, Banco RJ, Kwon B. A prospective study of Autologous Growth Factors (AGF) in lumbar interbody fusion. Spine J. 2006;6(1):14–20. Castro FP Jr. Role of activated growth factors in lumbar spinal fusions. J Spinal Disord Tech. 2004;17(5):380–4. Weiner BK, Walker M. Efficacy of autologous growth factors in autologous intertransverse fusions. Spine. 2003;28:1968–70. Lowery GL, Kulkarni S, Pennisi AE. Use of autologous growth factors in lumbar spine fusion. Bone. 1999;25:47S–50S. Chen W, Lo WC, Lee JJ, Su CH, Lin CT, Liu HY, et al. Tissue-engineered intervertebral disc and chondrogenesis using human nucleus pulposus regulated through TGF-beta1 in platelet-rich plasma. J Cell Physiol. 2006;209(3):744–54. Hunziker EB, Driesang IM, Morris EA. Clinical orthopaedics and related research. Chondrogenesis in cartilage repair is induced by members of the transforming growth factor-beta superfamily. Clin Orthop Relat Res. 2001;391(Suppl):S171–81. Nakagawa K, Sasho T, Arai M, Kitahara S, Ogino S, Wada Y, et al. Effects of autologous platelet-rich plasma on the metabolism of human articular chondrocytes. Chiba and Ichihara, Japan. Electronic poster presentation P181. International Cartilage Repair Society Meeting, Warsaw Poland, October 2007. Kon E, Filardo G, Presti ML, Delcogliano M, Iacono F, Mon-taperto C, et al. Utilization of platelet-derived growth factors for the treatment of cartilage degenerative pathology. Bologna, Italy. Electronic poster presentation 29.3. International Cartilage Repair Society Meeting, Warsaw Poland, October 2007. Anitua E, Sa´nchez M, Nurden AT, Zalduendo MM, De La Fuente M, Azofra J, et al. Platelet-released growth factors enhance the secretion of hyaluronic acid and induce hepatocyte growth factor production by synovial fibroblasts from arthritic patients. Rheumatology. 2007;46(12):1769–72. Wu W, Chen F, Liu Y, Ma Q, Mao T. Autologous injectable tissue-engineered cartilage by using platelet-rich plasma: experimental study in a rabbit model. J Oral Maxillofac Surg. 2007;65(10):1951–7. Источник | ||