Полиакриламидный гель (ПААГ)
Реферат на тему:
Полиакриламидный гель (ПААГ)
1. Полиакриламидный гель (ПААГ)
Это — продукт полимеризации акриламида. В результате разрывов двойных связей и конденсации по ним получаются длинные бесцветные нити линейного полимера полиакриламида. Эти нити могут быть ковалентно связаны («сшиты») между собой.
Конечно, в реальных полимерах нити полиакриламида вовсе не параллельны, а расположены хаотически, но в отдельных точках своего сближения они сшиты мостиками «Биса». Получаются неправильной формы поры пространственной решетки, средний размер которых, тем не менее, определяется частотой расположения сшивок и концентрацией основных нитей полимеров.
Оба мономера: акриламид и «Бис» представляют собой хорошо растворимые в водной среде порошки. Образование пространственной сетки геля происходит прямо в растворе выбранного буфера, который благодаря этому заполняет все поры геля.
Полимеризацию стимулируют добавки в малых количествах еще двух веществ. Одно из них служит инициатором процесса полимеризации, второе — ускоряет этот процесс.
Содержание водной фазы в геле очень велико — от 70 до 97%.
Пористость и механические характеристики ПААГ задают путем выбора процентного отношения суммарной массы обоих полимеров к объему геля. Эту величину принято обозначать буквой Т. Практически она варьирует от 3 до 30%. Вес сшивки («Биса») составляет обычно от 1 до 5% суммарного веса мономе-ров. Эту величину обозначают буквой С. При малых значениях сшивки (С 300 5
2. Электрофорез белков в вертикальных пластинах
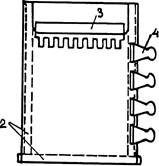
Первые опыты с электрофорезом белков ставились в вертикально стоящих трубочках. Для простоты изложения я в этой системе рассматривал и основные особенности электрофореза, не зависящие от формы геля. Однако в ходе эксплуатации довольно скоро выяснилось, что система трубочек неудобна в двух отношениях. Во-первых, в трубочке трудно добиться одинакового охлаждения геля по всему ее сечению. Во-вторых, для сравнения результатов электрофореза нескольких сопоставляемых препаратов белков нужно было приготовить столько же отдельных трубочек в совершенно одинаковых условиях состава и полимеризации ПААГ, что затруднительно. Поэтому с середины 70-х годов электрофорез белков ведут исключительно в вертикально расположенных пластинах (рис. 1).
2-ПРОКЛАДКИ; 3-ПЛЕНКА; 4-ЗАЖИМ
Обычно используют пластины шириной 8-14 см и длиной до 30 см. Полимеризацию акриламида, а затем и сам электрофорез ведут в форме, образованной двумя пластинами зеркального стекла толщиной 5 мм. Переднее стекло (на рис. 37) имеет вырез, назначение которого будет ясно из дальнейшего.
Расстояние между пластинами, — а значит и толщина геля, — задается толщиной прокладок из тефлона (0,4-1,5 мм) при ширине 10-15 мм (на рисунке они показаны пунктиром). Эти прокладки устанавливают по бокам и внизу формы, при условии плотного прилегания нижней прокладки к торцам боковых. Нижняя прокладка — немного выступает за пределы формы, поскольку после затвердевания геля ее надлежит удалить. Тефлон хорошо прилегает к зеркальному стеклу, а нижние торцы боковых прокладок можно слегка смазать силиконовым маслом. Прокладки между стеклами надежно зажимают по всей периферии пружинными зажимами для бумаг. (На рисунке показаны только 4 зажима с одной стороны пластины.) Вся камера таким образом должна быть надежно герметизирована, кроме верхнего ее края, на то время, пока в ней будет проходить полимеризация жидкой смеси предшественников ПААГ.
По окончании этого процесса (о чем можно судить по образованию резкой границы между гелем и тонким слоем воды, которым защищают полимеризацию от контакта с кислородом воздуха) зажимы можно снять. Полимеризация занимает обычно 30-40 минут.
В аналитических опытах на каждой пластине в параллельных «треках» ведут электрофорез нескольких препаратов, состав которых затем можно сопоставлять при строго одинаковых условиях разделения (рис.2 ).
Для фиксации этих треков в ходе полимеризации на верхнем крае геля формируют ряд одинаковых углублений прямоугольной формы «карманов», куда затем и вносят различные препараты.
Для этого в еще не заполимеризовавшийся гель вставляют «гребенку» из тефлона, такой же толщины, как прокладки между стеклами. Как видно на разрезе, верхняя часть гребенки делается немного толще, чем нижняя (с зубцами). Это удобно так как позволяет устанавливать гребенку каждый раз одинаково и ровно — до упора в торец стеклянной пластины. Жидкий гель заливают между пластинами с таким расчетом, чтобы при опускании гребенки до упора он заполнял бы промежутки между ее зубцами. Торцы зубцов гребенки перед установкой смачивают, потерев их об стекло с налитым на него жидким гелем. Кроме того начинают вставлять ее с некоторым перекосом, следя за тем, чтобы под зубцами не задержались пузырьки воздуха.
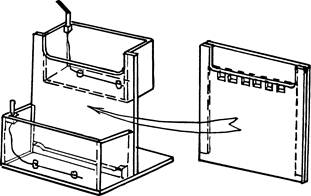
После завершения полимеризации геля снимают зажимы, удаляют нижнюю прокладку и вынимают гребенку. Весь «сэндвич» сохраняет свою целостность благодаря прилипанию ПААГ к стеклу. Его устанавливают в простой прибор, склеенный из оргстекла — его нетрудно изготовить в лабораторных условиях (рис. 3). Так, чтобы то стекло формы геля, которое имеет вырез, прилегало к верхнему резервуару прибора. Вырезы в стекле и резервуаре совпадают, а второе, не вырезанное стекло формы геля, замыкает собой объем резервуара.
Его можно заполнять буфером, который таким образом попадает и в карманы геля. Естественно, что всю форму с гелем надо хорошо прижать к стенке прибора (лучше через резиновую прокладку), чтобы предотвратить вытекание буфера из верхнего резервуара. На дне коробки нижнего резервуара видна опора, на которую ставят пластины с гелем. Выемка на этой опоре обеспечивает контакт нижнего буфера с нижним торцом геля. Необходимо проверять, что на этом торце тоже нет пузырьков воздуха.
Препараты белков с добавленной в них сахарозой или глицерином вносят в карманы геля после окончания сборки прибора, осторожно подслаивая их, как было описано выше, под буфер. Препараты должны быть заведомо освобождены от пыли, нерастворившихся белков и других посторонних частиц фильтрованием или центрифугированием.
В верхнем и нижнем резервуарах для буфера видны проволочки электродов. Через штырьковые разъемы их присоединяют к клеммам источника питания.
В приборе описанного типа можно обойтись и без вырезов в стеклянной пластине и верхнем резервуаре, если электрическую цепь между верхним буфером и гелем замкнуть через смоченный тем же буфером широкий фитиль из толстой фильтровальной бумаги. Конструкция прибора упрощается, но при этом следует иметь в виду возможность обсыхания фитиля, что приведет к увеличению его электрического сопротивления, а следовательно к уменьшению напряжения, подающегося на гель.
По окончании электрофореза пластины разнимают, отслаивая одну из них от геля с помощью шпателя. Его всовывают между пластинами со стороны карманов и слегка поворачивают. Эту операцию не следует форсировать. Лучше сначала пройтись шпателем с легким нажимом вдоль всего верхнего края пластины, наблюдая за тем как между стеклом и гелем постепенно проникает воздух, а потом уже приподнять пластину. Со второй пластины гель снимают руками и переносят в ванночку для фиксации белков и их окраски. Эту простую операцию следует производить в перчатках. Случайное прикосновение руки к рабочей поверхности геля при современных высокочувствительных методах окрашивания может оставить на геле артефактное белковое пятно.
Я намеренно столь подробно описал операцию проведения электрофореза в этом простом устройстве, чтобы дать учащемуся или читателю представление о необходимости исключительной предусмотрительности и тщательности в постановке соответствующих экспериментов.
Источник
Электрофорез в полиакриламидном геле — Polyacrylamide gel electrophoresis
Электрофорез в полиакриламидном геле ( PAGE ) — это метод, широко используемый в биохимии , судебной химии , генетике , молекулярной биологии и биотехнологии для разделения биологических макромолекул , обычно белков или нуклеиновых кислот , в соответствии с их электрофоретической подвижностью . Электрофоретическая подвижность зависит от длины, конформации и заряда молекулы. Электрофорез в полиакриламидном геле — мощный инструмент, используемый для анализа образцов РНК. Когда полиакриламидный гель денатурируется после электрофореза, он предоставляет информацию о составе образца РНК.
Гидратация из акрилонитрила приводит к образованию акриламида молекул ( С
3 ЧАС
5 NO ) нитрилгидратазой . Перед добавлением воды мономер акриламида находится в порошкообразном состоянии. Акриламид токсичен для нервной системы человека, поэтому при работе с ним необходимо соблюдать все меры безопасности. Акриламид растворим в воде и при добавлении радикальных инициаторов полимеризуется с образованием полиакриламида. Полезно получать полиакриламидный гель путем гидратации акриламида, поскольку размер пор можно регулировать. Повышенные концентрации акриламида приводят к уменьшению размера пор после полимеризации. Полиакриламидный гель с маленькими порами помогает лучше исследовать более мелкие молекулы, поскольку маленькие молекулы могут проникать в поры и перемещаться через гель, в то время как большие молекулы задерживаются в отверстиях пор.
Как и во всех формах гель-электрофореза , молекулы могут работать в своем естественном состоянии , сохраняя структуру молекул более высокого порядка. Этот метод называется native-PAGE. В качестве альтернативы можно добавить химический денатурант, чтобы удалить эту структуру и превратить молекулу в неструктурированную молекулу, подвижность которой зависит только от ее длины (поскольку все комплексы белок-SDS имеют одинаковое отношение массы к заряду). Эта процедура называется SDS-PAGE . Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) — это метод разделения молекул на основе разницы в их молекулярной массе. При pH, при котором проводят гель-электрофорез, молекулы SDS заряжаются отрицательно и связываются с белками в заданном соотношении, примерно одна молекула SDS на каждые 2 аминокислоты. Таким образом, детергент обеспечивает всем белкам равномерное соотношение заряда к массе. Связываясь с белками, детергент разрушает их вторичную, третичную и / или четвертичную структуру, денатурируя их и превращая в отрицательно заряженные линейные полипептидные цепи. Под воздействием электрического поля в PAGE отрицательно заряженные полипептидные цепи перемещаются к аноду с различной подвижностью. Их подвижность или расстояние, пройденное молекулами, обратно пропорционально логарифму их молекулярной массы. Сравнивая относительное отношение расстояния, пройденного каждым белком, к длине геля (Rf), можно сделать выводы об относительной молекулярной массе белков, где длина геля определяется расстоянием, пройденным небольшой молекулой. как следящий краситель.
Для нуклеиновых кислот мочевина является наиболее часто используемым денатурирующим агентом. Для белков додецилсульфат натрия (SDS) представляет собой анионный детергент, применяемый к образцам белков для покрытия белков, чтобы передать два отрицательных заряда (от каждой молекулы SDS) на каждые две аминокислоты денатурированного белка. 2-Меркаптоэтанол также можно использовать для разрыва дисульфидных связей, обнаруженных между белковыми комплексами, что способствует дальнейшей денатурации белка. В большинстве белков связывание SDS с полипептидными цепями обеспечивает равномерное распределение заряда на единицу массы, что приводит к фракционированию по приблизительному размеру во время электрофореза. Белки с более высоким гидрофобным содержанием — например, многие мембранные белки и те, которые взаимодействуют с поверхностно-активными веществами в своей природной среде — по сути сложнее точно обрабатывать с помощью этого метода из-за большей вариабельности соотношения связанных SDS. С процедурной точки зрения совместное использование как Native, так и SDS-PAGE может быть использовано для очистки и разделения различных субъединиц белка. Native-PAGE сохраняет олигомерную форму нетронутой и будет показывать полосу на геле, которая представляет уровень активности. SDS-PAGE денатурирует и разделяет олигомерную форму на ее мономеры, показывая полосы, которые представляют их молекулярные массы. Эти полосы можно использовать для идентификации и оценки чистоты белка.
СОДЕРЖАНИЕ
Процедура
Базовые приготовления
Образцы могут быть любым материалом, содержащим белки или нуклеиновые кислоты. Они могут быть получены биологическим путем, например, из прокариотических или эукариотических клеток, тканей, вирусов, образцов окружающей среды или очищенных белков. В случае твердых тканей или клеток они часто сначала разрушаются механически с помощью блендера (для больших объемов образцов), с использованием гомогенизатора (меньшие объемы), с помощью ультразвукового устройства или с использованием циклического воздействия высокого давления, а также комбинации биохимических и биохимических методов. механические методы, включая различные типы фильтрации и центрифугирования, могут использоваться для разделения различных клеточных компартментов и органелл перед электрофорезом. Синтетические биомолекулы, такие как олигонуклеотиды, также могут быть использованы в качестве аналитов.
Образец для анализа при желании необязательно смешивают с химическим денатурирующим агентом, обычно SDS для белков или мочевиной для нуклеиновых кислот. SDS — это анионный детергент, который денатурирует вторичные и не связанные дисульфидными связями третичные структуры и дополнительно накладывает отрицательный заряд на каждый белок пропорционально его массе. Мочевина разрывает водородные связи между парами оснований нуклеиновой кислоты, вызывая разделение составляющих цепей. Нагревание образцов до температуры не менее 60 ° C дополнительно способствует денатурации.
В дополнение к SDS белки могут быть на короткое время нагреты до почти кипения в присутствии восстанавливающего агента, такого как дитиотреитол (DTT) или 2-меркаптоэтанол (бета-меркаптоэтанол / BME) , который дополнительно денатурирует белки за счет уменьшения дисульфидных связей, таким образом преодолевая некоторые формы третичного сворачивания белка и разрушая структуру четвертичного белка (олигомерные субъединицы). Это известно как сокращение SDS-PAGE.
В раствор может быть добавлен следящий краситель. Обычно он имеет более высокую электрофоретическую подвижность, чем аналиты, что позволяет экспериментатору отслеживать продвижение раствора через гель во время электрофоретического анализа.
Приготовление акриламидных гелей
Гели обычно состоят из акриламида , бисакриламида , необязательного денатурирующего агента (SDS или мочевина) и буфера с отрегулированным pH. Раствор можно дегазировать под вакуумом, чтобы предотвратить образование пузырьков воздуха во время полимеризации. В качестве альтернативы, бутанол может быть добавлен в растворяющий гель (для белков) после его заливки, поскольку бутанол удаляет пузырьки и делает поверхность гладкой. Источник свободных радикалов и стабилизатор, такой как персульфат аммония и ТЕМЕД , добавляются для инициирования полимеризации. В результате реакции полимеризации образуется гель из-за добавленного бисакриламида , который может образовывать поперечные связи между двумя молекулами акриламида. Отношение бисакриламида к акриламиду можно варьировать для специальных целей, но обычно оно составляет примерно 1 часть к 35. Концентрация акриламида в геле также может варьироваться, обычно в диапазоне от 5% до 25%. Гели с более низким процентным содержанием лучше подходят для разделения молекул с очень высокой молекулярной массой, в то время как для разделения более мелких белков требуется гораздо более высокое процентное содержание акриламида. Средний диаметр пор полиакриламидных гелей определяется общей концентрацией акриламидов (% T с T = общая концентрация акриламида и бисакриламида) и концентрацией сшивающего бисакриламида (% C с C = концентрация бисакриламида). Размер пор уменьшается обратно до% T. Что касается% C, то концентрация 5% дает самые маленькие поры, поскольку влияние бисакриламида на размер пор имеет форму параболы с вершиной в 5%.
Гели обычно полимеризуются между двумя стеклянными пластинами в литейном устройстве для геля с гребенкой, вставленной вверху для создания лунок для образцов. После полимеризации геля гребешок можно удалить, и гель готов для электрофореза.
Электрофорез
В PAGE используются различные буферные системы в зависимости от природы образца и цели эксперимента. Буферы, используемые на аноде и катоде, могут быть одинаковыми или разными.
Электрическое поле прикладывается к гелю, заставляя отрицательно заряженные белки или нуклеиновые кислоты мигрировать через гель от отрицательного электрода (который является катодом, поскольку это электролитический, а не гальванический элемент) и к положительному электроду ( анод). В зависимости от своего размера каждая биомолекула по-разному движется через матрицу геля: небольшие молекулы легче проходят через поры в геле, а более крупным — сложнее. Гель обычно протекает в течение нескольких часов, хотя это зависит от напряжения, приложенного к гелю; миграция происходит быстрее при более высоких напряжениях, но эти результаты обычно менее точны, чем при более низких напряжениях. По прошествии установленного времени биомолекулы мигрировали на разные расстояния в зависимости от их размера. Более мелкие биомолекулы перемещаются дальше по гелю, в то время как более крупные остаются ближе к месту происхождения. Таким образом, биомолекулы могут быть разделены примерно по размеру, который зависит в основном от молекулярной массы в денатурирующих условиях, но также зависит от конформации более высокого порядка в естественных условиях. Подвижность геля определяется как скорость миграции при градиенте напряжения 1 В / см и измеряется в см 2 / сек / В. Для аналитических целей относительная подвижность биомолекул, R f , отношение расстояния, пройденного молекулой по гелю к общему расстоянию движения следящего красителя, наносится на график в зависимости от молекулярной массы молекулы (или иногда логарифма MW, или, скорее, M r , молекулярный радиус). Такие обычно линейные графики представляют стандартные маркеры или калибровочные кривые, которые широко используются для количественной оценки различных размеров биомолекул.
Однако некоторые гликопротеины аномально действуют на гелях с SDS. Кроме того, сообщается, что анализ более крупных белков в диапазоне от 250 000 до 600 000 Да является проблематичным из-за того, что такие полипептиды неправильно перемещаются в обычно используемых гелевых системах.
Дальнейшая обработка
После электрофореза гель можно окрашивать (для белков, чаще всего с помощью кумасси бриллиантового синего R-250 или авторадиографии; для нуклеиновых кислот, бромистым этидием ; или для любого из них, окрашивать серебром ), что позволяет визуализировать разделенные белки, или обрабатывать далее ( например Вестерн-блоттинг ). После окрашивания биомолекулы разных видов проявляются в виде отдельных полос внутри геля. Обычно маркеры размера молекулярной массы известной молекулярной массы размещаются на отдельной дорожке в геле для калибровки геля и определения приблизительной молекулярной массы неизвестных биомолекул путем сравнения пройденного расстояния относительно маркера.
Для белков SDS-PAGE обычно является первым выбором в качестве анализа чистоты из-за его надежности и простоты. Присутствие SDS и стадия денатурирования разделяют белки примерно по размеру, но может происходить аберрантная миграция некоторых белков. Различные белки также могут окрашиваться по-разному, что мешает количественной оценке путем окрашивания. PAGE можно также использовать в качестве препаративного метода очистки белков. Например, количественный препаративный электрофорез в нативном непрерывном полиакриламидном геле ( QPNC-PAGE ) представляет собой метод разделения нативных металлопротеинов в сложных биологических матрицах.
Химические ингредиенты и их роль
Полиакриламидный гель (ПАГ) был известен как потенциальная среда для заливки срезов тканей еще в 1964 году, и две независимые группы использовали ПАГ в электрофорезе в 1959 году. Он обладает несколькими электрофоретически желательными свойствами, которые делают его универсальной средой. Это синтетический, термостойкий, прозрачный, прочный, химически относительно инертный гель, который может быть приготовлен с широким диапазоном средних размеров пор. Размер пор геля и воспроизводимость размера пор геля определяются тремя факторами: общим количеством присутствующего акриламида (% T) (T = общая концентрация мономера акриламида и бисакриламида), количеством сшивающего агента (% C ) (C = концентрация бисакриламида) и время полимеризации акриламида (см. QPNC-PAGE). Размер пор уменьшается с увеличением% T; при сшивании 5% C дает наименьший размер пор. Любое увеличение или уменьшение% C от 5% увеличивает размер пор, поскольку размер пор по отношению к% C является параболической функцией с вершиной, равной 5% C. По всей видимости, это происходит из-за неоднородного связывания полимерных нитей в геле. Этот гелевый материал также может выдерживать высокиеградиенты напряжения , поддается различным процедурам окрашивания и обесцвечивания, его можно переваривать для извлечения разделенных фракций или сушить для авторадиографии и постоянной записи.
Компоненты
Полиакриламидные гели состоят из геля для укладки и разделяющего геля. Укладывающиеся гели имеют более высокую пористость по сравнению с разделяющим гелем и позволяют белкам перемещаться в концентрированной области. Кроме того, штабелируемые гели обычно имеют pH 6,8, поскольку нейтральные молекулы глицина обеспечивают более быструю подвижность белка. Разделительные гели имеют pH 8,8, где анионный глицин замедляет подвижность белков. Разделительные гели позволяют разделить белки и имеют относительно более низкую пористость. Здесь белки разделены на основе размера (в SDS-PAGE) и размера / заряда (Native PAGE).
Химический буфер стабилизирует значение pH до желаемого значения в самом геле и в буфере для электрофореза. Выбор буфера также влияет на электрофоретическую подвижность буферных противоионов и тем самым на разрешение геля. Буфер также должен быть инертным, не модифицировать и не реагировать с большинством белков. В зависимости от области применения в качестве катодного и анодного буферов могут использоваться, соответственно, разные буферы. В одном геле можно использовать несколько значений pH, например, в DISC-электрофорезе. Общие буферы в PAGE включают Трис , Бис-Трис или имидазол .
Противоионы уравновешивают собственный заряд буферного иона, а также влияют на напряженность электрического поля во время электрофореза. В катодных буферах SDS-PAGE часто избегают высокозаряженных и подвижных ионов, но они могут быть включены в сам гель, где он мигрирует впереди белка. В таких приложениях, как DISC SDS-PAGE, значения pH в геле могут изменяться, чтобы изменить средний заряд противоионов во время анализа, чтобы улучшить разрешение. Популярные противоионы — глицин и трицин . Глицин использовался в качестве источника замыкающего иона или медленного иона, потому что его pKa составляет 9,69, а подвижность глицината такова, что эффективная подвижность может быть установлена на значение ниже, чем у самых медленных известных белков с чистым отрицательным зарядом в диапазоне pH. Минимальный pH в этом диапазоне составляет приблизительно 8,0.
Акриламид ( C
3 ЧАС
5 НЕТ ; мВт: 71,08) при растворении в воде, медленно, спонтанная автоматическая полимеризация акриламида происходит, соединяя молекулу вместе с головой на хвост моде , чтобы сформировать длинные одноцепочечные полимеры. Наличие системы, генерирующей свободные радикалы, значительно ускоряет полимеризацию. Этот вид реакции известен как полимеризация присоединением винила . Раствор этих полимерных цепей становится вязким, но не образует гель, потому что цепи просто скользят друг по другу. Для образования геля необходимо соединить вместе различные цепи. Акриламид — канцерогенное вещество , нейротоксин и токсин для репродуктивной системы. Также важно хранить акриламид в прохладном темном и сухом месте, чтобы уменьшить автополимеризацию и гидролиз .
Бисакриламид ( N , N ‘-метиленбисакриламид ) ( C
7 ЧАС
10 N
2 О
2 ; mW: 154,17) является наиболее часто используемым сшивающим агентом для полиакриламидных гелей. Химически это можно представить как две молекулы акриламида, соединенные головой к голове своими нереактивными концами. Бисакриламид может сшивать две полиакриламидные цепи друг с другом, в результате чего получается гель.
Додецилсульфат натрия (SDS) ( C
12 ЧАС
25 NaO
4 S ; mW: 288,38) (используется только в денатурирующих белковых гелях) является сильным детергентным агентом, используемым для денатурирования нативных белков до индивидуальных полипептидов . Эта денатурация, которая называется реконструктивной денатурацией, достигается не за счет полной линеаризации белка, а за счет конформационного изменения комбинации случайной спирали и вторичных структур α-спирали. Когда смесь белков нагревается до 100 ° C в присутствии SDS, детергент оборачивается вокруг основы полипептида. Он связывается с полипептидами при постоянном весовом соотношении 1,4 г SDS / г полипептида. В этом процессе внутренние заряды полипептидов становятся незначительными по сравнению с отрицательными зарядами, вносимыми SDS. Таким образом, полипептиды после обработки становятся стержневидными структурами, обладающими однородной плотностью заряда, то есть таким же чистым отрицательным зарядом на единицу веса. Электрофоретическая подвижность этих белков является линейной функцией логарифмов их молекулярных масс. Без SDS разные белки с одинаковыми молекулярными массами мигрировали бы по-разному из-за различий в соотношении массы и заряда, поскольку каждый белок имеет изоэлектрическую точку и молекулярную массу, характерные для его первичной структуры . Это известно как родная СТРАНИЦА . Добавление SDS решает эту проблему, поскольку он связывается с белком и разворачивает его, обеспечивая почти однородный отрицательный заряд по длине полипептида.
Мочевина ( CO (NH
2 )
2 ; мВт: 60,06) представляет собой хаотропный агент, который увеличивает энтропию системы, препятствуя внутримолекулярным взаимодействиям, опосредованным нековалентными силами, такими как водородные связи и силы Ван-дер-Ваальса . Структура макромолекул зависит от суммарного воздействия этих сил, поэтому следует, что увеличение хаотропных растворенных веществ денатурирует макромолекулы,
Персульфат аммония (APS) ( N
2 ЧАС
8 S
2 О
8 ; mW: 228,2) является источником свободных радикалов и часто используется в качестве инициатора гелеобразования. Альтернативным источником свободных радикалов является рибофлавин , образующий свободные радикалы в фотохимической реакции.
ТЕМЕД ( N , N , N ‘, N ‘ -тетраметилэтилендиамин) ( C
6 ЧАС
16 N
2 ; mW: 116.21) стабилизирует свободные радикалы и улучшает полимеризацию. Скорость полимеризации и свойства получаемого геля зависят от концентрации свободных радикалов. Увеличение количества свободных радикалов приводит к уменьшению средней длины полимерной цепи, увеличению мутности геля и снижению эластичности геля. Уменьшение количества показывает обратный эффект. Следует использовать самые низкие каталитические концентрации, которые позволяют проводить полимеризацию за разумный период времени. APS и TEMED обычно используются примерно в эквимолярных концентрациях в диапазоне от 1 до 10 мМ.
Химия для обработки и визуализации
Следующие химические вещества и процедуры используются для обработки геля и визуализированных в нем образцов белка.
Следящий краситель; поскольку белки и нуклеиновые кислоты в основном бесцветны, их прохождение через гель во время электрофореза нелегко проследить. Поэтому в буфер для образцов для ПААГ обычно включают анионные красители с известной электрофоретической подвижностью. Очень распространенный следящий краситель — это бромфеноловый синий (BPB, 3 ‘, 3 «, 5’, 5» тетрабромфенолсульфонфталеин). Этот краситель окрашен при щелочном и нейтральном pH и представляет собой небольшую отрицательно заряженную молекулу, которая движется к аноду . Будучи высокомобильной молекулой, он опережает большинство белков. Когда он достигает анодного конца среды для электрофореза, электрофорез останавливают. Он может слабо связываться с некоторыми белками и придавать синий цвет. Другими распространенными отслеживающими красителями являются ксилолцианол , который имеет более низкую подвижность, и Orange G , который имеет более высокую подвижность.
Погрузочные средства; большинство систем PAGE загружают сверху в лунки геля. Чтобы гарантировать, что образец опускается на дно геля, буфер для образца дополняется добавками, которые увеличивают плотность образца. Эти добавки должны быть неионными и инертными по отношению к белкам, чтобы не мешать электрофорезу. Обычные добавки — глицерин и сахароза .
Кумасси бриллиантовый синий R-250 (CBB) ( C
45 ЧАС
44 год N
3 NaO
7 S
2 ; мВт: 825,97) является наиболее популярным белковым красителем. Это анионный краситель, который неспецифически связывается с белками. Структура CBB преимущественно неполярная, и он обычно используется в метанольном растворе, подкисленном уксусной кислотой. Белки в геле фиксируются уксусной кислотой и одновременно окрашиваются. Избыток красителя, включенного в гель, можно удалить, обесцвечивая тем же раствором без красителя. Белки обнаруживаются в виде синих полос на прозрачном фоне. Поскольку SDS также является анионным, он может мешать процессу окрашивания. Поэтому рекомендуется большой объем окрашивающего раствора, по крайней мере, в десять раз превышающий объем геля.
Бромид этидия (EtBr) является популярным красителем нуклеиновых кислот. EtBr позволяет легко визуализировать ДНК или РНК на геле, поскольку EtBr флуоресцирует оранжевым цветом в УФ-свете. Бромид этидия связывает цепи нуклеиновых кислот в процессе интеркаляции. Хотя этидий бромид является популярным красителем, важно соблюдать осторожность при использовании EtBr, поскольку он является известным канцерогеном . Из-за этого многие исследователи предпочитают использовать красители, такие как SYBR Green и SYBR Safe, которые являются более безопасными альтернативами EtBr. EtBr используется, просто добавляя его в гелевую смесь. После того, как гель растекся, гель можно просмотреть с помощью системы фотодокументации.
Окрашивание серебром используется, когда требуется более чувствительный метод обнаружения, поскольку при классическом окрашивании кумасси бриллиантовым синим обычно можно обнаружить полосу белка 50 нг, окрашивание серебром увеличивает чувствительность, как правило, в 10–100 раз. Это основано на химии фотографического развития. Белки фиксируются на геле разбавленным раствором метанола, затем инкубируются с кислым раствором нитрата серебра. Ионы серебра восстанавливаются до своей металлической формы формальдегидом при щелочном pH. Кислый раствор, например уксусная кислота, останавливает развитие. Окрашивание серебром было введено Кереньи и Галлясом в качестве чувствительной процедуры для обнаружения следовых количеств белков в гелях . Метод был распространен на изучение других биологических макромолекул , которые были разделены на различных носителях. Многие переменные могут влиять на интенсивность окраски, и каждый белок имеет свои собственные характеристики окрашивания; чистая стеклянная посуда, чистые реактивы и вода высшей степени чистоты — залог успешного окрашивания. Окрашивание серебром было разработано в 14 веке для окрашивания поверхности стекла. Он широко использовался для этой цели с 16 века. Цвет ранних серебряных пятен варьировался от светло-желтого до оранжево-красного. Камилло Гольджи усовершенствовал окрашивание серебром для исследования нервной системы . Метод Гольджи окрашивает ограниченное количество клеток случайным образом полностью.
Авторадиография, также используемая для обнаружения полос белка после гель-электрофореза, использует радиоактивные изотопы для маркировки белков, которые затем обнаруживаются с помощью рентгеновской пленки.
Вестерн-блоттинг — это процесс, с помощью которого белки, разделенные в акриламидном геле, электрофоретически переносятся на стабильную, управляемую мембрану, такую как мембрана из нитроцеллюлозы , нейлона или ПВДФ . Затем можно применять иммунохимические методы для визуализации перенесенных белков, а также точно идентифицировать относительное увеличение или уменьшение представляющего интерес белка.
Источник