- Как приготовить препарат для просмотра под микроскопом
- Фиксация препаратов
- Обезвоживание препаратов
- Просветление препаратов
- Заливка препаратов
- Изготовление срезов препаратов
- Окрашивание препаратов
- Как приготовить препарат для просмотра под микроскопом
- Приготовление влажного препарата для исследования
- Приготовление сухого препарата для исследования
- Подкрашивание препарата для исследования
- Приготовление препаратов для микроскопирования
Как приготовить препарат для просмотра под микроскопом
Биологические объекты можно исследовать как живыми, так и фиксированными. В последнем случае для более тщательного изучения материал можно разделить на части и обработать различными красителями, чтобы выявить и идентифицировать те или иные структуры. Из исследуемого объекта можно приготовить временные или постоянные препараты.
Фиксация препаратов
Фиксация — это сохранение материала в состоянии, близком к естественному. Для этого необходимо быстро умертвить ткани, что лучше всего достигается с небольшими кусочками живого материала. Используемое для этого вещество называется фиксатором. Быстрой фиксацией достигается сохранение изначальной структуры объекта, причем ткани уплотняются настолько, что с них можно готовить тонкие срезы.
Обезвоживание препаратов
Обезвоживание проводится при подготовке материала к заливке или для заключения его в соответствующую среду, которая не смешивается с водой. Воду необходимо удалить также потому, что иначе препарат будет со временем разрушен бактериями. Для того чтобы сохранить ультраструктуру, обезвоживание надо проводить постепенно, обрабатывая материал рядом водных растворов этанола или про-панона (ацетона) со все возрастающей концентрацией, и закончить обработку «абсолютным» (безводным) этанолом или пропаноном.
Просветление препаратов
Некоторые из общеупотребительных сред для заливки и заключения не смешиваются со спиртом. Поэтому его надо постепенно замещать средой (просветляющим веществом), с которой заливочная среда смешивается, например ксилолом. Это приводит также к тому, что материал становится прозрачным.
Заливка препаратов
Для того чтобы с помощью микротома получить очень тонкий срез, необходимо, чтобы материал был залит в соответствующую опорную среду. При приготовлении препаратов для световой микроскопии объекты заливают в парафин, которому затем дают остыть. Для электронной микроскопии приходится использовать более твердые вещества (пластмассы или смолы), поскольку здесь необходимы особо тонкие срезы, а значит, и опора должна быть более плотной.
Различия в подготовке материалов для светового и электронного микроскопов
Изготовление срезов препаратов
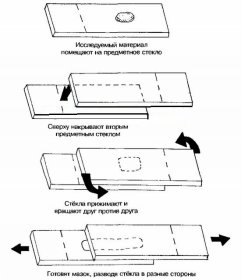
Как правило, толщина кусочков материала слишком велика, чтобы сквозь них могло пройти достаточное для исследования под микроскопом количество света. Обычно приходится срезать очень тонкий слой исследуемого материала, т. е. готовить срезы. Срезы можно делать бритвой или на микротоме. Вручную срезы готовятся с помощью остро отточенной бритвы. Для работы на обычном микроскопе срезы должны быть толщиной 8—12 мкм. Ткань закрепляют между двумя кусочками сердцевины бузины. Бритву смачивают жидкостью, в которой хранилась ткань; срез делают через бузину и ткань, причем бритву держат горизонтально и двигают ее к себе медленным скользящим движением, направленным чуть вкось. Быстро сделав несколько срезов, следует выбрать из них самый тонкий, содержащий характерные участки ткани.
Срез с ткани, залитой в ту или иную среду, можно сделать на микротоме. Для светового микроскопа срезы толщиной в несколько микрометров можно сделать с залитой в парафин ткани с помощью специального стального ножа. На ультратоме изготавливают чрезвычайно тонкие срезы (20—100 нм) для электронного микроскопа. В этом случае необходим алмазный или стеклянный нож.
Срезы для светового микроскопа можно приготовить, не заливая материал в среду; для этого используют замораживающий микротом. В процессе приготовления замороженного среза образец сохраняется в замороженном и, следовательно, в твердом состоянии.
Окрашивание препаратов
Как правило, биологические структуры на препаратах прозрачны, поэтому для получения контраста между ними приходится прибегать к различным средствам. Самым распространенным является окрашивание. Некоторые красители, используемые в световой микроскопии, перечислены в таблице.
Определенные красители в низких концентрациях не токсичны для живых тканей и поэтому могут применяться для окрашивания живого материала. Их называют прижизненными (витальными) красителями. К ним относятся, например, метиленовый синий и нейтральный красный.
При окрашивании парафиновых срезов парафин удаляют с помощью растворителя, а срез перед окрашиванием частично обводняют.
Полностью окрашенные срезы заключают на предметном стекле в специальную среду, например в канадский бальзам или эупарол; она не пропускает воздух, так что срез может сохраняться в ней неограниченно долго. Заключенный в среду срез накрывают покровным стеклом.
Последовательность описанных выше действий типична, когда речь идет о приготовлении тонких срезов для постоянных препаратов. Однако часто в порядок действий вносят два следующих изменения:
а) если срез сырого материала готовят вручную, то сначала делают срез, а потом его фиксируют;
б) окрашивать можно после фиксации или же в процессе обезвоживания на какой-либо его стадии. Например, красителем, растворенным в 50%-ном этаноле, можно окрасить срез после его обезвоживания в 50%-ном этаноле.
Описанная процедура приготовления препаратов в основном сходна как для светового, так и для электронного микроскопов, хотя существуют некоторые различия в деталях.
Источник
Как приготовить препарат для просмотра под микроскопом
Благодаря микроскопу человек открыл для себя удивительный мир, о существовании которого ранее и не мог подумать. Ежедневно по всему миру в лабораториях и медицинских центрах, учебных заведениях и на производственных предприятиях к окуляру светового или монитору цифрового микроскопа обращаются сотни тысяч внимательных пар глаз, пытаясь постичь доселе неведомое или еще раз убедиться, что процесс идет в верном направлении. Однако, материалы для исследований бывают разные, в том числе живые, и чтобы можно было с ними работать, следует правильно готовить микропрепараты, которые позволят всесторонне и качественно изучить предмет исследования. Все образцы для микроскопа, жизнь которых протекает на клеточном уровне, можно условно разделить на две основные категории, о которых мы поговорим ниже, также упомянув такой способ приготовления микропрепаратов, как окрашивание.
Приготовление влажного препарата для исследования
В приготовлении влажных препаратов для исследования под микроскопом возникает необходимость, если образец без воды живет непродолжительное время, как это бывает с некоторыми одноклеточными организмами. Для приготовления микропрепарата следует в центр чистого предметного стекла с помощью пипетки поместить одну-две капли дистиллированной воды. После размещения в воде исследуемого образца, его необходимо накрыть сверху покровным стеклом и немного прижать. Производить приготовление микропрепарата можно только в резиновых перчатках. В противном случае, жировые пятная от пальцев рук на стеклах будут мешать наблюдению образца под микроскопом.
Приготовление сухого препарата для исследования
Сухой препарат — это объект исследования, который не нуждается в воде для выживания. Приготовление сухого микропрепарата намного проще, чем влажного. Достаточно поместить как можно тонкий срез препарата в центр предметного стекла и накрыть его сверху покровным стеклом. Если на руках резиновые перчатки, образец для исследования под микроскопом можно немного прижать верхним стеклом.
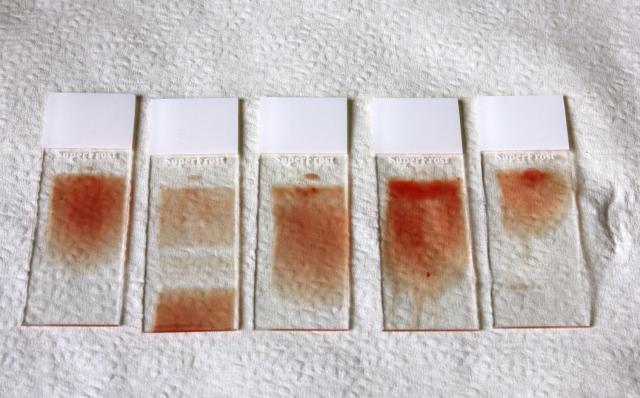
Подкрашивание препарата для исследования
Встречаются микроорганизмы, исследование которых под микроскопом без предварительного окрашивания невозможно. Самым надежными сегодня способом окрашивания является использование йодида калия или раствор йода — так называемые, растворы Люголя. Для приготовления микропрепарата следует поместить его в воду на предметном стекле, в которую необходимо добавить каплю контрастного вещества. Кроме раствора Люголя можно использовать растворы «кристаллического фиолетового» или «метиленового синего». Иногда бывает, что необходимо окрасить уже готовый микропрепарат. В этом случае следует разместить с одной стороны покровного стекла бумажную салфетку, а с другой — краситель. Салфетка вытянет влагу с одной стороны стекла и затянет под него краситель с другой, окрашивая тем самым исследуемый препарат.
Источник
Приготовление препаратов для микроскопирования
 |  | |
 | Практические советы Витальное окрашивание Прижизненное окрашивание Домашняя лаборатория Занимательная микроскопия Изготовление микропрепаратов Камера Горяева Классификация и маркировка объективов микроскопов Комбинации цветных стекол для выделения спектра Методы микроскопирования Методы исследования простейших Методы и приемы биологического эксперимента Микроскопия для начинающих Микроскопические измерения Модификации контрастной окраски по Граму Необходимое оборудование Общие методы заключения препаратов Организация и оснащение гистологической лаборатории Освещение по Келлеру Подготовка предметных стекол Поляризационная микроскопия Правила работы с микроскопом Правила ведения лабораторного журнала Приобретение микроскопа Приготовление микропрепаратов членистоногих Техника приготовления гистологических препаратов Фототубус для цифровых камер Формидрон инструкция по применению |  |
 |  |
 |  | |
 | |  |
 |  |  |
 |  | |
 | |  |
 |  |  |
 |  | |
 | |  |
 |  |  |
 |  | ||||||||||
 |
|  | |||||||||
 |  |
 |  | ||||||
 |
|  | |||||
 |  |  | |||||
 |  | |
 | |