- Методы приготовления препаратов для микроскопии, микробиология
- При работе необходимо соблюдать следующую последовательность:
- При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
- Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
- Метод окрашивания в модификации
- Приготовление препаратов
- Материалы
- Методические материалы и пособия
- Простейшие человека
- ВВЕДЕНИЕ
- Подготовка к анализу
- Взятие биоматериала
- Правила сбора каловых масс
- Копропротозооскопия (исследование фекалий на кишечные простейшие)
- Метод нативного мазка с физраствором и раствором Люголя
- Комплексный метод исследования фекалий на кишечные простейшие и гельминты из консерванта
- Метод влажного мазка из консерванта
- Метод исследования материала из консерванта формалин-эфирным обогащением
- Модифицированный метод окрашивания по Цилю-Нильсену мазков из осадка после обогащения консервированного материала
- Метод Бермана в модификации для исследования на балантидиаз
- Методы окрашенных мазков на криптоспоридиоз
- Морфологическая картина простейших при исследовании
- Дизентерийная амёба
- Лямблии
- Балантидий
- Криптоспоридии
- Определение в крови антител к паразитам
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
- Устанавливают микроскоп в рабочее положение, т.е. так, чтобы колонка была обращена в сторону исследователя, а зеркало — в направлении источника света.
- Ставят под тубус, пользуясь револьвером, объектив малого увеличения. Как правило, предмет рассматривают вначале при малом увеличении.
- Проверив, открыта ли диафрагма и поднят ли конденсор, вращают, глядя в окуляр, зеркало и устанавливают его так, чтобы поле зрения оказалось хорошо освещенным.
- Помещают препарат на предметный столик микроскопа так, чтобы рассматриваемый объект оказался над отверстием столика. Препарат закрепляют с помощью клемм.
- Находят фокусное расстояние, для чего опускают или поднимают тубус с помощью макрометрического винта. Для окончательной фокусировки пользуются микрометрическим винтом.
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Препараты готовят, как правило, на предметных стеклах, толщина которых не должна превышать 1,2 — 1,4 мм. Применение более толстых стекол не позволяет получить резкое изображение краев диафрагмы осветителя в плоскости препарата. Поверхность стекла должна быть тщательно очищена и обезжирена, чтобы капля жидкости равномерно расплывалась по стеклу. Это достигается протиранием стекол ватой, смоченной эфиром (после этого промывание водой не требуется), или обжиганием поверхности стекол в пламени горелки (жир при этом сгорает).
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
1. «Раздавленная капля». На предметное стекло наносят каплю водопроводной воды и помещают в нее небольшое количество клеток изучаемых микроорганизмов, размешивают и накрывают покровным стеклом. Микроорганизмы, выращенные на плотной питательной среде, переносят в каплю воды бактериологической петлей, выращенные в жидкой среде — стерильной пипеткой. В этом случае каплю воды на предметное стекло можно не наносить. Капля исследуемого материала должна быть настолько мала, чтобы после прижимания ее покровным стеклом не было избытка жидкости, выступающего из-под него. В противном случае избыток жид кости необходимо удалить фильтровальной бумагой.
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
1. Приготовление мазка. На обезжиренное спиртом предметное стекло помещают маленькую каплю водопроводной воды и переносят в нее петлей небольшое количество исследуемого материала как для препарата «раздавленная капля». Полученную суспензию равномерно размазывают петлей на площади 1 — 2 см2 возможно более тонким слоем. Мазок должен быть настолько тонок, чтобы высыхал после приготовления.
2. Высушивание мазка. Лучше всего сушить готовый препарат при комнатной температуре на воздухе. Хорошо приготовленный тонкий мазок высыхает быстро. Если высушивание мазка замедлено, то препарат можно слегка нагреть в струе теплого воздуха высоко над пламенем горелки, держа стекло мазком вверх. Эту операцию следует проводить осторожно, не перегревая мазка, иначе клетки микроорганизмов деформируются.
3. Фиксация препарата преследует несколько целей: убить микроорганизмы, то есть сделать безопасным дальнейшее обращение с ними; обес печить лучшее прилипание клеток к стеклу; сделать мазок более восприимчивым к окраске, так как мертвые клетки окрашиваются лучше, чем живые. Самым распространенным способом фиксации является термическая обработка. Для этого препарат трижды проводят через наиболее горячую часть пламени горелки, держа предметное стекло мазком вверх. Не следует перегревать мазок, так как при этом происходят грубые изменения клеточных структур, а иногда и внешнего вида клеток, например их сморщивание. Для исследования тонкого строения клетки прибегают к фиксации различными химическими веществами. Фиксирующую жидкость наливают на мазок, либо препарат на определенное время погружают в стакан с фиксатором.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Источник
Приготовление препаратов
Цитологический препарат (мазок) – основной объект изучения клеточного и неклеточного состава. Препарат готовят, распределяя (размазывая) образец возможно более тонким слоем по сухому стеклу (традиционная цитология) или с помощью цитоцентрифуги (жидкостная цитология, тонкослойные препараты), выполняя его фиксацию и окрашивание перед исследованием. Для приготовления цитологического препарата необходимо использовать новые стандартные тонкие сухие обезжиренные стекла.
Параметры стандартно приготовленного традиционного мазка:
- начало мазка на расстоянии 1–1,5 см от узкого края предметного стекла, конец – на расстоянии 2–2,5 см от другого его края;
- при исследовании жидкого материала (жидкость серозной и кистозной полости, смыв и др.) мазок из осадка должен заканчиваться у узкого края предметного стекла в виде зубчатого следа (щеточки);
- мазок должен быть максимально тонким (приближающимся к однослойному), равномерной толщины на всем протяжении;
- мазок не должен достигать длинного края предметного стекла на расстояние 0,2–0,3 см.
При невыполнении условий приготовления мазок может содержать недоступные детальному изучению (непросматриваемые) нагромождения клеток или тканевые клочки или недостаточный для интерпретации клеточный материал (неинформативный мазок).
Жидкостная цитология – метод приготовления препаратов из клеточной взвеси в жидкой среде, используется взамен или в дополнение к традиционному приготовлению мазков. Любой клеточный материал помещается в консервирующую (стабилизирующую) среду и из полученной взвеси (клеточной суспензии) готовят тонкослойные препараты с помощью специальных цитоцентрифуг или автоматизированных / полуавтоматизированных систем. Оставшуюся после приготовления препаратов жидкость с клеточной суспензией при необходимости используют для проведения молекулярно-биологических исследований. Отбор проб для такого тестирования и повторного приготовления препаратов методом жидкостной цитологии может проводиться вручную или с помощью автоматических или полуавтоматических аппаратов.
Источник
Материалы
Методические материалы и пособия
Простейшие человека
ВВЕДЕНИЕ
Обнаружение и дифференцирование простейших (отличие патогенных форм от непатогенных) — довольно сложная задача. Большинство одноклеточных организмов в кале обнаруживают в двух формах: вегетативной (стадия трофозоита) — активной, подвижной, жизнедеятельной, легко поддающейся вредным воздействиям (в частности, охлаждению) и потому быстро погибающей после выделения из кишечника, и в виде устойчивых к внешним воздействиям цист (ооцист). В оформленном кале простейшие, как правило, обнаруживают лишь в инцистированном состоянии; для обнаружения вегетативных форм необходимо исследовать кал еще в тёплом состоянии. Это обусловлено тем, что в остывшем кале вегетативные формы простейших быстро гибнут и мертвыми быстро поддаются действию протео-литических ферментов, вследствие чего теряют характерные особенности своей структуры. Кроме того, при остывании уменьшается, а затем исчезает подвижность простейших — важный вспомогательный фактор при их дифференцировании.
В фекалиях можно выявить 20 видов простейших (8 патогенных и условно-патогенных и 12 комменсалов). Простейшие кишечника обитают в тонкой или толстой кишках в стадии трофозоита и/или цисты. Они относятся к одной из 4 групп: амёб, жгутиковых, реснитчатых и кокцидий. Основными и наиболее значимыми простейшими, вызывающими заболевания у человека, являются лямблии, дизентерийная амёба и балантидий.
Подготовка к анализу
Накануне анализа нужно исключить прием слабительных средств и продуктов, вызывающих разжижение стула. Не следует в течение двух суток до анализа применять ректальные свечи, масла и лекарственные препараты для стимуляции перистальтики кишечника. Не принимать в пищу красящие продукты и лекарства.
Взятие биоматериала
- дуоденальное зондирование. Использование специального зонда, который вводится через пищевод и достигает двенадцатиперстной кишки, желчных протоков. С целью забора материала желудочного сока и желчи;
- анализ кала на определение цисты. Лабораторное исследование утренних выделений пациента на наличие цист, яиц и самих особей паразитов;
- ректороманоскопия.
Часто проводят взятие биоматериала при подозрении на паразитов и при симптомах, которые они вызывают. Назначают при геморрое, выпадении прямой кишки. Если у пациента стул со слизью и кровяными выделениями. Процедура проводится с использованием специального прибора, состоящего из металлической трубки, аноскопа, осветительной лампочки и других вспомогательных элементов, которые вводятся в анальное отверстие для осмотра.
И только после подтверждения класса и вида паразита врач назначит препараты, соответствующие стадии и продолжительности приобретенного на фоне гельминтов заболевания.
Из-за подверженности вегетативных форм простейших вредным воздействиям, в т.ч. охлаждению, они обнаруживаются в кале только до его остывания (при охлаждении погибают), т.е. примерно 20 минут после сбора материала. Если исследование проводится в более поздние сроки, то анализ выявит только цисты простейших.
Понятие «циста» обычно характерно для описания жизненного цикла некоторых видов бактерий, протистов, и многих одноклеточных. Применимо оно для самого микроорганизма в покоящейся форме и для защитной оболочки, которая образуется как в неблагоприятные моменты, так и в определенный период размножения.
Правила сбора каловых масс
- Каловые массы должны быть выделены естественным образом, без использования каких-либо слабительных препаратов и клизм.
- Свежесть собранного биологического материала напрямую влияет на точность результата. С момента сбора должно пройти не более 6 часов.
- Огромное значение имеет диета, которую необходимо соблюдать в течение 3-5 дней до сбора биоматериала. Для этого нужно отказаться от жирной и тяжелой пищи, исключить употребление сладких, газированных и алкогольных напитков.
- Отменить прием лекарственных препаратов и активированного угля.
- Непосредственно перед сбором кала необходимо помочиться, принять гигиенические процедуры и тщательно удалить следы влаги.
- Сдается утром.
- Еще одно требование – не надо подмываться.
- После акта дефекации проводится забор с помощью ложечки и специальной тары, которую можно приобрести в любой аптеке.
- Собирается небольшое количество кала около двадцати грамм.
- Материал для анализа нужно доставить как можно быстрее в герметично укупоренной таре. Затем кал исследуют в лаборатории поликлиники.
- Следует отметить, что время после акта дефекации до того, как кал сдают в лабораторию, не должно превышать двух часов.
Для обнаружения цист простейших в кале предполагаемого больного, как правило, используются методы микроскопического исследования.
Цистные формы, которые можно найти в каловых массах:
- реснички (реснитчатые);
- споровые;
- корненожки;
- инфузории;
- жгутики (жгутиковые)
- кишечные кокцидии (криптоспоридии).
Наиболее распространённые патогенные микроорганизмы, встречающиеся в цистовой форме: Entamoeba coli (энтамёба коли, кишечная амёба), Chilomastix mesnili (хиломастикс), Lamblia intestinalis (лямблия), Entamoeba histolytica (дизентерийная амёба).
Копропротозооскопия (исследование фекалий на кишечные простейшие)
Метод нативного мазка с физраствором и раствором Люголя
Комплексный метод исследования фекалий на кишечные простейшие и гельминты из консерванта
Метод влажного мазка из консерванта
Метод исследования материала из консерванта формалин-эфирным обогащением
Модифицированный метод окрашивания по Цилю-Нильсену мазков из осадка после обогащения консервированного материала
Метод Бермана в модификации для исследования на балантидиаз
Методы окрашенных мазков на криптоспоридиоз
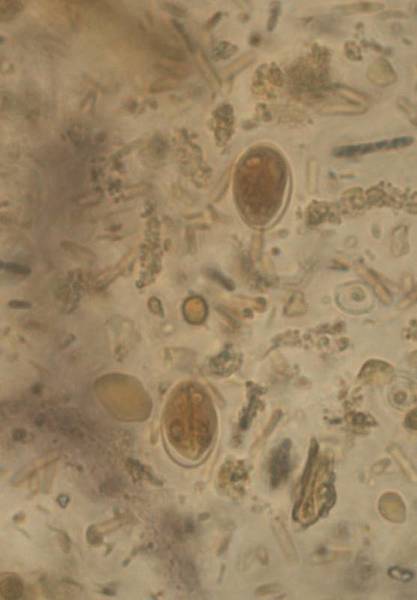
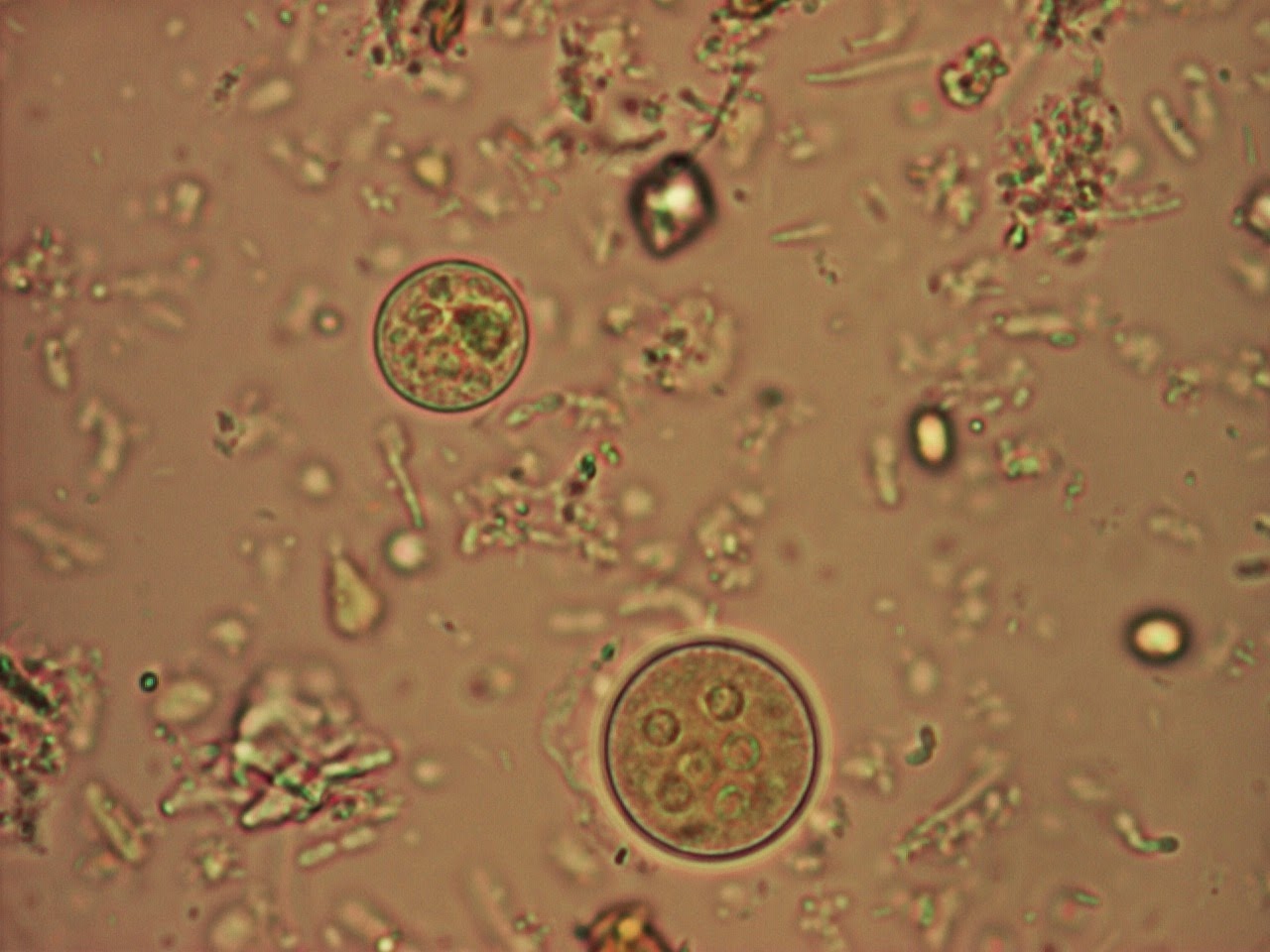
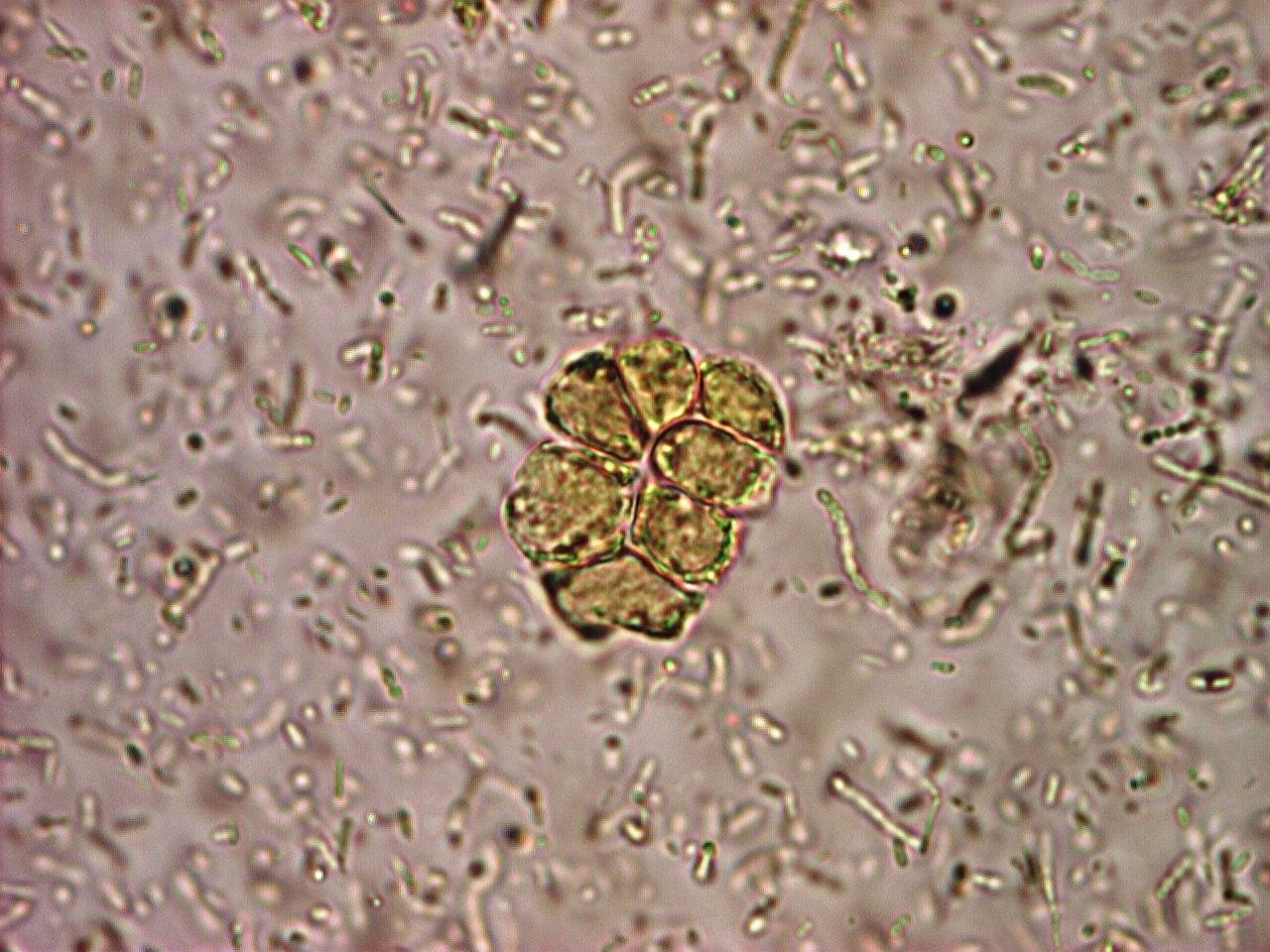
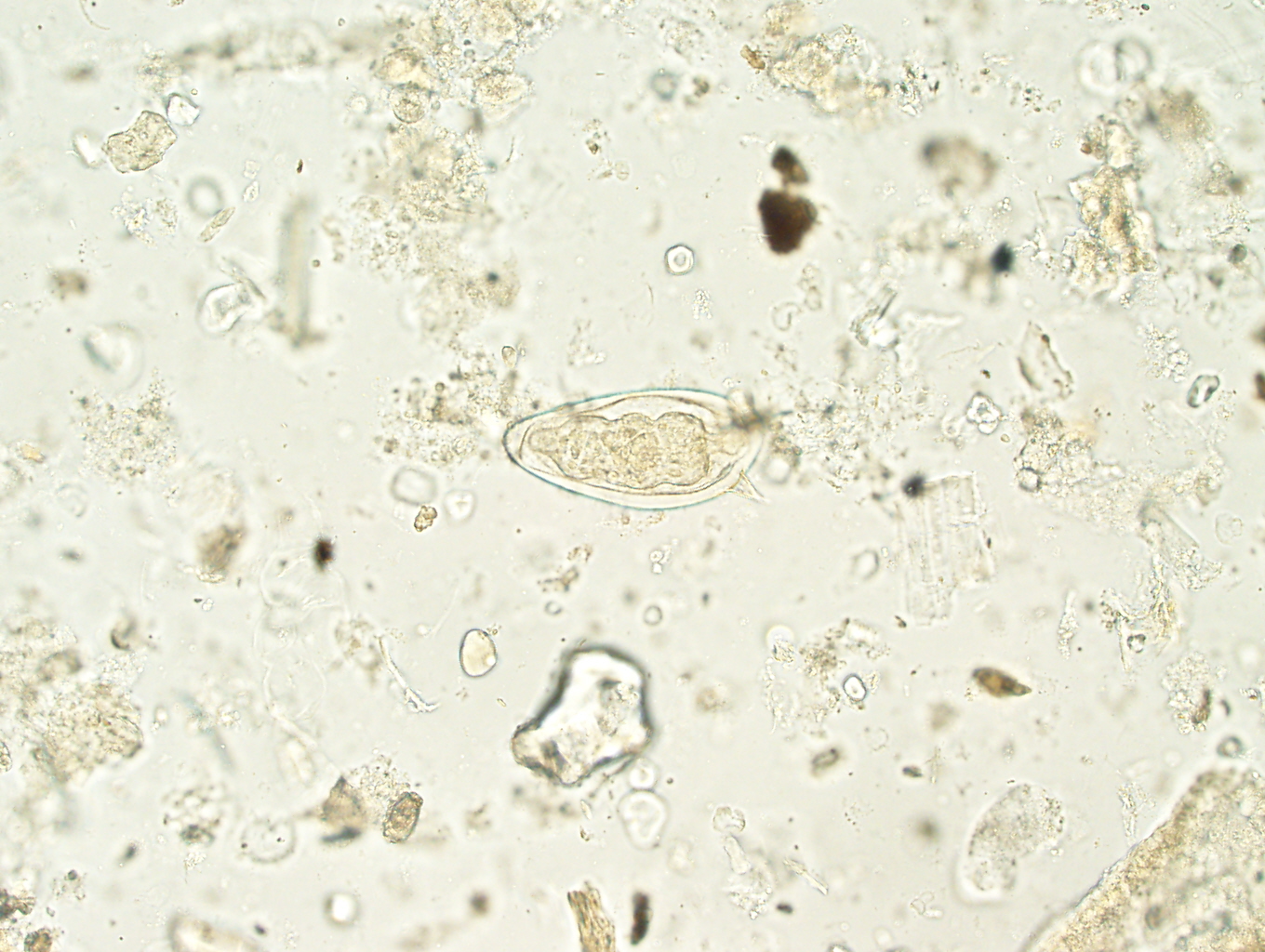
Морфологическая картина простейших при исследовании
Дизентерийная амёба
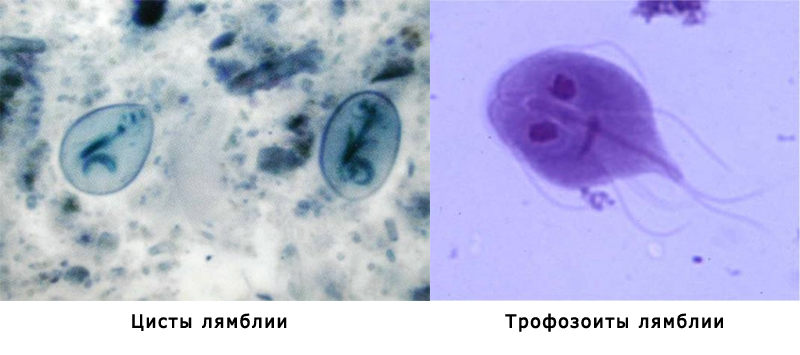
Лямблии
Lamblia intestinalis (лямблии) относится к классу жгутиковых. Лямблии паразитируют в тонкой кишке, преимущественно в двенадцатиперстной кишке, а также в жёлчном пузыре. Существование трофозоитов (вегетативная форма лямблий) требует жидкой среды, поэтому, попадая в толстую кишку, лямблии инцистируются, и в кале обнаруживают только цисты. Лишь при профузной диарее или после действия слабительных в испражнениях удаётся обнаружить вегетативные формы.
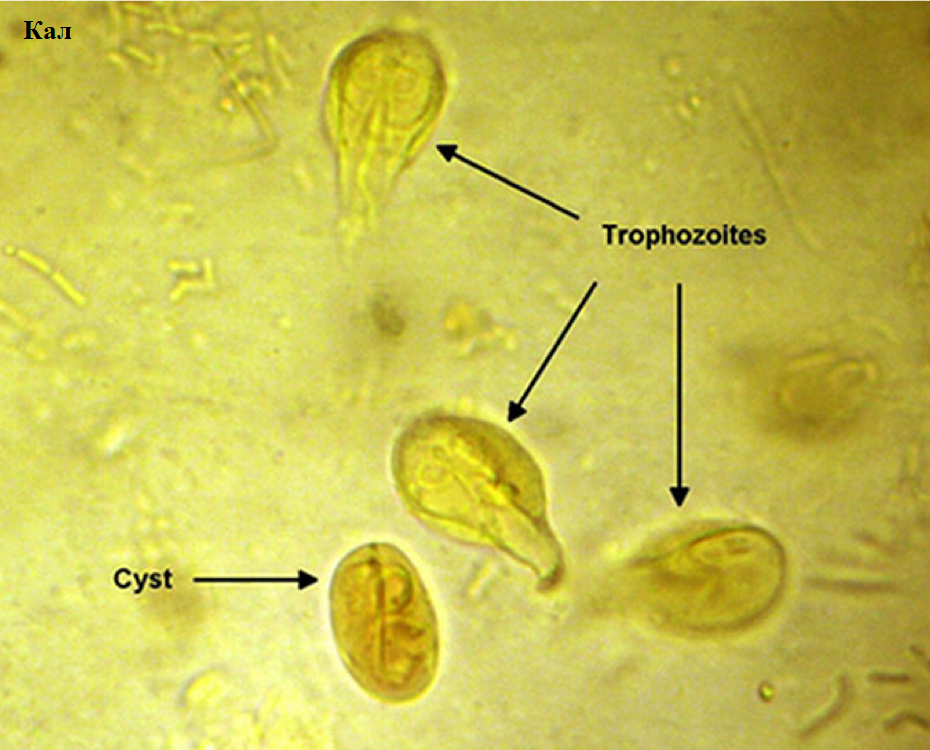
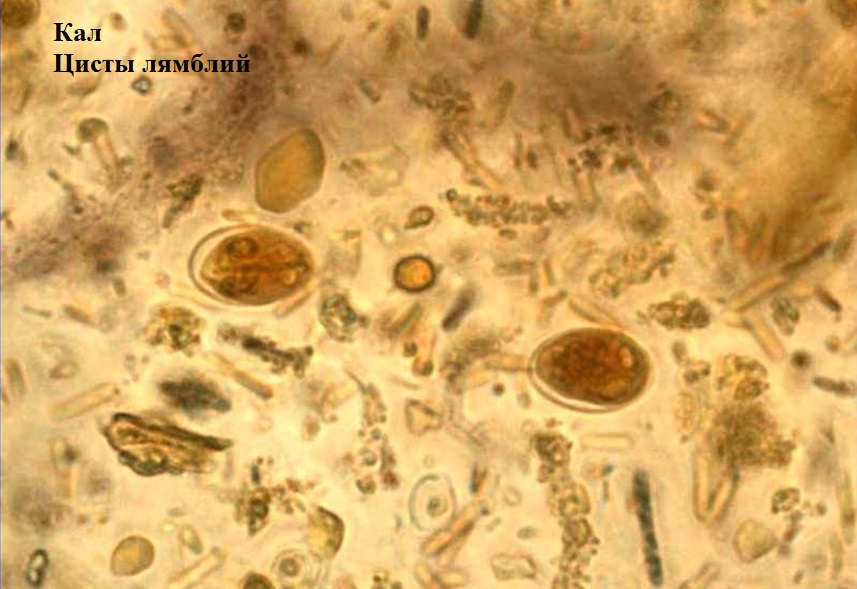
Балантидий
Balantidium coli. Балантидий — единственная ресничная инфузория, паразитирующая в кишечнике человека и вызывающая заболевания различной тяжести — от лёгких колитов до тяжёлых язвенных поражений. Возбудитель обнаруживают в фекалиях в форме трофозоитов или цист. Возможно носительство у здоровых людей.
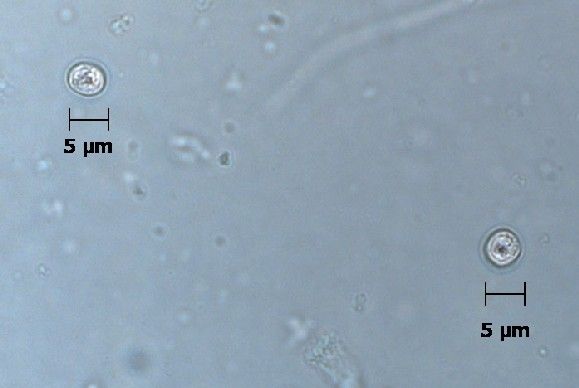
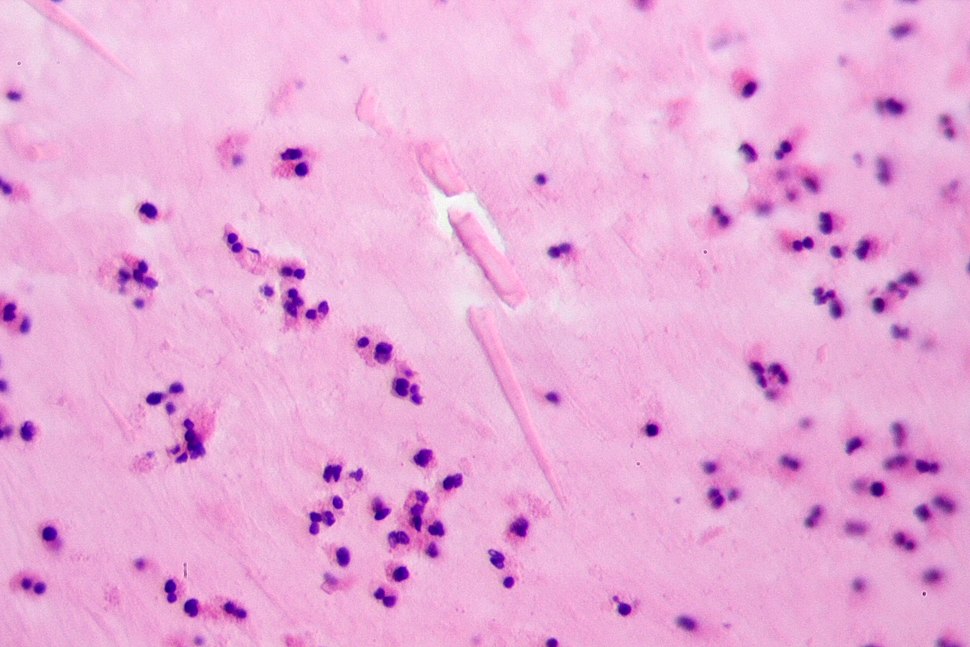
Криптоспоридии
Cryptosporidium. Представителей рода Cryptosporidium в настоящее время рассматривают как важнейших возбудителей диарей. Криптоспоридии (от греч. «скрытая спора») — облигатные паразиты, поражающие микроворсинки слизистых оболочек ЖКТ и дыхательных путей человека и животных. Инфекции ЖКТ, вызванные криптоспоридиями, зарегистрированы во всех странах мира. Такое широкое распространение криптоспоридиоза связано с большим количеством природных резервуаров инфекции, низкой инфицирующей дозой и высокой резистентностью возбудителя к дезинфицирующим веществам и противопаразитарным препаратам.
Среди криптоспоридий потенциально патогенными для человека видами являются Cryptosporidium parvum и Cryptosporidium felis (выявлены у ВИЧ-инфицированных). Наиболее типичная локализация инфекции у человека — дистальные отделы тонкой кишки. У пациентов с выраженными им-мунодефицитами может быть инфицирован весь ЖКТ — от ротоглотки до слизистой оболочки прямой кишки.
Диагностика криптоспоридиоза в большинстве случаев основана на обнаружении ооцист криптоспоридий в испражнениях и/или (значительно реже) в биоптате слизистой оболочки тонкой кишки при синдроме водянистой диареи. Используют микроскопию приготовленных препаратов, окрашенных по Граму. В большинстве случаев данный метод окраски не позволяет выявить ооцисты, вследствие их слабой способности удерживать краситель и невозможности отличить их от дрожжеподобных грибов. Поэтому применяют окраску на кислотоустойчивость. При таком методе окраски ооцисты криптоспоридий окрашиваются в красный или розовый цвет и хорошо видны на сине-фиолетовом фоне, в который окрашиваются другие микроорганизмы и содержимое кишечника.
При остром криптоспоридиозе количество ооцист в фекалиях велико, что позволяет легко их обнаружить при микроскопии окрашенных препаратов. Однако при хроническом криптоспоридиозе с лёгким течением, когда количество ооцист в кале мало, для повышения вероятности их обнаружения необходимо использовать методики обогащения. В последние годы для диагностики криптоспоридиоза стали часто использовать серологические методы.
Криптоспоридиоз желчевыводящих путей может проявляться холециститом, значительно реже гепатитом (с повышением концентрации билирубина, активности АСТ, АЛТ, щелочной фосфатазы в крови) и склеро-зирующим холангитом. Для диагностики билиарного криптоспоридиоза исследуют биоптаты печени и жёлчь, где можно обнаружить криптоспоридии в различных стадиях развития.
Определение в крови антител к паразитам
Паразитов, поразивших человека, не всегда можно обнаружить при помощи соскоба или анализа кала, так как они паразитируют не только в органах ЖКТ. Именно поэтому специалисты часто настаивают, чтобы пациенты с подозрительной симптоматикой сдавали кровь на антитела к паразитам.
Выделяют следующие факторы необходимости исследования крови на антитела к паразитам:
- Плановое обследование людей, проживающих в районах с высоким риском заражения;
- Подозрение на возможное наличие в организме гельминтов;
- Проведение общих эпидемиологических исследований в регионе;
- Имеющийся в анамнезе пациента высокий уровень лейкоцитоза;
- Медкомиссия для лиц, имеющих возможность заражения глистами по роду своей деятельности – работников мясокомбинатов и скотоводческих ферм.
Высокое содержание АТ к антигенам паразитов в крови бывает возможно и в случае недавно перенесённой инвазии или протекающего в настоящее время. Полученные результаты анализа интерпретируются следующим образом:
- Положительный результат анализа на антитела к гельминтам и простейшим указывает на то, что в организме имеются паразиты. Но он может оказаться и ложным в случае наличия в анамнезе пациента таких заболеваний, как цирроз печени, туберкулёз или онкология, сопровождаемых поражениями внутренних органов;
- Отрицательный результат анализа крови, выявляющего антитела к антигенам глистов, говорит о том, что их не обнаружено. Но он не исключает только что произошедшего инфицирования, так как АТ к ним вырабатываются спустя 2 недели после заражения.
Существуют такие глистные инвазии, при которых обнаружить яйца паразитов в кале практически невозможно. При них единственным способом диагностики является выявление специфических антител к антигенам паразитов. При помощи этого исследования можно определить наличие 4-х инвазий: трихинеллёз, токсокароз, эхинококкоз и описторхоза .
Для того чтобы полученный результат был максимально достоверным, к нему следует правильно подготовиться:
- Перед исследованием не рекомендуется употреблять пищу, так как оно должно проводиться натощак. Единственное, что можно, это пить простую воду;
- Физические нагрузки перед анализом крови на антитела к гельминтам также следует исключить;
- За сутки до диагностики запрещается употреблять алкогольные напитки и есть жирную, копчёную или солёную пищу.
По возможности за неделю до проведения анализа следует отменить приём любых лекарственных препаратов. В том случае, когда такой возможности нет, необходимо обязательно сообщить врачу – диагносту об употребляемых медикаментозных средствах. Если этого не сделать, кровь на антитела к антигенам паразитов покажет недостоверные результаты.
Источник