- РЕЦЕПТЫ ПИТАТЕЛЬНЫХ РАСТВОРОВ
- Старый, и хорошо себя зарекомендовавший раствор.
- Рецепт N 1 (по Герикке).
- Рецепт N 2 (по Эллису).
- Рецепт N 3
- Рецепт N 4.
- Рецепт N 5.
- Рецепт N 6.
- Рецепт №1 (по Кнопу)
- Рецепт №2 (по Эллису)
- Рецепт №3 (по Герикке)
- Рецепт №4 (летний)
- Рецепт №4 (зимний)
- Рецепты питательных растворов, приготовленных из готовых смесей.
- Как приготовить раствор альсевера
- Количественное определение ферментов в эритроцитах
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ РАСТВОРОВ
Рецепты питательных растворов, приготовляемых самостоятельно.
Старый, и хорошо себя зарекомендовавший раствор.
В раствор Кнопа входят (на 1л):
кальциевая селитра (нитрат кальция) Са(NО3)2 . 1 г
фосфат калия однозамещенный КH2РO4 . 0,25 г
сульфат магния MgSO4 . 0,25 г
хлорид калия (калийная соль) КСl . 0,125 г
хлорид железа FеСl3 . . 0,0125 г.
Каждое вещество нужно растворить отдельно в небольшом объеме воды. Затем налейте в мерный сосуд приблизительно 700-800 мл воды, добавьте первый раствор, хорошо размешайте, долейте второй, размешайте и т.д., пока все вещества не окажутся в мерном сосуде. Только после этого долейте воду до общего объема 1 л. В хорошо приготовленном растворе не должен образовываться осадок. Нельзя растворять все вещества вместе или, смешав концентрированные растворы, доливать воду до литра, поскольку это вызовет появление осадка солей кальция, и баланс элементов нарушится.
Самый капризный элемент — железо. Чтобы не допустить появления ржавого осадка, можно заменить хлорид железа железным купоросом. Для начала приготовьте концентрированный раствор из 1,5 г железного купороса и 1,7 г лимонной кислоты. (Лимонная кислота снизит риск выпадения ржавого осадка.) Растворите отдельно каждое вещество, а потом смешайте оба раствора, доведя объем до 0,5 л. Для приготовления питательной смеси добавляйте 5 мл этого раствора на 1 л раствора Кнопа вместо хлорида железа.
Рецепт N 1 (по Герикке).
Рецепт N 2 (по Эллису).
Рецепт N 3
Количества (граммы) указаны в расчете на 500 л воды. PH готового раствора доводят серной кислотой до значения 5,3 — 5,7.
Нитрат кальция 434,00
Нитрат калия 213,00
Сульфат магния 189,00
Монокалийфосфат 142,00
Сульфат железа 10,00
Сульфат аммония 5,00
Бура 5,00
Сульфат марганца 2,50
Сульфат цинка 0,02
Сульфат меди 0,02
Рецепт N 4.
Количества (граммы) указаны в расчете на 500 л воды. PH готового раствора доводят серной кислотой до значения 5,3 — 5,7. На каждый литр готового раствора необходимо добавить 1 куб. см раствора микроэлементов Хогланда (состав раствора указан в рецепте N 6).
А. Зимний раствор:
Кальциевая селитра 238
Калийная селитра 166
Суперфосфат 274
Сульфат калия и магния 314
Хлористое железо 8
Б. Летний раствор:
Кальциевая селитра 300
Калийная селитра 150
Сульфат аммония 30
Суперфосфат 340
Сульфат калия и магния 170
Хлористое железо 10
Рецепт N 5.
Количества солей указаны в расчете на 1000 л воды. До pH 5,0 — 6,5 доводить технической серной кислотой.
Нитрат калия 535
Нитрат аммония 50
Фосфорная кислота (техническая) 75
Сульфат магния 85
Сульфат железа 20
сульфат марганца 3,5
На каждый литр раствора необходимо добавить 1 куб. см раствора микро- элементов Хогланда. Раствор очень хорош для выращивания огурцов
Рецепт N 6.
Раствор микроэлементов по Хогланду. Количества указаны в граммах в расчете на 18 л дистиллированной воды.
Хлористый литий 0,5
Сульфат меди 1,0
Борная кислота 11,0
Сульфат алюминия 1,0
Хлористое олово (двухвалентное) 0,5
Йодистый калий 0,5
Сульфат цинка 1,0
Двуокись титана 1,0
Хлористый марганец (двухвалентный) 7,0
Сульфат никеля 1,0
Нитрат кобальта 1,0
Бромистый калий 0,5
Приготавливая питательные растворы по рецептам 4 и 5, необходимо на каждый литр этих готовых растворов добавлять по 1 куб. см раствора микроэлементов Хогланда, а на каждый литр готовых растворов, приготовленных по рецептам 1 и 2, весьма целесообразно добавить по 0,5 куб. см раствора Хогланда.
Ниже приведены рецепты тех же растворов, количества солей указаны для более «любительских» количеств – на 10 литров воды.
Рецепт №1 (по Кнопу)
Рецепт №2 (по Эллису)
Рецепт №3 (по Герикке)
Рецепт №4 (летний)
Рецепт №4 (зимний)
Кальциевая селитра — 0,47
Калийная селитра — 0,33
Суперфосфат — 0,55
Сульфат калия и магния — 0,63
Железо хлористое — 0,016
Хлористый литий — 0,28
Сульфат меди — 0,55
Борная кислота — 6,1
Сульфат цинка — 0,55
Хлористый марганец двухвалентный — 3,89
Йодистый калий — 0,28
Бромистый калий — 0,28
Сульфат алюминия — 0,55
Сульфат никеля — 0,55
Нитрат кобальта — 0,55
Двуокись титана — 0,55
Хлористое олово — 0,28
Т.е. если вам необходимо приготовить 5л питательного раствора, а на растворение отдельных солей вы использовали 0,5л воды, то при смешивании нужно добавить 4,5л чистой воды. Безусловно, отвешивать доли грамма, не имея в своем распоряжении аптекарских весов, практически невозможно. Обычные хозяйственные весы дают слишком большую погрешность и их использовать в столь тонком деле нельзя. Поэтому имеет смысл растворить большее количество солей, требующихся в очень малых количествах, в меньшем объеме воды. Например, если требуется 0,2 г сульфата железа на 10 л воды, то нужно растворить 2 г в 1 л воды, получая 0,5%-ный раствор. Из него остается отмерить точной мензуркой 100 см3, содержащие 0,2 г сульфата железа.
Выходом также может быть заготовление впрок концентрированного питательного раствора. Для этого отвешивают количество солей, необходимое для получения большего количества раствора с таким расчетом, чтобы на 1л воды в нем приходилось 1,5-2,5г солей. Отвешенные соли растворяют в 0,5-1л воды и сливают в бутылку. Когда понадобится сменить раствор, его приготавливают из имеющегося концентрата, учитывая использованное для него количество воды.
Рецепты питательных растворов, приготовленных из готовых смесей.
1. Для приготовления одного литра раствора вам потребуется две составляющие (для дозировки хорошо подходит 5-мл шприц, продающийся в каждой аптеке):1,67мл комплексного удобрения «Унифлор Бутон» или «Унифлор Рост» (в зависимости от вида культуры — «Бутон» больше для плодоношения и цветения, а «Рост» — для роста зеленых частей растений) в литре воды. Удобрения «Унифлор» производятся в Петербурге. Добавьте туда 2 мл 25% раствора кальциевой селитры (для приготовления раствора разведите 250 г четырехводной кальциевой (а не калиевой!) селитры в 1 л воды). Это количество КС приводится для мягкой (типа Питерской или дистиллированной воды). Конечное количество кальция при таком разведении — примерно 100 мг/л. В случае же жесткой воды, рекомендуется узнать (у местных водоканальцев или санэпидемиологов), концентрацию кальция на литр воды и добавлять соответствующее количество КС
2. Особенно удобны так называемые — ионообменные удобрения. В обычной водопроводной воде помимо других веществ содержится также незначительное количество кальция (Са) и хлора (Сl). Так как эти частицы имеют электрический заряд, их называют ионами. Ионообменные удобрения (Lewatit) состоят из маленьких шариков синтетической смолы, содержащих ионы минеральных веществ.
Когда удобрение попадает в питательный раствор, ионы минеральных веществ вытесняются ионами воды и становятся доступны для растения. Для использования ионообменных удобрений лучше всего подходит жесткая вода, так как в ней присутствуют ионы, подходящие для обмена.
Важное преимущество этого вида удобрений заключается в том, что минеральные ионы минеральных веществ поступают в питательный раствор постепенно. Порции удобрений хватает на 4-6 месяцев, и избытка минеральных веществ при правильной дозировке практически не возникает.
Вы можете использовать частички синтетической смолы в виде порошка или таблеток. При достаточно большом объеме внешнего горшка можно поместить Lewatit в так называемую питательную батарею, которая просто кладется на дно наружного сосуда в заранее приготовленный лоток. Поначалу возникали проблемы при использовании Lewatitya с мягкой водой. В такой воде содержится недостаточно ионов кальция, необходимых для обмена. Вследствие этого в питательный раствор поступает слишком мало минеральных веществ. Однако с появлением Lewatitya HD 5 плюс, появились ионообменные удобрения, которые можно использовать с водой любой степени жесткости, то есть, и с мягкой тоже.
Источник
Как приготовить раствор альсевера
Исследование ферментов улучшилось в связи с развитием физико-химической методологии и ее применения в клиническом исследовании.
В настоящее время располагаем значительным числом способов, различной чувствительности, требующих более или менее сложные технические условия для их проведения. Они способствуют определению наличия ферментов в эритроцитах, оценке активности и выявлению типа и структурной разновидности значительного числа таких протеин.
Активность фермента определяется измерением, в определенный интервал времени, колебаний концентрации субстрата, на который он воздействует. Активность выражается международной единицей. По определению международная ферментативная единица соответствует той активности, которая вызывает преобразование 1 микромоля специфического субстрата, за 1 минуту при стандартных условиях показателя водорода, температуры, концентрации субстрата и кофакторов. Активность относится к концентрации гемоглобина (в %).
Большинство методов определения ферментов в эритроцитах основываются на колебаниях оптической плотности пиридиновых нуклеотидов (НАДФ и восстановлен. НАДФ), наблюдаемой при 340 нм и вызванной воздействием фермента на субстрат. При этих реакциях НАДФ и восстановлен. НАДФ представляют собой акцептор/донор ионов водорода, подвергающихся процессу окисления/восстановления.
Помимо методов прямого определения концентрации ферментов можно проводить и тесты отбора, точность которых достаточно хорошая. Существуют также косвенные тесты исследования способности эритроцитов реагировать на усиленные запросы.
Метаболизм эритроцитов — последствия энзимопатий, недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) 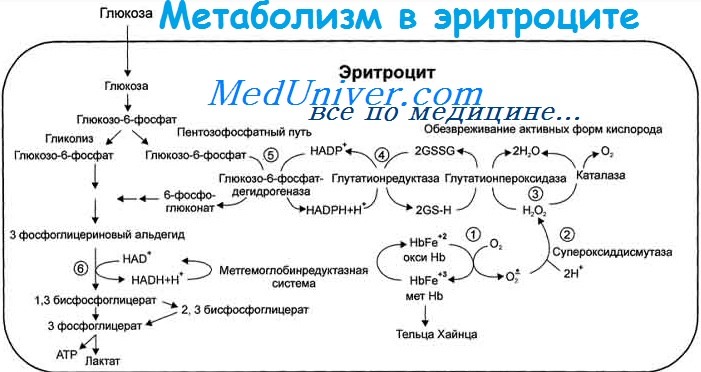
Количественное определение ферментов в эритроцитах
Принцип количественного определения ферментов в эритроцитах. В буфере, с соответствующим исследуемой области показателем водорода приготовить смесь реагентов, в состав которой входит достаточно большое количество специфического субстрата, коферменты и ионы магния. Добавить гемолизат, приготовленный в стандартных условиях, в котором содержится исследуемый фермент. Концентрация последнего непосредственно определяет пропорцию окисляемого или восстанавливаемого кофермента (пиридин-нуклеотид). Колебание оптической плотности смеси, при длине волны 340 нм, способствует исчислению количества фермента в объеме использованного гемолизата.
Приготовление гемолизата для количественного определения ферментов в эритроцитах. Отобрать кровь на противосвертываю-щем веществе (ЭДТА, ЛКЦД, гепарин, раствор Альсевера). Сохранять при температуре 4 С. Большинство эритроцитных ферментов устойчивы несколько дней, когда отбор и хранение проводятся правильно. Тем не менее рекомендуется обрабатывать пробы в день их отбора. Отделять эритроциты от плазмы и лейкоцитов центрифугированием на холоде. Надосадочная масса и buffy-coat отсасываются. Массу эритроцитов промывать холодным физиологическим раствором. Расплавление крови вызвано добавлением 19 объемов гемолизирующего раствора к 1 объему эритроцитов (см. список реагентов). Взболтать, процентрифугировать на холоде (10 мин. при 5000 об.). Определить концентрацию гемоглобина в гемолизате.
Реагенты количественного определения ферментов в эритроцитах:
1) Буфер трис-HCl, рН 8,0. Отвесить 12,1 г. трис и растворить в примерно 80 мл дистилированной воды. Добавить концентрированную HCl, покапельно, до достижения рН 8,0. До 100 мл добавить дистилированной воды. Хранить при 4°С.
2) Раствор 0,1 М MgCl2. Растовить 2,0 г MgCl2 в 100 мл дистилированной воды. Раствор весьма устойчив. Хранить на холоде.
3) Раствор глюкозо-6-фосфат (субстрат). Отвесить 21,7 мг двунатриевой соли Г-6-Ф-3Н20, растворить в 10 мл дистилированной воды. Получим раствор 6 мМ Г-6-Ф, долго устойчивый при условии хранения на холоде.
4) Раствор НАДФ. (TPN) (кофермент). Отвесить 1,7 мг однонатриевой четырехводной соли НАДФ, расворить в 1 мл дистилированной воды; получим раствор 2 мМ, устойчивый при температуре 4°С.
5) 1 М раствор КС1. Отвесить 7,5 г КС1 и растворить в 100 мл дистилированной воды. Раствор весьма устойчив на холоде.
6) 2 мМ раствор НАДвосст. Растворить примерно 2 мг восстановленного НАД в 1 мл дистилированной воды. Раствор должен быть свеже приготовленным.
7) Раствор лактикодегидрогеназы. Имеющийся в торговле раствор разбавить с таким расчетом, чтобы концентрация полученного раствора равнялась 60 единицам на 1 мл. Рабочий раствор приготовлять ежедневно. Устойчив 8 часов при температуре 4°С.
8) Раствор фосфоэнолпирувата. Отвесить достаточное количество фосфоэнолпирувата для приготовления 0,015 М раствора. Развести в соответствующем объеме воды и привести к водородному показателю 7—8, используя для этого 0,2 М раствор NaOH. Раствор очень устойчив, когда сохраняется путем свертывания.
9) 4 мМ раствор АДФ с водородным показателем 7. В случае использования чистого вещества необходимы 17 мг на 10 мл раствора. При температуре 4°С раствор устойчив несколько месяцев.
10) Гемолизирующий раствор. 0,5 мл бетамеркаптозтанола довести до 1 л дистилированной воды, вместе с 10 мл 0,27 М нейтрализованного ЭДТА и 5 мл из 2 мМ раствора НАДФ. Смесь устойчива неделю при температуре 4°С.
В принципе рекомендуется использование баков вместимостью 1 мл, при этом отмечаем, что указываемые ниже объемы для количественного определения Г-6-ПД и ПК расчитаны на подобные баки. При использовании баков другой вместимости умножить объемы отмеченных реагентов на фактор 2 или 3.
В целях определения концентрации Г-6-ПД в эритроцитах приготовить смесь из следующих ингредиентов (объемы даны в микролитрах): 100 раствора трис-НС1; 100 раствора MgCl2; 100 раствора НАДФ; 580 дистилированной воды; 20 гемолизата и 100 Г-6-фосфата (соблюдать указанный порядок). Длительность реакции 10 минут (между первым и вторым прочетом с помощью спектрофотометра, при длине волны 340 нм).
Для определения концентрации ПК в эритроцитах перемешать следующие ингредиенты (объемы даны в микролитрах): 100 раствора трис-НС1; 100 раствора KG; 100 раствора MgCl2; 100 раствора восст. НАД; 100 раствора АДФ: 280 дистилированной воды; 20 гемолизата; 100 лактикодегидрогеназы; 100 PEP. Прочет результата реакции проводить также при 340 нм в течение произвольно установленного времени — 10 мин. В отличие от Г-6-ПД оптическая плотность смеси для определения ПК уменьшается по мере того, как восстан. НАД подвергается процессу окисления.
Исчисление результатов, нормальные значения ферментов в эритроцитах. Формула, по которой определяется концентрация описанных выше ферментов в эритроцитах (Г-6-ПД и ПК) для отражения в международных единицах, следующая: МЕд/ Гб = ΔОП х 105 / (6 х 22 х Гб х Об),
где: ΔОП колебание оптической плотности смеси за одну минуту; 6,22 коэффициент миллимолярного гашения восстан. НАД или НАДФ; Гб отражает концентрацию гемоглобина в гемолизате, выраженную в г %; Об представляет собой объем гемолизата, добавленного к 1 мл реактивной системы, выраженного в микролитрах.
Нормальная концентрация Г-6-ПД в эритроцитах равняется 6,63 ± 1,10 MEд на г. гемоглобина. В ретикулоцитах содержится большее количество Г-6-ПД, по сравнению со зрелыми эритроцитами в норме и во всех случаях завышенных значений при ретикулоцитозе необходимо провести повторное определение концентрации ферментов. При наличии гипохромной анемии значения Г-6-ПД также могут оказаться завышенными, поскольку относятся к меньшей концентрации гемоглобина. В зрелых эритроцитах нормальная концентрация ПК равняется 5,38 ± 1,67 МЕд/ г. гемоглобина.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник