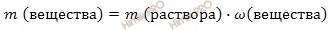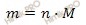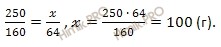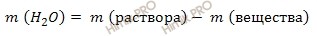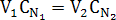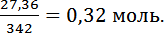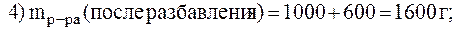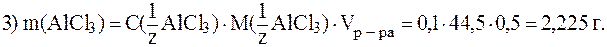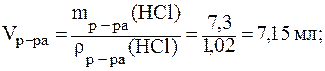Химик.ПРО – решение задач по химии бесплатно
Вычислить массу медного купороса (CuSO4 ∙ 5H2O) и воды (H2O), необходимых для приготовления 640 грамм раствора с массовой долей сульфата меди (II) (CuSO4) 10%.
Найдем, какая масса сульфата меди (II) содержится в 640 г 10-процентного раствора по формуле:
Если раствор 10-процентный, то массовая доля сульфата меди (II) (CuSO4) в нем 0,1.
m (CuSO4) = 640 ∙ 0,1 = 64 (г).
Рассчитаем молярные массы сульфата меди (II) (CuSO4) и медного купороса (CuSO4 ∙ 5H2O):
M (CuSO4 ∙ 5H2O) = 160 + 5 ∙ 18 = 250 (г/моль).
Учитывая, что в 1 моль медного купороса (CuSO4 ∙ 5H2O) содержится 1 моль сульфата меди (II) (CuSO4)и что молярные массы медного купороса (CuSO4 ∙ 5H2O) и сульфата меди (II) (CuSO4) соответственно равны 250 и 160 г/моль, вычислим массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
Найдем, какое количество (в г) кристаллогидрата (медного купороса (CuSO4 ∙ 5H2O)) содержит 64 г сульфата меди (II) (CuSO4). Составим пропорцию:
в 250 г CuSO4 ∙ 5H2O содержится 160 г
в 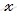
Таким образом, масса медного купороса (CuSO4 ∙ 5H2O), которую необходимо взять для приготовления заданного раствора, равна 100 г.
Вычислим массу воды, которую нужно взять для приготовления заданного раствора, по формуле:
m (H2O) = 640 – 100 = 540 (г).
Ответ: масса медного купороса равна 100 грамм, масса воды равна 540 грамм.
Источник
Решение задач на приготовление растворов с молярной и нормальной концентрацией.
Растворы М и Н концентрации готовятся в мерных колбах.
Задача 4. Приготовьте 250 мл 0,5 М раствора CuSO4 из безводного CuSO4
| Дано: Cм(CuSO4) = 0,5 М V (CuSO4) = 0,25 л |
| Найти: m (CuSO4)=? |
Согласно формуле n=m/M, находим массу CuSO4
m (CuSO4)= n· M=0,125 моль ·160 г/моль=20 г Ответ: Для того, что бы приготовить 250 мл CuSO4 из безводного, нужно взвесить на аналитических весах 20 г CuSO4, перенести в мерную колбу
объемом 250 мл и довести объем водой до метки.
Задача 5. Как приготовить 25 мл 0,1М раствора ZnSO4 из 5М раствора ZnSO4?
Из следствия из закона эквивалентов следует, что при разведении растворов изменения объемов обратно пропорционально изменению концентраций и V1∙М1 = V2∙М2 , где V1∙М1-количество вещества в исходном растворе, а V2∙М2 – после разбавления.
Определяем объем исходного раствора:
V1∙5 М = 25 мл∙0,1 М отсюда V1 = 0,5 мл.
Ответ: Для приготовления 25 мл 0,1М раствора ZnSO4 из 5М необходимо отмерить в мерную колбу на 25 мл из бюретки 0,5мл 5М раствора ZnSO4 и довести объем водой до метки колбы.
Примечание: бесцветные растворы отмечают по нижнему мениску, а окрашенные по верхнему.
Задача 6. Как приготовить 200мл 0,2н раствора CuSO4 из СuSO4·5H2O? Дано:
Vраствора (CuSO4) = 200мл
1) Определяем количество моль эквивалентов СuSO4·5H2O. В растворе.
СN= 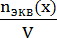
3). Находим массу СuSO4·5H2O, необходимую для приготовления
Для приготовления 200 мл 0,2N раствора CuSO4 необходимо взвесить на аналитических весах 5 г СuSO4·5H2O , перенести навеску в мерную колбу на 200 мл и довести объем водой до метки.
Задача 7. Приготовьте 50 мл 0,025 N раствора NaOH разбавлением 1 N раствора NaOH.
Определяем объем исходного 1N раствора NaOH по формуле
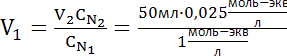
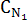 (NaOH)=1 N
(NaOH)=1 N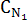 (NaOH)=0,025 N
(NaOH)=0,025 NОтвет: Для того, что бы приготовить 50 мл 0,025N раствор NaOH из 1N, нужно с помощью пипетки отобрать 1,3 мл 1N раствора NaOH, перенести в мерную колбу объемом 50 мл и довести до метки водой.
Задача 8. Определите эквивалентную концентрацию раствора сульфата алюминия (нормальность раствора), если 250 мл раствора содержит 27,36 г соли.
1. Определим массу соли, содержащейся в 1 литре раствора нитрата калия. m(KNO3) = 27,36 · 4 = 109,44 г.
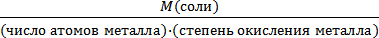
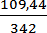
3. Определяем число моль-эквивалентов, содержащихся в 27,36 г сульфата алюминия:
nэкв(Al2(SO4)3) = 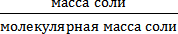
4. Концентрация раствора сэкв (Al2(SO4)3 = 0,32 моль/л или это 0,32 N. Ответ: Концентрация раствора Al2(SO4)3 0,32N
Вычислите массу глюкозы, необходимую для приготовления 0,2 моляльного раствора, содержащего 300 г воды.
Молярная масса глюкозы составляет 180 г/моль. Следовательно, растворив 180 г глюкозы в 1000 г воды, мы получили бы одномолярный раствор. Для приготовления 0,2 моляльного раствора, содержащего 300 г воды потребуется взять глюкозы :
m (глюкозы) = 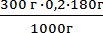
на 1000 г воды в 0,2 молярном растворе приходится (0,2∙ 180) г глюкозы, на 300 г воды в 0,2 молярном растворе приходится (х) г глюкозы
Х = m(глюкозы) = 10,8 г.
Ответ: Для приготовления 0,2 моляльного раствора необходимо 10,8г глюкозы растворить в 300 мл воды.
Задача 10. Рассчитайте мольную долю йода в растворе, содержащем 20 г йода в 500 г ССl4.
1. Определим число молей каждого компонента:
Na = 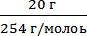
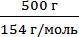
2. Находим мольную долю йода в растворе:
N(I2) = 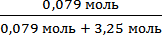
Мольная доля ССl4 равна : 1-0,024 = 0,976. Ответ: Мольная доля йода в растворе равна 0,024.
Источник
Эталоны решения задач
1. Вычислить массовую долю NaCl, если 20 г NaCl растворено в 180 г Н2О.
| Дано: m(NaCl) = 20 г m(Н2O) = 180 г | Решение. 1)   |
| w(NaCl) — ? |
2. Вычислить массу воды, которую необходимо добавить к 200 г раствора NaCl с w(NaCl) = 2%, чтобы получить раствор с w(NaCl) = 0,9%.
Дано:  = 200 г w(NaCl) = 2% w¢(NaCl) = 0,9% = 200 г w(NaCl) = 2% w¢(NaCl) = 0,9% | Решение. 1) в исходном растворе:  |
| m(Н20) — ? |
3. 500 мл раствора HNO3 с r = 1,2 г/мл с w(HNO3) = 32% разбавили 1 л Н2О. Найти массовую долю HNO3 вполученном растворе.
Дано: 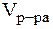 = 500 мл w(HNO3) = 32% = 0,32 = 500 мл w(HNO3) = 32% = 0,32  = 1,2 г/мл V(Н2O) = 1л = 1000 мл = 1,2 г/мл V(Н2O) = 1л = 1000 мл | Решение. 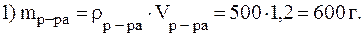  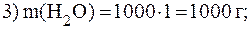 |
| w¢(HNO3) — ? |
4. Из 10,6 г Na2CO3 приготовили 500 мл раствора. Вычислить молярную концентрацию C(Na2CO3).
Дано: m(Na2CO3) = 10,6 г 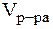 = 500 мл = 0,5 л = 500 мл = 0,5 л | Решение. 1) Mr(Na2CO3) = 23×2 + 12 + 16×3 = 106; 2) M(Na2CO3) = 106 г/моль; |
| C(Na2CO3) — ? |
5. Имеется 200 мл раствора H2SO4 с C(H2SO4) = 0,3 моль/л. Найти m(H2SO4) в растворе.
Дано: 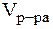 = 200 мл = 0,2 л C(H2SO4) = 0,3 моль/л = 200 мл = 0,2 л C(H2SO4) = 0,3 моль/л | Решение. 1) M(H2SO4) = 98 г/моль; 2) m(H2SO4) = C(H2SO4)×M(H2SO4)× 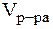 = = 0,3×98×0,2 = 5,88 г. = = 0,3×98×0,2 = 5,88 г. |
| m(H2SO4) — ? |
6. Приготовить 200 мл раствора NaHCO3 с C(NaHCO3) = 0,1 моль/л.
Пояснение: чтобы приготовить раствор, необходимо рассчитать массу содержащегося в нем растворенного вещества.
Дано: 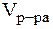 = 200 мл = 0,2 л C(NaHCO3) = 0,1 моль/л = 200 мл = 0,2 л C(NaHCO3) = 0,1 моль/л |
| m(NaHCO3) — ? |
1) по аналогии с предыдущей задачей:
m(NaHCO3) = с(NaHCO3)·M(NaHCO3)× 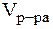
2) техника приготовления раствора:
а) взвесить на весах 1,68 г сухого NaHCO3.
б) через воронку перенести сухое вещество в мерную колбу вместимостью 200 мл.
в) добавить до метки на горлышке колбы дистиллированную воду.
7. В 200 мл раствора содержится 4,9 г H2SO4. Рассчитать C( 
Дано: 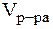 = 200 мл = 0,2 л m(H2SO4) = 4,9 г = 200 мл = 0,2 л m(H2SO4) = 4,9 г | Решение. 1) найдем фактор эквивалентности H2SO4: a) число обменивающихся ионов H + = 2; б) заряд +1  2) 2)  |
C(  H2SO4) — ? H2SO4) — ? |
8. Приготовить 500 мл раствора А1С13 с C( 
Дано: 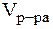 = 500 мл = 0,5 л с( = 500 мл = 0,5 л с(  AlCl3) = 0,1 моль/л AlCl3) = 0,1 моль/л | Решение. 1) найдем фактор эквивалентности AlCl3: a) число ионов Al 3+ = 1; б) заряд +3  2) 2)  |
| m(AlCl3) — ? |
4) приготовление раствора аналогично задаче №6.
9. Приготовить 250 мл раствора H2SO4 с C(H2SO4) = 0,1 моль/л из раствора H2SO4 с w(H2SO4) = 10%. 
Дано: 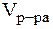 = 250 мл = 0,25 л = 250 мл = 0,25 л  = 1,056 г/моль C(H2SO4) = 0,1 моль/л w(H2SO4) = 10% = 0,1 = 1,056 г/моль C(H2SO4) = 0,1 моль/л w(H2SO4) = 10% = 0,1 | Решение. 1) найдем массу H2SO4 в приготовляемом растворе: m(H2SO4) = C(H2SO4)·M(H2SO4)· 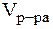 = 0,1·98·0,25 = 2,45 г; = 0,1·98·0,25 = 2,45 г; |
 (H2SO4) — ? (H2SO4) — ? |
2) найдем массу 10% раствора H2SO4, который содержит 2,45 г кислоты:
3) найдем 
4) приготовление раствора:
а) отмерить мерным цилиндром 23,2 мл 10% р-ра H2SO4;
б) перенести его в мерную колбу вместимостью 250 мл;
в) добавить до метки дистиллированную воду.
10. Приготовить 100 мл раствора НС1 с C( 
Дано: 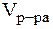 (HCl) = 100 мл = 0,1 л c( (HCl) = 100 мл = 0,1 л c(  HCl) = 0,1 моль/л HCl) = 0,1 моль/л 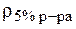 (HCl) = 1,02 г/мл w(HCl) = 5% = 0,05 (HCl) = 1,02 г/мл w(HCl) = 5% = 0,05 |
 (HCl) — ? (HCl) — ? |
1) для (HCl) z = 1×1 = 1, 
M( 
2) найдем массу HCl в приготовляемом растворе:
m(HCl) = c( 

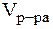
3) найдем массу 5% раствора HCl, который содержит 0,365 г кислоты:
4) найдем 
5) приготовление раствора аналогично предыдущей задаче.
11. c(Al2(SO4)3) = 0,02 моль/л. Найти C( 
| Дано: C(Al2(SO4)3) = 0,02 моль/л | Решение. 1) найдем z для Al2(SO4)3: a) число ионов Al 3+ = 2; б) заряд +3: z = 3·2 = 6 2) так как C(  x) = z·c(x), то: C( x) = z·c(x), то: C(  Al2(SO4)3) = 6·0,02 = 0,12 моль/л. Al2(SO4)3) = 6·0,02 = 0,12 моль/л. |
C(  Al2(SO4)3) — ? Al2(SO4)3) — ? |
12. Приготовить 250 мл раствора CuSO4 с C( 
Дано: 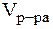 (CuSO4) = 250 мл = 0,25 л C( (CuSO4) = 250 мл = 0,25 л C(  CuSO4) = 0,1 моль/л CuSO4) = 0,1 моль/л |
| m(CuSO4·H2O) — ? |
2) найдем массу безводного CuSO4 в растворе:
m(CuSO4) = C( 

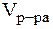
3) найдем массу кристаллогидрата, содержащего 2 г CuSO4:


4) приготовление раствора аналогично предыдущей задаче.
Вопросы для самоконтроля
1. Что такое раствор? Приведите примеры растворов, находящихся в разном агрегатном состоянии.
2. В чем заключается отличие химической теории растворов от физической?
3. Что такое количество вещества?
4. Что называют молярной массой?
5. Что такое химический эквивалент?
6. Что такое фактор эквивалентности?
7. Что называют молярной массой эквивалента?
8. Что такое массовая доля растворенного вещества? Какова ее размерность?
9. Что такое молярная концентрация? Какова ее размерность?
10. Что такое молярная концентрация эквивалента? Какова ее размерность?
11. Что такое моляльная концентрация? Какова ее размерность?
12. Что такое титр раствора? Какова его размерность?
13. Что такое мольная доля? Какова ее размерность?
9. Какими соотношениями связаны между собой выражения концентрации:
а) массовая доля и молярная концентрация;
б) массовая доля и молярная концентрация эквивалента;
в) молярная концентрация и молярная концентрация эквивалента?
Варианты задач для самостоятельного решения
Вариант №1
1. Вычислить массу воды, которую надо добавить к 300 г раствора с w(NaCl) = 5%, чтобы получить раствор с w(NaCl) = 1,5%.
2. Приготовить 200 мл раствора Al2(SO4)3 с C( 
Вариант №2
1. К 500 г раствора NaCl с w(NaCl) = 0,05 добавили 300 г Н2О. Вычислить w(NaС1) в полученном растворе.
2. Приготовить 200 мл раствора CuSO4 с C( 
Вариант №3
1. В 200 мл раствора содержится 10 г H2SO4. Вычислить C(H2SO4) и C( 
2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 25 г CuSO4×5H2O в 200 г Н2О.
Вариант №4
l. w(Na2CO3) = 10%, r = l,05 г/мл. Вычислить C(Na2CO3) и C( 
2. Приготовить 200 мл раствора Na2CO3 с w(Na2CO3) = 0,5% (r » 1 г/мл) из кристаллогидрата Na2CO3×10H2O.
Вариант №5
1. C(H2SO4) = 0,01 моль/л, r = 1 г/мл. Вычислить w(H2SO4) и C( 
2. Приготовить 200 мл раствора FeSO4 с C(FeSO4) = 0,1 моль/л из кристаллогидрата FeSO4×7Н2О.
Вариант №6
1. Вычислить C(Na2SO4) и C( 
2. Приготовить 500 мл раствора CuSO4 с w(CuSO4) = 2% (r » 1 г/мл) из раствора с C(CuSO4) = 2 моль/л.
Вариант №7
1. Приготовить 250 мл раствора NaHCO3 с C( 
2. w(H2SO4) = 3,24%. Вычислить С(H2SO4) и C( 
Вариант №8
2. Рассчитать титр раствора, полученного растворением 4 г КОН в воде в колбе вместимостью 500 мл.
Вариант №9
1. Приготовить 250 мл раствора H2SO4 с C( 
2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 25 г CuSO4×5Н20 в 200 г Н2О.
Вариант №10
1. Приготовить 100 мл раствора NaHCO3 с C(NaHCO3) = 0,l моль/л из раствора с w(NaHCO3) = 2%. r = 1,01 г/мл.
2. Приготовить 200 мл раствора CuSO4 с C( 
Вариант № 11
1. Вычислить массу воды, которую надо добавить к 300 г раствора NaCl с w(NaCl) = 5%, чтобы получить раствор с w(NaCl) = 1,5%.
2. Приготовить 500 мл раствора CuSO4 с w(CuSO4) = 2% (r » 1 г/мл) из раствора с C(CuSO4) = 4 моль/л.
Вариант №12
1. К 500 г раствора NaCl с w(NaCl) = 0,05 добавили 500 г Н2О. Вычислить w(NaCl) в полученном растворе.
2. Приготовить 500 мл раствора NaHCO3 с C( 
Вариант №13
1. В 200 мл раствора содержится 10 г H2SO4. Вычислить C(H2SO4) и с( 
Вариант №14
1. w(Na2CO3) = 5%, r = 1,03 г/мл. Вычислить c(Na2CO3) и с( 
2. Приготовить 200 мл раствора Al2(SO4)3 с с( 
Вариант №15
1. C(H2SO4) = 0,01 моль/л, r = 1 г/мл. Вычислить w(H2SO4) и C( 
2. Приготовить 400 мл раствора Na2CO3 с w(Na2CO3) = 1% (r » 1 г/мл) из кристаллогидрата Na2CO3×10Н2О.
Вариант №16
1. Вычислить C(Na2SO4) и C( 
2. w(H2SO4) = 6,24%. Вычислить C(H2SO4) и C( 
Вариант №17
1. Рассчитать титр раствора, полученного растворением 4 г КОН в воде в колбе вместимостью 500 мл.
2. Приготовить 500 мл раствора FeSO4 c C(FeSO4) = 0,2 моль/л из кристаллогидрата FeSO4×7Н2О.
Вариант №18
1. Приготовить 100 мл раствора NaHCO3 с C(NaHCO3) = 0,05 моль/л из раствора с w(NаНСО3) = 2% и r = 1,01 г/мл.
2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 50 г CuSO4×5Н2О в 400 г Н2О.
Источник