- Как приготовить раствор для микроскопа
- Приготовление влажного препарата для исследования
- Приготовление сухого препарата для исследования
- Подкрашивание препарата для исследования
- Приготовление препарата для микроскопа
- Приготовления препарата «раздавленная капля»
- Приготовление препарата «висячая капля»
- Приготовление препарата «отпечаток»
- Приготовление препарата «отпечаток», иной способ
- Приготовление препарата «фиксированный мазок»
- Примеры микропрепаратов для микроскопа
- Приготовление микроскопических препаратов
- Исследование микроорганизмов в живом виде
- Исследование микроорганизмов в фиксированном и окрашенном виде
- Приготовление красящих растворов
Как приготовить раствор для микроскопа
Благодаря микроскопу человек открыл для себя удивительный мир, о существовании которого ранее и не мог подумать. Ежедневно по всему миру в лабораториях и медицинских центрах, учебных заведениях и на производственных предприятиях к окуляру светового или монитору цифрового микроскопа обращаются сотни тысяч внимательных пар глаз, пытаясь постичь доселе неведомое или еще раз убедиться, что процесс идет в верном направлении. Однако, материалы для исследований бывают разные, в том числе живые, и чтобы можно было с ними работать, следует правильно готовить микропрепараты, которые позволят всесторонне и качественно изучить предмет исследования. Все образцы для микроскопа, жизнь которых протекает на клеточном уровне, можно условно разделить на две основные категории, о которых мы поговорим ниже, также упомянув такой способ приготовления микропрепаратов, как окрашивание.
Приготовление влажного препарата для исследования
В приготовлении влажных препаратов для исследования под микроскопом возникает необходимость, если образец без воды живет непродолжительное время, как это бывает с некоторыми одноклеточными организмами. Для приготовления микропрепарата следует в центр чистого предметного стекла с помощью пипетки поместить одну-две капли дистиллированной воды. После размещения в воде исследуемого образца, его необходимо накрыть сверху покровным стеклом и немного прижать. Производить приготовление микропрепарата можно только в резиновых перчатках. В противном случае, жировые пятная от пальцев рук на стеклах будут мешать наблюдению образца под микроскопом.
Приготовление сухого препарата для исследования
Сухой препарат — это объект исследования, который не нуждается в воде для выживания. Приготовление сухого микропрепарата намного проще, чем влажного. Достаточно поместить как можно тонкий срез препарата в центр предметного стекла и накрыть его сверху покровным стеклом. Если на руках резиновые перчатки, образец для исследования под микроскопом можно немного прижать верхним стеклом.
Подкрашивание препарата для исследования
Встречаются микроорганизмы, исследование которых под микроскопом без предварительного окрашивания невозможно. Самым надежными сегодня способом окрашивания является использование йодида калия или раствор йода — так называемые, растворы Люголя. Для приготовления микропрепарата следует поместить его в воду на предметном стекле, в которую необходимо добавить каплю контрастного вещества. Кроме раствора Люголя можно использовать растворы «кристаллического фиолетового» или «метиленового синего». Иногда бывает, что необходимо окрасить уже готовый микропрепарат. В этом случае следует разместить с одной стороны покровного стекла бумажную салфетку, а с другой — краситель. Салфетка вытянет влагу с одной стороны стекла и затянет под него краситель с другой, окрашивая тем самым исследуемый препарат.
Источник
Приготовление препарата для микроскопа
В этой статье расскажу 3 способа приготовления препаратов для микроскопа. Эти способы — самые простые.
В начале статьи — так называемый словарик, а точнее пояснения, что такое тот или иной предмет.
Для изготовления микропрепаратов требуется специальный инструмент, красители, а также определенная аккуратность и сноровка. Очень важно строгое соблюдение всех необходимых условий – иначе микропрепарат может оказаться непригодным для исследований.
В продаже есть готовые наборы препаратов для исследований (что удобно для дома и школы) — например, 25 препаратов, или 38 слайдов от Левенгук. А также минералы и другие наборы.
Смотрите КАТАЛОГ микроскопов.
пояснения
Фиксированный препарат — в микробиологии часто готовят именно фиксированные препараты, так что следует знать, что это такое. Эти препараты рассматривают под микроскопом именно в окрашенном виде. Под словом «фиксация» имеется ввиду такая обработка живого объекта (который вы собираетесь рассмотреть), которая дает возможность быстро прервать жизненные процессы в том или ином объекте (поясню проще — убить), при этом сохранив тонкую структуру. В результате фиксации клетки прочно прикрепляются к стеклу и лучше прокрашиваются. Фиксация необходима в случае работы с патогенными микроорганизмами (в целях самобезопасности).
Патоген, патогенный микроорганизм — живой организм, паразит, вызывающей патологическое состояние (заболевания) иного живого организма.
Суспензия — смесь каких-либо веществ, где твёрдое вещество распределено в виде мельчайших частиц в жидком веществе в неосевшем состоянии.
Биологическая петля — тонкая металлическая палочка, на конце — тонкая металлическая петля. Используется для захватывания маленького количества той или иной суспензии микроорганизмов.
Вазелин — мазеобразная жидкость без запаха и вкуса. Смесь состоит из минерального масла и твёрдых парафинов (воскоподобная смесь).
Герметизация — обеспечение совершенной непроницаемости для разных газов и жидкостей поверхностей и мест соединения деталей.
Агар-агар — в микробиологии используется для изготовления плотных и полужидких питательных сред, то есть агаризованных сред.
Жидкость Карнуа — жидкость для фиксации.
Горелка — устройство, имеющее инжектор, который установлен в металлической трубке с отверстиями для поступления в эту трубку атмосферного воздуха, которая закреплена на подставке с боковым вводом для подачи в трубку газа, при этом отверстия выполнены на боковой поверхности трубки, на которой для изменения подачи воздуха в горелку, может быть установлена подвижная заслонка, изменяющая площадь проходного сечения этих отверстий.
Смесь Никифорова — смесь равных объемов этилового спирта и безводного серного эфира, применяется для фиксации мазков крови, мазков-отпечатков органов и каких либо тканей.
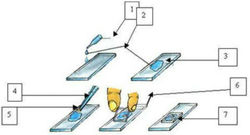
Приготовления препарата «раздавленная капля»
Приготовление препарата «висячая капля»
- Одну каплю суспензии микроорганизмов (заранее приготовленной) с помощью биологической петли аккуратно нанесите на чистое покровное стекло.
- Переверните покровное стекло с каплей суспензии так, чтобы капля свободно висела.
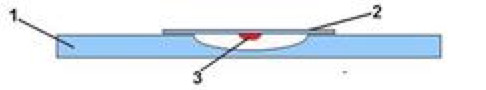
- Поместите перевёрнутое покровное стекло с каплей над лункой специального покровного стекла с углублением в центре.
- Капля не должна касаться краёв стекла и углубления (лунки), она должна свободно висеть на покровном стекле.
- Края углубления специального покровного стекла предварительно смазывают вазелином для герметизации камеры.
- Наслаждайтесь наблюдением за бактериями в микропрепарате!
Приготовление препарата «отпечаток»
Из агаризованной среды, на которой какие-либо микроорганизмы растут абсолютным сплошным газоном или же в виде отдельных колоний, аккуратно вырежете скальпелем не очень большой кубик.
Перенесите его на предметное стекло таким образом, чтобы поверхность кубика с микроорганизмами была обращена именно вверх.
Затем к газону микроорганизмов или к колонии приложите обычное покровное стекло (абсолютно чистое), аккуратно и не сильно, а слегка, надавите на него биологической петлей или пинцетом и тотчас снимите, стараясь не сдвинуть его в сторону.
Полученный препарат (покровное стекло с отпечатком) помещают именно отпечатком вниз в каплю обычной воды на чистое предметное стекло. Отпечаток также можно получить и на предметном стекле, если касаться поверхности колонии предметным стеклом.
Приготовление препарата «отпечаток», иной способ
Из агара в чашке Петри с засеянными на нем бактериями (бактериальным газоном) вырежьте блок.
Возьмите обезжиренное чистое стекло и приложите его к поверхности блока агара, засеянного бактериями. Получился первый отпечаток, Отпечатки делайте до тех пор, пока бактериальный слой на блоке не истощится, располагая их слева направо начиная с левой короткой грани стекла.
Приготовление препарата «фиксированный мазок»
Для того, чтобы приготовить этот препарат, требуется на обезжиренное предметное стекло нанести одну каплю воды.
В неё биологической петлей внесите исследуемый вами материал и распределите его так, чтобы получить тонкий и равномерный мазок диаметром примерно 1-1,5 сантиметра (только при таком распределении материала в мазке можно увидеть изолированные бактериальные клетки).
Если исследуемый материал содержится в жидкой среде, то петлей его непосредственно наносят на предметное стекло и готовят мазок. Мазки высушивают на воздухе или в струе теплого воздуха над пламенем горелки.
Для фиксации мазка предметное стекло (именно мазком вверх) очень аккуратно и медленно проводят 3 раза (в течение всего 3 секунд) через пламя горелки. Микроорганизмы, находящиеся в мазке, при фиксации погибают, плотно прикрепляясь к поверхности предметного стекла, и они не смываются при дальнейшей обработке препарата.
Внимание! Более долгое нагревание может вызвать деформацию структур клеток. Мазки крови, мазки-отпечатки органов и каких-либо тканей и (в некоторых случаях и мазки из культур), фиксируют погружением на 5-20 минут в метиловый синий или этиловый спирт, смесь Никифорова, также сулемовый спирт или иные фиксирующие жидкости.
Примеры микропрепаратов для микроскопа
Перечень микропрепаратов набора на 25 слайдов от WSBD World:
Loose Connective Tissue Рыхлая волокнистая соединительная ткань
Spinal Cord c.s. Поперечный срез спинного мозга
Motor Nerve Ending Нервные клеточные окончания (нейроны)
Stomach Mammal Sec. Срез ткани желудка млекопитающего
Kidney c.s. Поперечный срез почки
Artery & Vein c.s. Поперечный срез вены и артерии
Blood Vessel of Lung Срез кровеносного сосуда легкого
Blood Vessel of kidney Срез кровеносного сосуда почки
Tase Bud Вкусовой рецептор
Mouth Smear Мазок со слизистой полости рта
Human Sperm Smear Мазок человеческой спермы
Mitosis of Animal Cell Митоз клетки животного
Hydra thru Testis c.s. Семенник гидры
Hydra thru Ovary c.s. Яичник гидры
Hydra with Bud Гидра с отростком
Fern Prothalium wm Заросток папоротника
Zea Mays Seed l.s. Срез семян кукурузы
Spirogyra Спирогира
Lung Mammal Легкое млекопитающего
Colon Mammal Толстая кишка млекопитающего
Trachea Mammal Трахея млекопитающего
Pancreas Mammal Поджелудочная железа млекопитающего
Uterus Mammal Матка млекопитающего
Spleen Mammal Селезенка млекопитающего
Onion Root Tips Корневые кончики лука
Содержимое другого набора (38 штук) — Levenhuk N38 NG набор готовых микропрепаратов:
Ботаника и зоология:
Кожица лука
Зерновка ржи
Корневой чехлик
Ветка липы
Пыльник
Завязь
Камелия
Эпидермис листа герани
Конечность пчелы
Крыло пчелы
Циклоп
Вольвокс
Эвглена
Инфузория-туфелька
Дождевой червь (поперечный срез)
Ротовой аппарат комара
Аскарида
Дафнии
Биология и физиология:
Мутация дрозофилы (бескрылая форма)
Мутация дрозофилы (черное тело)
Дрозофила «норма»
Животная клетка
Растительная клетка
Плесень мукор
Дробление яйцеклетки
Митоз в корешке лука
Поперечно-полосатые мышцы
Сперматазоиды млекопитающего
Нерв (поперечный срез)
Рыхлая соединительная ткань
Яйцеклетка млекопитающего
Нервные клетки
Гиалиновый хрящ
Гладкие мышцы
Костная ткань
Кровь лягушки
Кровь человека
Однослойный эпителий
Источник
Приготовление микроскопических препаратов
Для изучения микроорганизмов производят микроскопирование как живых, так и убитых микробов в неокрашенном и окрашенном виде. Микроскопический препарат готовят на предметном стекле — пластинке из тонкого стекла (76х26 мм) с хорошо отшлифованными краями. Предметные стекла, употребляемые при микробиологическом исследовании, должны быть кристально чисты и абсолютно обезжирены. На поверхности обезжиренного стекла вода легко расплывается и не образует капель шаровидной формы.
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 мин, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде. Стекла, бывшие в употреблении, необходимо обработать раствором серной кислоты в течение 2 ч, хорошо промыть в воде и прокипятить 10 мин в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тряпочкой.
В лаборатории всегда следует иметь запас готовых для работы стекол. Хранить предметные стекла лучше всего в банке с притертой пробкой, погруженными в смесь спирта с эфиром, взятых в равных объемах. Из банки предметные стекла достают пинцетом. Покровные стекла — вырезанные квадратом или прямоугольником тонкие стеклышки (толщиной 0,15-0,17 мм) размерами 18х18 мм, 20х20 мм, 18х24 мм.
Исследование микроорганизмов в живом виде
Микроорганизмы можно микроскопировать как в живом, так и в мертвом (фиксированном) состоянии на специально приготовленных препаратах. Плесневые грибы и дрожжи лучше рассматривать в живом виде в препарате «раздавленная» капля. Клетки этих микроорганизмов относительно крупные, и обычно при микроскопировании в живом виде хорошо выявляются их форма, размеры, некоторые детали внутреннего строения, а также характер размножения (почкование, деление, спорообразование и т.д.).
Бактерии ввиду их малых размеров чаще рассматривают в мертвом виде на фиксированных окрашенных препаратах. При этом получается более ясное представление о форме и размерах клеток, о способности их к спорообразованию. В живом виде в «раздавленной» капле бактерии рассматривают в том случае, когда выясняют их способность к движению.
Препарат «раздавленная» капля. На обезжиренное предметное стекло прокаленной петлей наносят каплю стерильной воды, в которую той же петлей вносят небольшое количество исследуемой культуры микроорганизма (дрожжей или бактерий), взятой с твердой питательной среды. Из жидкой среды культуру берут вместе с каплей жидкости, а при надобности добавляют каплю стерильной воды. Суспензия культуры микробов на стекле должна давать лишь слабую муть. При микроскопировании дрожжей в каплю жидкости на стекле добавляют петлей небольшое количество метиленовой сини (до голубого окрашивания) и всю эту смесь тщательно размешивают. Прижизненная окраска дрожжей метиленовой синью применяется для того, чтобы выявить мертвые клетки, легко окрашивающиеся в синий цвет. Живые клетки остаются неокрашенными, так как не пропускают краску через свою оболочку.
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми м окрашены в синий цвет.
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. На поверхность покровного стекла наносится капля иммерсионного масла, и препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X. При этом обязательно следует регулировать освещение с помощью диафрагмы для получения более четкого изображения рассматриваемых деталей.
При приготовлении препаратов в раздавленной капле нужно помнить следующее:
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимают кусочком фильтровальной бумаги.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если пузырьков много, препарат следует приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают немедленно (особенно живых бактерий), так как в противном случае вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки.
После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 сек, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
Исследование микроорганизмов в фиксированном и окрашенном виде
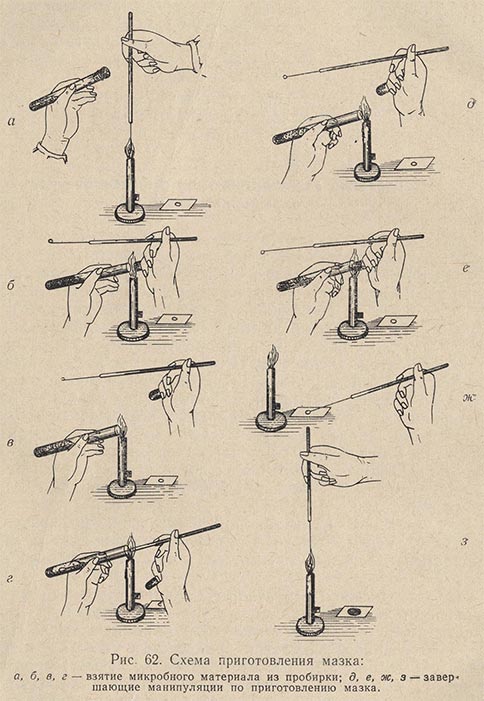
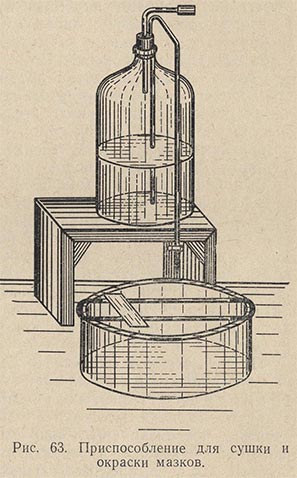
Приготовление мазка. На чистое обезжиренное предметное стекло платиновой петлей наносят материал (рис. 62). Если он жидкий, то каплю, взятую петлей, непосредственно равномерно распределяют по поверхности предметного стекла тонким слоем на площади примерно в 1 см2. Если же изучается агаровая культура, то на предметное стекло предварительно наносят каплю стерильной воды, в которой тонким слоем распределяется исследуемая культура. Получается так называемый мазок. Все манипуляции по приготовлению мазка необходимо выполнять с соблюдением правил асептики (над пламенем горелки стерилизуют петли, концы сосудов с исследуемым материалом, ватные пробки и пр.). Сделав мазок, его сушат при комнатной температуре, поместив на специальный сушильный столик (рис. 63). Хороший мазок после сушки должен давать едва заметный налет. Препарат с густым мазком для наблюдения малопригоден.
Для ускорения высыхания можно осторожно подсушить мазок над пламенем горелки. Предметное стекло в этом случае над пламенем горелки держат так, чтобы мазок был обращен вверх.
Фиксация мазка. Предметное стекло с высушенным мазком, обращенным вверх от пламени горелки, проводят 3-4 раза на границе между светлой и темной частью пламени. Цель фиксации — убить микробные клетки, прикрепить их к стеклу и облегчить окрашивание. Мертвые клетки гораздо лучше воспринимают краску, чем живые. Препарат в общей сложности не должен находиться в пламени более 2 сек. Излишнего нагревания мазков нужно избегать, так как при этом сильно изменяется структура клеток, мазок будет плохо окрашиваться. При недостаточной же фиксации мазка его можно смыть при последующей окраске. Практически достаточность нагревания определяют прикладывая предметное стекло к руке. При этом должен чувствоваться легкий ожог.
Окраска мазков. В лабораторной практике пользуются простыми и сложными методами окраски микробов. Сложные, или дифференциальные, способы окраски, как уже указывалось, применяются для детального изучения структуры клеток. При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленовой сини, разведенного фуксина и пр.). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок. Раствор краски в среднем выдерживают на мазке 2-3 мин (в зависимости от вида краски). Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 мин. Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 мин. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма. Раствор генцианвиолета держат для окраски 3-5 мин.
По истечении указанного срока краску сливают с предметного стекла. Если на мазок помещалась фильтровальная бумага, ее нужно осторожно снять пинцетом и затем промыть мазок легкой струей дистиллированной воды (можно и водопроводной). Струю воды следует направлять на ребро предметного стекла, а не на мазок. Промытый препарат высушивают на воздухе при комнатной температуре или с помощью полосок фильтровальной бумаги.
На сухой мазок наносят каплю кедрового масла. Не следует кедровое масло наносить на влажный (а тем более на мокрый) мазок. При этом возникает эмульсия воды в кедровом масле и четкость изображения в микроскопе резко снижается.
Сущность сложных методов окраски заключается в том, что препарат окрашивают не одной, а двумя и большим количеством контрастных красок. В микробиологической практике сложный метод окраски микробов по Граму имеет весьма важное значение при дифференциации микробов.
Техника окраски микробов методом Грама состоит в следующем. На фиксированный мазок кладут полоску фильтровальной бумаги и наливают карболовый раствор генцианвиолета на 1-2 мин. Затем краску сливают. Сняв бумажку и не промывая препарат водой, наносят на мазок раствор Люголя также на 1-2 мин (мазок чернеет). По истечении указанного времени раствор Люголя сливают с предметного стекла и погружают стекло в стаканчик со спиртом для обесцвечивания. Предметное стекло слегка покачивают в спирте, выдерживая 30-60 сек. Быстро промывают мазок водой и дополнительно окрашивают разведенным фуксином в течение 1-2 мин. Фуксин сливают, препарат промывают водой, высушивают и микроскопируют.
Выполнить окраску микробов по Граму можно, пользуясь модификацией этого метода, предложенной Синевым. Вместо раствора карболового генцианвиолета используют фильтровальную бумагу, пропитанную этим раствором и высушенную. На фиксированный мазок накладывают полоску такой бумаги, наносят несколько капель стерильной воды, так чтобы бумажка оказалась смоченной, и окрашивают препарат в течение 2 мин. Затем бумажку снимают, на препарат наливают раствор Люголя и далее поступают так же, как указано выше при окраске по Граму.
По отношению к окраске по Граму все бактерии разделяют на две группы: грамположительные (грампозитивные) и грамотрицательные (грамнегативные). Первые в результате окраски остаются окрашенными в фиолетовый цвет; вторые — обесцвечиваются спиртом и при дополнительном окрашивании фуксином приобретают красный цвет. Объясняется это тем, что у грамположительных бактерий в цитоплазме клеток содержатся специфические белки и магниевая соль рибонуклеиновой кислоты, которые с генцианвиолетом и йодом образуют комплекс фиолетового цвета, не разрушающийся под действием спирта. У грамотрицательных бактерий магниевая соль рибонуклеиновой кислоты в клетках отсутствует, и такого комплекса при окраске генцианвиолетом и йодом в цитоплазме не образуется. Генцианвиолет и йод в дальнейшем легко обесцвечиваются спиртом.
Приготовление красящих растворов
При бактериологическом исследовании для окраски микробов применяются основные анилиновые краски. Чаще всего употребляются: основной фуксин (красная краска), метиленовая синь (синяя краска), генцианвиолет, кристаллвиолет, метилвиолет (фиолетовые краски). Эти краски продаются в виде аморфных или кристаллических порошков, из которых готовят красящие растворы.
Исходным материалом для приготовления необходимых рабочих красок являются насыщенные спиртовые растворы указанных красителей. Спиртовые растворы готовят впрок и сохраняют в склянках с притертыми пробками. Сами по себе спиртовые растворы для окраски микробов не применяются.
Насыщенный спиртовой раствор красителя получают растворением 1 г его в 10 мл 96%-ного этилового спирта (этанола). Краска обычно полностью не растворяется, и на дне флакона остается небольшой осадок. Полученный спиртовой раствор настаивают 3-5 дней, ежедневно взбалтывая.
Рабочий водно-спиртовой раствор краски получают смешивая 1 мл насыщенного спиртового раствора с 10 мл дистиллированной воды. Для повышения красящей способности в качестве протравы к водно-спиртовым растворам красок добавляют карболовую кислоту.
Рецепты приготовления наиболее употребительных красок.
Карболовый фуксин Циля. 10 мл насыщенного спиртового раствора основного фуксина смешивают со 100 мл 5%-ной карболовой кислоты. Можно приготовить красящий раствор и непосредственно из сухого красителя. Для этого 1 г основного фуксина растирают в ступке с 5 г кристаллической карболовой кислоты. Для лучшего растирания рекомендуется добавить несколько капель глицерина. Затем понемногу приливают 10 мл 96%-ного спирта. К равномерно растертой массе постепенно приливают 100 мл дистиллированной воды, перемешивают и оставляют на 1-2 суток. Затем фильтруют через бумажный фильтр. Фуксин Циля стоек и может сохраняться очень долго. Его употребляют для окраски спор и кислотоустойчивых бактерий, трудно воспринимающих краску.
Фуксин Пфейфера (разведенный фуксин). 1 мл карболового фуксина Циля смешивают с 9 мл дистиллированной воды. Раствор нестоек, поэтому его приготовляют непосредственно перед окраской препаратов. Используют для простой окраски мазков и дополнительной окраски их по методу Грама.
Карболовый генцианвиолет. 10 мл насыщенного спиртового раствора генцианвиолета смешивают со 100 мл 5%-ной карболовой кислоты или 1 г генцианвиолета растирают в ступке с 5 г кристаллической карболовой кислоты, постепенно добавляют 10 мл 96%-ного спирта и 100 мл дистиллированной воды.
Щелочная метиленовая синь (по Лефлеру). К 100 мл дистиллированной воды прибавляют 30 мл насыщенного спиртового раствора краски и 1 мл 1%-ного раствора едкого кали (КОН). Раствор фильтруют. Краска очень прочная, причем красящая способность старой краски выше, чем свежеприготовленной.
Водный раствор метиленовой сини. 1 г метиленовой сини растворяют в 100 мл дистиллированной воды.
Раствор Люголя. 2 г йодистого калия растворяют в 5 мл дистиллированной воды, прибавив 1 г кристаллического йода. Объем доводят водой до 300 мл. Раствор Люголя должен иметь слабощелочную или нейтральную реакцию. При кислой реакции его нейтрализуют (по лакмусу) двууглекислой содой. Раствор следует хранить в склянках из темного стекла, предохраняя от действия света.
Приготовление пропитанной генцианвиолетом фильтровальной бумаги для окраски микробов по Граму в модификации Синева. Раствор карболового генцианвиолета помещают на сутки в термостат при 37 °С, затем фильтруют через бумажный фильтр. Фильтрат выливают в тарелку и погружают в него нарезанную полосками фильтровальную бумагу на 1-2 мин. Пропитанная краской бумага подсушивается, нарезается кусочками (2х4 см) и сохраняется в темных склянках с притертой пробкой. Срок хранения неограниченный.
Примечание. Свежеприготовленные карболовые растворы красок имеют на поверхности пленку с металлическим блеском. Эти растворы стойкие и сохраняются довольно долго. Однако при слишком длительном хранении они могут стать непригодными; в этом случае металлический блеск на поверхности их пропадает, а на дне образуется мелкий порошкообразный осадок.
Источник