Опыт 1. Приготовление ЭДТА



В качестве титранта в методе комплексонометрического титрования применяют стандартный раствор ЭДТА. Раствор готовят из двунатриевой соли ЭДТУ (ЭДТА, трилон Б, комплексон III), кристаллизующейся с двумя молекулами воды. Ее состав отвечает формуле Na2C10H14N2×2H2O. Молекулярная масса этого соединения составляет 372,242 у. е. Применение натриевой соли этилендиаминтетрауксусной кислоты для приготовления стандартного раствора обусловлено ее лучшей растворимостью в воде по сравнению с кислотой. Так, при 22 о С растворимость ЭДТА составляет 10,8 г на 100 г воды, а ЭДТУ только 0,2 г на 100 г воды.
Для выполнения лабораторных работ готовят 500 мл 0,025 М раствора ЭДТА. Навеска, необходимая для приготовления указанного объема стандартного раствора ЭДТА, составляет:
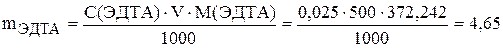
Выполнение работы.
1. Навеску ЭДТА 4 – 5 г взвешивают в бюксе на технических весах, переносят в колбу вместимостью 500 мл и доводят до метки дистиллированной водой.
2. Бюкс после перенесения навески взвешивают на технических весах и по разности двух взвешиваний находят массу навески ЭДТА. Раствор в колбе тщательно перемешивают, растворение ЭДТА происходит медленно.
Источник
ПРАКТИЧЕСКИЕ РАБОТЫ. Работа 1. Приготовление и стандартизация раствора ЭДТА
Работа 1. Приготовление и стандартизация раствора ЭДТА
Цинк металлический (х.ч.) или MgSO4·7H2O (х.ч.).
Аммиачный буферный раствор (рН 9–10).
Серная кислота H2SO4, 2 н. раствор.
Металлоиндикатор: кислотный хромовый темно-синий.
1. Приготовление раствора ЭДТА. Навеску (приблизительную) для приготовления 250 мл 0,05 М (0,1 н.) раствора ЭДТА рассчитывают по формуле
где m – масса ЭДТА, г; С – молярная концентрация эквивалента, моль/л; M – молярная масса эквивалента, г/моль; V – требуемый объем, л.
Навеску взвешивают на технохимических весах, переносят в мерную колбу, растворяют в небольшом количестве воды и доводят объем водой до метки (вода должна выдержать пробу на отсутствие комплексообразующих металлов, перемешивают и переливают в склянку.
2. Приготовление раствора стандартного вещества – металлического цинка. Точную навеску (взятую на аналитических весах) металлического цинка (х.ч.) для приготовления 250 мл 0,05 М раствора растворяют в 10 мл 2 н. раствора H2SO4 в мерной колбе вместимостью 250 мл, доводят водой до метки, тщательно перемешивают и переливают в склянку. Рассчитывают молярную концентрацию эквивалента этого раствора С = m/M·V, где m – навеска х.ч. металлического цинка, г; M – молярная масса эквивалента, г/моль;V – объем, л.
Вместо металлического цинка в качестве стандартного вещества можно использовать MgSO4·7H2O.
3. Приготовление 0,1 н. (0,05 М) раствора стандартного вещества – сульфата магния.
Из точной навески MgSO4·7H2O готовят раствор в мерной колбе вместимостью 100,0 мл. Рассчитывают концентрацию как в п. 2.
4. Стандартизация раствора ЭДТА. В колбу для титрования помещают 15,00 мл приготовленного раствора цинка или сульфата магния, добавляют 5 мл аммиачного буферного раствора, 50 мл воды, около 0,03 г индикатора кислотного хром темно-синего и титруют раствором ЭДТА до перехода красной окраски в сине-фиолетовую. Титрование повторяют 2–3 раза и берут среднее значение объема. Рассчитывают молярную концентрацию эквивалента ЭДТА: СА · VA = CB ·VВ,
где СА и СВ – молярные концентрации эквивалента растворов ЭДТА и стандартного соответственно, VА и VВ – их объемы.
Работа 2. Определение цинка
Ионы цинка образуют с ЭДТА бесцветный комплекс состава ZnY 2 – c константой устойчивости 3,27·10 16 .
Сульфат ZnSO4 или нитрат цинка Zn(NO3)2, 2,5 н. раствор.
Металлоиндикатор эриохром черный Т, 1%-я твердая смесь с твердым хлоридом натрия.
Аммиачный буферный раствор (рН 9-10).
Отбирают пипеткой 5,00 мл раствора нитрата или сульфата цинка, переносят в мерную колбу на 500 мл, разбавляют дистиллированной водой до метки и перемешивают. Отбирают пипеткой 10,00 мл этого раствора, переносят в колбу для титрования, прибавляют около 10 мл аммиачной буферной смеси (отмеряют с помощью мерного цилиндра), добавляют 0,1 г смеси твердого индикатора с хлоридом натрия и перемешивают до получения отчетливой вишневой окраски. Титруют стандартным раствором ЭДТА до перехода вишневой окраски индикатора в синюю от одной капли избытка титранта. Титрование повторяют 2–3 раза и вычисляют среднее значение объема. По результатам титрования находят молярную концентрацию эквивалента раствора по ионам цинка, титр раствора по цинку и массу цинка в г по формулам
где СА и VA молярная концентрация эквивалента и объем раствора цинка;
CB и VВ тоже для раствора ЭДТА; ТА – титр раствора по цинку; МА – молярная масса эквивалента цинка; mA – масса цинка, содержащаяся в объеме V колбы, из которой отбирали аликвотную часть.
Работа 3. Определение меди
Ионы меди образуют с ЭДТА комплексы голубого цвета с константой устойчивости 6,3·10 18 . В присутствии мурексида, образующего комплекс с медью зеленовато-желтого цвета, титрование можно вести при комнатной температуре при рН 6 (условная константа устойчивости комплексоната меди при рН 6 равна 1,4·10 14 ).
ЭДТА, 0,0500 М стандартный раствор.
Металлоиндикатор мурексид (смесь с твердым хлоридом натрия в соотношении 1:100).
Ацетатный буферный раствор с рН 6.
Анализируемый раствор разбавляют водой до метки в мерной колбе вместимостью 100,0 мл (раствор должен содержать 0,1–0,2 г меди). После перемешивания отбирают пипеткой 10,00 мл раствора в коническую колбу емкостью 100,0 мл, прибавляют 20 мл дистиллированной воды, 5 мл буферного раствора, на кончике шпателя 20–30 мл индикаторной смеси, перемешивают и титруют раствором ЭДТА до изменения окраски в чисто-фиолетовую. Замечают объем ЭДТА и вводят 1–2 мл ацетатного буферного раствора (или 1 каплю 2 М раствора NH3). Если цвет раствора остается фиолетовым, титрование прекращают, а если от добавления буферного раствора окраска изменилась в желтую или желто-зеленую, продолжают титрование раствором ЭДТА до устойчивой фиолетовой окраски. Расчеты проводят также как в работе 2.
Работа 4. Определение кальция и магния при их совместном присутствии
Константы устойчивости комплексов кальция и магния с ЭДТА различаются на 2 порядка (логарифмы констант устойчивости равны 10,7 и 8,7 для кальция и магния соответственно). Поэтому эти ионы нельзя оттитровать раздельно, используя только различие в константах устойчивости комплексонатов. При рН
10 в качестве металлоиндикатора используют эриохром черный Т. При этих условиях определяют сумму кальция и магния. В другой аликвотной части создают рН > 12, вводя NaOH, при этом магний осаждается в виде гидроксида, его не отфильтровывают, и в растворе определяют комплексонометрически кальций в присутствии мурексида, флуорексона или кальциона, являющихся металлоиндикаторами на кальций. Магний определяют по разности.
Метод пригоден для определения жесткости воды. Следы тяжелых металлов титруются совместно с кальцием и магнием; поэтому их маскируют перед титрованием цианидом калия или осаждают сульфидом натрия либо диэтилдитиокарбаминатом натрия. Практически все ионы, присутствующие в воде, можно замаскировать цианидом калия и триэтаноламином; не маскируются щелочные металлы, кальций и магний.
1,0 мл 0,0100 М раствора ЭДТА эквивалентен содержанию 0,408 мг Са; 0,561 мг СаО; 0,243 мг Mg; 0,403 мг MgO.
ЭДТА, 0,0500 М стандартный раствор.
Аммиачный буферный раствор с рН 10 (67 с NH4Cl и 570 мл 25 %-го NH3 в 1 л раствора).
NaOH или КОН, 2 М растворы.
Металлоиндикаторы: эриохром черный Т; мурексид, флуорексон; кальцион (смеси с хлоридом натрия в соотношении 1:100).
1. Определение суммы кальция и магния. Отбирают пипеткой 10,00 мл анализируемого раствора (его можно приготовить, взяв навеску смеси солей кальция и магния на аналитических весах, перенеся ее в мерную колбу вместимостью 100 мл, растворив, доведя до метки водой и тщательно перемешав) из мерной колбы (100 мл) в коническую колбу для титрования вместимостью 100 мл, прибавляют 2–3 мл буферного раствора с рН 10 и 15 мл воды, перемешивают, прибавляют на кончике шпателя 20–30 мг смеси эриохром черного Т и хлорида натрия. Перемешивают до полного растворения индикаторной смеси и титруют раствором ЭДТА до изменения окраски раствора из винно-красной в голубую.
2. Определение кальция. Отбирают пипеткой 10,00 мл анализируемого раствора в коническую колбу вместимостью 100 мл, прибавляют 2–3 мл раствора NaOH или КОН, разбавляют водой примерно до 25 мл, вводят 20–30 мг индикаторной смеси мурексида, флуорексона или кальциона с хлоридом натрия и титруют раствором ЭДТА до изменения окраски раствора от одной капли ЭДТА.
Изменение окраски в конечной точке титрования зависит от выбранного индикатора. При использовании мурексида окраска изменяется из розовой в фиолетовую; при использовании флуорексона – из желтой с зеленой флуоресценцией в бесцветную или розовую с резким уменьшением интенсивности флуоресценции; при использовании кальциона – из бледно-желтой в оранжевую. В последнем случае щелочную среду создают только 2 М раствором КОН.
3. Определение магния. Объем титранта, израсходованный на титрование магния, вычисляют по разности объемов ЭДТА, пошедших на титрование при рН 10 и рН 12.
Вопросы и задачи
1. Какие методы титрования относят к комплексометрическим?
2. Какие соединения получили название «комплексоны»? Почему наиболее часто применяют комплексон III (ЭДТА)?
3. Напишите в общем виде реакцию взаимодействия ЭДТА с катионом определяемого металла.
4. Катионы каких металлов можно определять комплексонометрически?
5. Как можно определить точку эквивалентности в методе комплексонометрического титрования?
6. Как в комплексонометрии учитывается влияние рН?
7. Перечислите наиболее часто применяемые металлохромные индикаторы. Каков механизм их действия?
8. Каковы особенности комплексонометрического титрования по замещению и по остатку?
9. Как приготовить стандартный раствор комплексона III?
10. Какие вещества используют для стандартизации раствора комплексона III?
11. Для чего к исследуемому раствору добавляют аммиачную буферную смесь?
12. На чем основано определение кальция и магния при совместном присутствии?
13. Как определяют жесткость воды комплексонометрически?
14. Чему равна жесткость воды, если на титрование 20,00 мл ее израсходовано 2,30 мл 0,1 н. раствора ЭДТА? Ответ: 11,5 ммоль/л.
15. Вычислите процентное содержание СаСО3 и MgCO3 в известняке, если после растворения 1,0000 г пробы и соответствующей обработки объем раствора довели водой до 100,0 мл и на титрование 20,00 мл его для определение суммы Са 2+ и Mg 2+ затратили 19,25 мл 0,0510 М раствора комплексона III, а на титрование Mg 2+ израсходовали 6,26 мл того же раствора.
16. Какую навеску силиката, содержащего около 20 % Al2O3, следует взять для анализа, чтобы после сплавления и соответствующей обработки пробы Al был отделен и оттитрован 10,00 мл 0,1 М раствора ЭДТА? Ответ: 0,26 г.
17. Чему равно процентное содержание Mn в медном сплаве, если после растворения 0,2062 г пробы и маскировки мешающих элементов Mn оттитрован 15,42 мл 0,0500 М раствора ЭДТА? Ответ: 16,32 %.
18. Навеску соли магния 0,2000 г растворили в мерной колбе емкостью 100 мл. На титрование 20,00 этого раствора израсходовали 20,25 мл 0,02500 М раствора ЭДТА. Вычислить процентное содержание магния в соли.
Источник
1. Приготовление и стандартизация 0,05 м эдта
Для приготовления стандартного раствора в комплексонометрическом титровании используется дигидрат динатриевой соли этилендиаминтетрауксусной кислоты (Na2H2Y2H2O). При необходимости он может быть получен в чистом виде высушиванием в течение нескольких дней при 80 С и относительной влажности 50% и использоваться в качестве первичного стандартного вещества. Однако чаще стандартные растворы ЭДТА являются вторичными. Для их стандартизации применяют металлический цинк, висмут и другие вещества.
Приготовление и стандартизацию раствора ЭДТА проводят по следующей методике. Молярная масса Na2H2Y2H2O равна 372,24 г/моль. Для приготовления 150 мл 0,05 М ЭДТА необходимо взять m = 372,240,050,15 2,8 г этого вещества. Навеску Na2H2Y2H2O помещают в стакан, прибавляют 150 мл воды и перемешивают до полного растворения. В 3 колбы для титрования помещают по 10,00 мл 0,05000 М MgSO4, добавляют в каждую колбу по 10 мл аммиачного буферного раствора, около 0,1 г индикаторной смеси эриохрома чёрного Т и титруют приготовленным раствором ЭДТА до перехода фиолетовой окраски в ярко-синюю (без фиолетового оттенка).
Расчёт молярной концентрации ЭДТА в стандартизируемом растворе проводят по следующей формуле:
где С(MgSO4) = 0,05000 моль/л, V(MgSO4) = 10,00 мл
2. Комплексонометрическое определение сульфата цинка
Определение проводят по следующей методике. Полученную задачу количественно переносят в мерную колбу вместимостью 100,0 мл, доводят водой до метки и перемешивают. В 3 колбы для титрования отмеривают по 10,00 мл приготовленного раствора, прибавляют в каждую колбу по 10 мл аммиачного буферного раствора, 0,1 г индикаторной смеси эриохрома чёрного Т и титруют приготовленным раствором ЭДТА до синего окрашивания.
Массу ZnSO4 в полученной задаче рассчитывают по следующей формуле
где M(ZnSO4) = 161,45 г/моль, Vк = 100,0 мл, Vп = 10,00 мл.
Титр 0,05000 М ЭДТА по ZnSO4 равен 0,05000161,4510 -3 = 8,07310 -3 г/мл. При его использовании и с учётом значений объёмов колбы и пипетки приведенная выше формула будет иметь следующий вид
где k — поправочный коэффициент для раствора ЭДТА.
3. Комплексонометрическое определение хлорида кальция
Комплексонометрическое титрование солей кальция можно проводить в щелочной среде и без использования аммиачного буферного раствора, так как, для ионов Ca 2+ не нужен вспомогательный комплексообразующий реагент, препятствующий выпадению гидроксида металла. Кроме того, ионы Ca 2+ не образуют устойчивых аммиачных комплексов.
Определение проводят по следующей методике. Полученную задачу количественно переносят в мерную колбу вместимостью 100,0 мл, доводят водой до метки и перемешивают. В 3 колбы для титрования отмеривают по 10,00 мл приготовленного раствора, добавляют в каждую колбу по 2-3 гранулы KOH (или NaOH), 0,1 г индикаторной смеси мурексида и титруют приготовленным раствором ЭДТА до перехода окраски из красной в фиолетовую.
Массу СaCl2 в полученной задаче рассчитывают по следующей формуле
где M(СaCl2) = 110,984 г/моль, Vк = 100,0 мл, Vп = 10,00 мл.
Титр 0,05000 М ЭДТА по СaCl2 равен 0,05000110,98410 -3 = 5,54910 -3 г/мл. При его использовании и с учётом значений объёмов колбы и пипетки приведенная выше формула будет иметь следующий вид:
Источник






