- Гидроксид аммония
- Получение гидроксида аммония
- Применение гидроксида аммония
- Вред гидроксида аммония
- Гидроксид аммония (Е527)
- Получение добавки
- Характеристика
- Применение гидроксида аммония
- Вред аммониевой воды
- Хранение
- Структура гидроксида аммония, свойства, номенклатура, применение
- Химическая структура
- Аммиачный лед
Гидроксид аммония

Получение гидроксида аммония
Гидроксид аммония представляет собой водный раствор аммиака. Раствор прозрачный, с резким и едким запахом. Промышленным способом и в больших количествах получение гидроксида аммония возможно растворением в воде продуктов сжигания каменного угля.
Применение гидроксида аммония
Как пищевая добавка гидроксид аммония имеет обозначение Е527 и разрешен на территории России и Украины. Его добавляют в конфеты из карамели, какао-продукты и некоторые виды шоколада. В этих продуктахгидроксид аммония поддерживает необходимое по рецептуре значение кислотности, играя роль буфера. Дело в том, что какао-бобы содержат до 2% кислот в своем составе, которые при добавлении гидроксида аммония в состав продукта нейтрализуются.
Кроме пищевой промышленности, растворы гидроксида аммония широко используются в медицине, в домашнем обиходе. 10% раствор этого вещества более известен как нашатырный спирт или аммиачная вода. При вдыхании его происходит стимуляция дыхательного центра, что применяют при потере сознания, обмороках и когда необходимо вызвать рвоту. Наружно благодаря своим антисептическим и охлаждающим свойствам гидроксид аммония подходит для обработки рук, царапин и ссадин, укусов насекомых.

Вред гидроксида аммония
Гидроксид аммония добавляется в пищевые продукты согласно технологическим инструкциям и рекомендациям, часто в комбинации с другими гидроксидами. Норма содержания этого вещества в шоколаде и какао не должна превышать 70 г/кг сухого вещества.
В ряде стран (Новая Зеландия, Австралия, некоторые европейские страны) гидроксид аммония запрещен в качестве пищевой добавки. Имеются сведения, по которым это вещество способно негативно отражаться на здоровье человека, вызывая токсические поражения печени и кишечника.
Вред гидроксида аммония заключается в том, что это довольно нестабильное вещество легко превращается в аммиак и воду. Аммиак раздражающе действует на слизистую оболочку пищеварительного тракта. Четких норм суточного потребления гидроксида аммония не разработано.
Источник
Гидроксид аммония (Е527)

Получение добавки
Гидроксид аммония – это соединение чистой воды и аммиака. Раствор прозрачный, обладающий едким и достаточно резким запахом. Если рассматривать промышленное производство добавки, то для этого используют продукты сжигания каменного угля и растворяют их в воде. Процесс производства проходит в несколько этапов: первый этап – дистилляция, второй этап – дефлегмация и завершающий этап – конденсация аммиачной воды.
Характеристика
Формула аммиачной воды – NH4OH. Пищевую добавку Е527 активно используют в производстве пищевого направления в виде эмульгатора. Производители часто используют иные названия добавки – гидроксид аммония или ammonium hydroxide. Раствор полностью бесцветен, но с резким, характерным ацетону, запахом. Добавка великолепно растворяется в воде. Для производства обычно используется синтетического происхождения сырье, в частности аммиачная вода, которая, получается, посредством соединения коксового газа и воды. Основная цель применения данной добавки в пищевой промышленности – это регулирование кислотности. Е527 опасна для организма человека, следовательно, разрешена не во всех мировых странах. На сегодняшний день ее применение разрешено в странах ЕС, России и Украине.
Е527 обладает щелочными свойствами, следовательно, его чистая, неразбавленная форма способна вызывать серьезные химические ожоги. Добавка аллергенная и сильно раздражает не только слизистые, но и кожные покровы. Именно по этой причине в косметике Е527 можно встретить максимум в 6% концентрации. Чаще всего из косметических средств аммиачную воду можно встретить в красках для волос, но ее концентрация не должна превышать 3%. Желательно чтобы в составе красок для волос вообще не было данной синтетической добавки.
Применение гидроксида аммония
В пищевой промышленности аммиачную воду добавляют в некоторые разновидности шоколада, в разные какао-продукты, в карамельные конфеты. В период производства данной продукции добавка играет роль буфера. Стоит отметить, что в какао-бобах содержится 2% кислот, которые в контакте с Е527 полностью нейтрализуются.
Кроме промышленности пищевого направления, аммониевая вода используется в домашнем обиходе и в медицине. 10% раствор многим известен как нашатырный спирт. При его резком вдыхании наблюдается стимулирование работы дыхательного центра. Нашатырный спирт активно используют в период выведения после наркоза, при потере сознания, в период, когда срочно нужно вызвать рвотный рефлекс. Также стоит отметить, что раствор Е527 используют и наружно, так как он обладает великолепными охлаждающими и антисептическими свойствами. Им часто обрабатывают укусы насекомых, мелкие царапины и руки для обеззараживания.

Также стоит отметить, что гидроксид аммония присутствует в составе некоторых удобрений, красок для волос, моющих средств и даже соды.
Гидроксид аммония встречается в красках для волос, а также используется для химического выпрямления или завивки волос. Основная задача Е527 для ухода за волосами – это вызвать набухание и раскрытие каждого волоска, и запустить реакцию распада перекиси водорода. Периодически аммиачную воду в 6% концентрации можно встретить в качестве корректора РН в препаратах по уходу за кожей и в средствах для укладки волос.
Так как добавка несет опасность для организма, стоит обращать внимание на количество ее в продукте. Максимальная норма Е527 – это 50 грамм аммиачной воды на 1 килограмм продукции.
Кроме всего перечисленного, гидроксид аммония встречается в: сельскохозяйственных продуктах (не пестицидных), строительных материалах, очистке и меблировке, электрических и электронных изделиях, взрывчатых материалах, тканевых, текстильных и кожаных изделиях, чернилах, тонерах и красителях, услугах прачечной, посудомоечной машины, продуктах для ухода за газонами и садами, бумажных изделиях, продуктах личной гигиены, продуктах для обработки воды.
Вред аммониевой воды
Гидроксид аммония должен добавляться в продукцию по определенным рекомендациям и техническим инструкциям, очень часто наблюдается комбинация с иными гидроксидными добавками. По установленным нормативам в какао и шоколаде норма Е527 не должна превышать 70 грамм на 1 килограмм. В иных случаях данная норма составляет 50 грамм добавки на 1 килограмм продукта.
В некоторых странах, таких как Австралия и Новая Зеландия, аммониевая вода запрещена для использования в виде пищевой добавки, так как есть сведения о негативном отражении добавки на организме человека. Чаще всего от гидроксида аммония страдает кишечник и печень.
Вред Е527 заключается в его нестабильности и легком разделении на воду и аммиак. Чистый аммиак – это активный раздражитель, который негативно влияет на состояние слизистых пищеварительного тракта. Желательно при выборе продуктов внимательно изучать их состав, и, по возможности, избегать данную пищевую добавку, так как у каждого организм индивидуальный, а потому невозможно точно рассчитать безопасную норму Е527.
Когда вспоминают вредные свойства Ammonium Hydroxide, на первое место выходят: способность вызывания химических ожогов, невероятная токсичность, нестабильность (распад на воду и концентрированный аммиак в чистом виде), способность раздражать дыхательные пути, слизистые и кожу.
Эффекты от воздействия Е527 могут включать в себя чрезмерное раздражение глаз и слизистых оболочек, контактные ожоги кожи и глаз, опасный для жизни легочный отек. При действии и ситуациях, когда возможно чрезмерное воздействие добавки, рекомендуется надевать защитный автономный дыхательный аппарат и защитную одежду (включая полную защиту лица). Если контакт произошел, немедленно промойте пораженную кожу или глаза проточной водой в течение как минимум 15 минут, и удалите загрязненную одежду и обувь на месте. Е527 легко воспламеняется. Пожары, содержащие гидроксид аммония, можно гасить сухим химикатом, CO2, туманом или стандартной пеной.
Хранение
Гидроксид аммония следует хранить в прохладных, хорошо проветриваемых помещениях, в прочных стеклянных, пластиковых или резиновых бутылках вдали от тяжелых металлов, кислот и горючих материалов (например, дерева, бумаги, масла). Для небольших разливов гидроксида аммония сначала выделите область разлива, затем возьмите с собой песок или другой негорючий абсорбент и поместите в контейнер для последующего удаления. Перед тем, как внедрить удаление отходов отработанного гидроксида аммония, проконсультируйтесь с органами регулирования окружающей среды.
Источник
Структура гидроксида аммония, свойства, номенклатура, применение
гидроксид аммония представляет собой соединение NH молекулярной формулы4ОН или Н5НЕ производится растворением газообразного аммиака (NH3в воде. По этой причине он получает названия аммиачной воды или жидкого аммиака.
Это бесцветная жидкость с очень интенсивным и острым запахом, которая не изолирует. Эти характеристики имеют прямую связь с концентрацией NH3 растворяется в воде; концентрация, которая на самом деле, будучи газом, может покрывать его огромное количество, растворенное в небольшом объеме воды.
Значительно небольшая часть этих водных растворов состоит из катионов NH.4 + и ОН-анионы — . С другой стороны, в очень разбавленных растворах или в замороженных твердых веществах при очень низких температурах аммиак можно найти в форме гидратов, таких как: NH3∙ H2О, 2НХ3∙ H2O и NH3H 2H2О.
Любопытно, что облака Юпитера образованы разбавленными растворами гидроксида аммония. Однако космическому зонду Galileo не удалось обнаружить воду в облаках планеты, что можно было бы ожидать из знания того, что известно образование гидроксида аммония; то есть они кристаллы NH4ОН абсолютно безводный.
Ион аммония (NH4 + ) вырабатывается в просвете почечных канальцев путем соединения аммиака и водорода, секретируемых клетками почечных канальцев. Аналогичным образом, аммоний вырабатывается в клетках почечных канальцев в процессе превращения глютамина в глутамат и, в свою очередь, при превращении глутамата в α-кетоглутарат..
Аммиак производится промышленным способом по методу Хабера-Боша, в котором газы азота и водорода вступают в реакцию; с использованием иона трехвалентного железа, оксида алюминия и оксида калия в качестве катализаторов. Реакцию проводят при высоких давлениях (150-300 атмосфер) и высоких температурах (400-500 ºC) с выходом 10-20%..
В реакции образуется аммиак, который при окислении производит нитриты и нитраты. Они необходимы при получении азотной кислоты и удобрений, таких как аммиачная селитра.
- 1 Химическая структура
- 1.1 Аммиачный лед
- 2 Физические и химические свойства
- 2.1 Молекулярная формула
- 2.2 Молекулярный вес
- 2.3 Внешний вид
- 2.4 Концентрация
- 2.5 Запах
- 2.6 Вкус
- 2.7 Пороговое значение
- 2.8 Точка кипения
- 2.9 Растворимость
- 2.10 Растворимость в воде
- 2.11 Плотность
- 2.12 Плотность пара
- 2.13 Давление пара
- 2.14 Коррозионное действие
- 2,15 рН
- 2.16 Константа диссоциации
- 3 Номенклатура
- 4 Растворимость
- 5 рисков
- 5.1 Реакционная способность
- 6 использует
- 6.1 В еду
- 6.2 Терапия
- 6.3 Промышленное и разное
- 6.4 В сельском хозяйстве
- 7 ссылок
Химическая структура
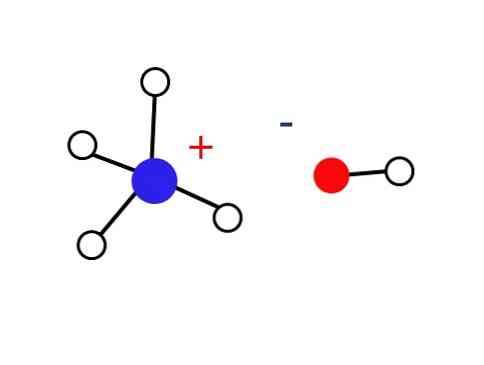
Как указано в его определении, гидроксид аммония состоит из водного раствора газообразного аммиака. Следовательно, внутри жидкости нет определенной структуры, кроме структуры случайного расположения ионов NH.4 + и ОН — сольватированные молекулами воды.
Ионы аммония и гидроксила являются продуктами равновесного гидролиза аммиака, поэтому для этих растворов характерен резкий запах:
Согласно химическому уравнению, высокое снижение концентрации воды приведет к смещению равновесия с образованием большего количества аммиака; то есть при нагревании гидроксида аммония пары аммиака будут выделяться.
По этой причине ионы NH4 + и ОН — им не удается сформировать кристалл в земных условиях, что приводит к тому, что твердое основание NH4ОН не существует.
Это твердое вещество должно состоять только из ионов, взаимодействующих электростатически (как показано на рисунке).
Аммиачный лед
Однако при температурах значительно ниже 0ºC и в окружении огромных давлений, таких как те, что преобладают в ядрах ледяных лун, аммиак и вода замерзают. При этом они кристаллизуются в твердой смеси с различными стехиометрическими пропорциями, являясь самым простым NH3∙ H2O: моногидрат аммиака.
NH3∙ H2O и NH3H 2H2Или это аммиачный лед, потому что твердое тело состоит из кристаллического расположения молекул воды и аммиака, соединенных водородными связями.
Учитывая изменение T и P, согласно вычислительным исследованиям, которые моделируют все физические переменные и их влияние на этот лед, происходит переход фазы NH3∙ нН2Или в фазу NH4Огайо.
Поэтому только в этих экстремальных условиях NH4ОН может существовать как продукт протонирования во льду между NH3 и Н2O:
Обратите внимание, что на этот раз, в отличие от гидролиза аммиака, участвующие виды находятся в твердой фазе. Аммиачный лед, который становится соленым без выделения аммиака.
Источник