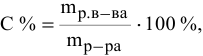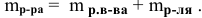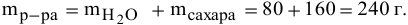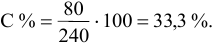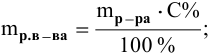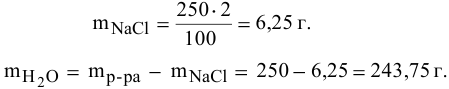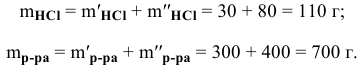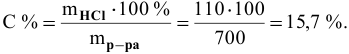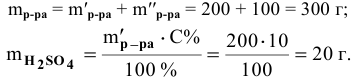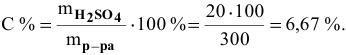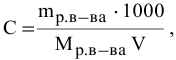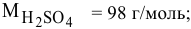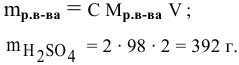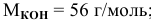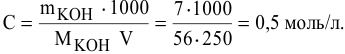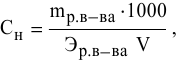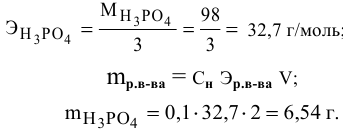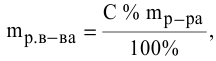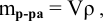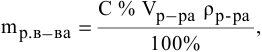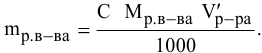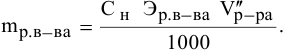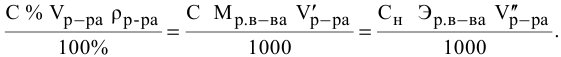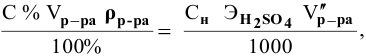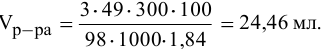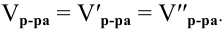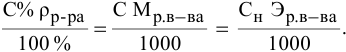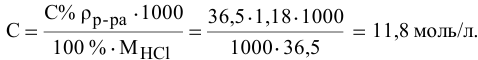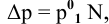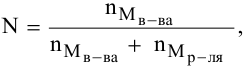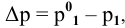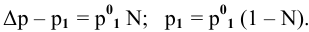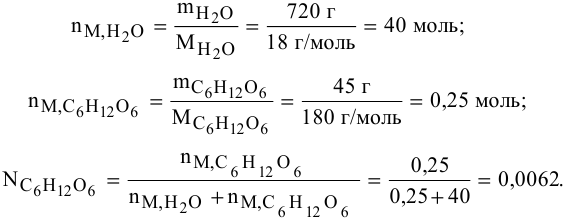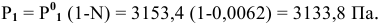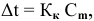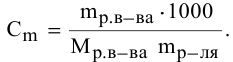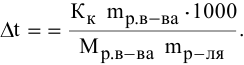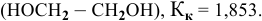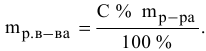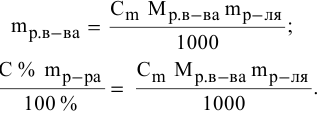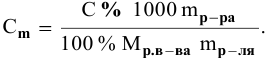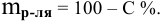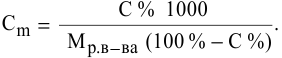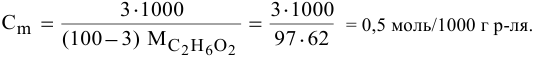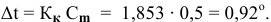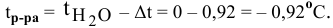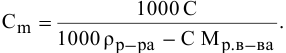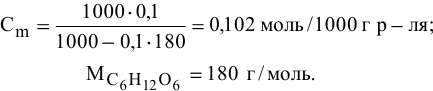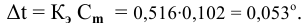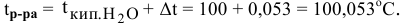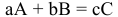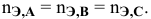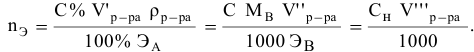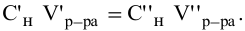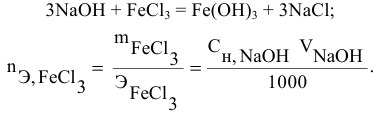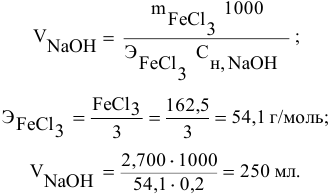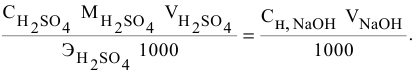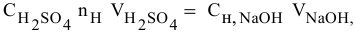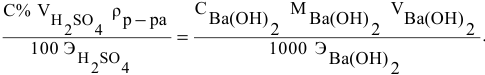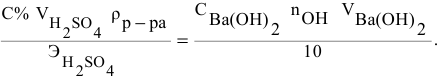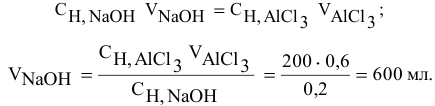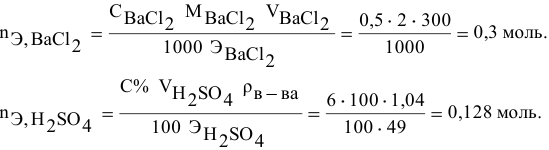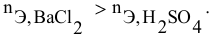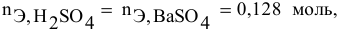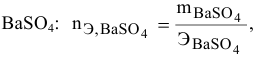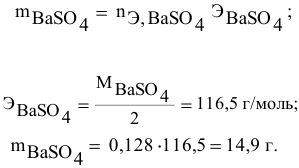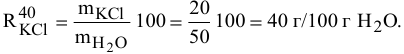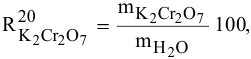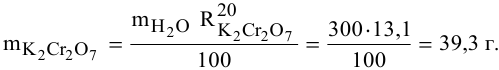- Решение задач на растворы
- Ход урока
- Организационный момент
- Проверочная работа
- Подведение итогов урока
- Оценки за урок.
- Домашнее задание.
- Задачи с решениями на концентрацию растворов
- Концентрация растворов. Растворы неэлектролитов. Растворимость
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
- Задача:
Решение задач на растворы
Цели урока: Рассмотреть алгоритм решения задач на растворы: познакомиться с приемами решения задач в математике и химии, рассмотреть биологическое значение воды как универсального растворителя, развить практические умения решать задачи, расширить знания учащихся о значении этих веществ в природе и деятельности человека, сформировать целостную картину о взаимосвязи предметов в школе.
Ход урока
Организационный момент
Учитель математики: Здравствуйте! Сегодня мы проводим необычный урок – урок на перекрестке наук математики и химии.
Учитель химии: Здравствуйте, ребята! Мы с вами увидим, как математические методы решения задач помогают при решении задач по химии.
А чтобы сформулировать тему урока, давайте проделаем небольшой эксперимент.
(Наливаю в 2 хим. стакана воду, добавляю в оба одинаковое количество сульфата меди.) Что получилось? (Растворы). Из чего состоит раствор? (Из растворителя и растворённого вещества). А теперь добавим в один из стаканов ещё немного сульфата меди. Что стало с окраской раствора? (Он стал более насыщенным). Следовательно, чем отличаются эти растворы? (Массовой долей вещ-ва).
Учитель математики: А с математической точки зрения – разное процентное содержание вещества.
Итак, тема урока “Решение задач на растворы”.
Цель урока: Рассмотреть алгоритм решения задач на растворы, познакомить с приемами решения задач в математике и химии, расширить знания о значении этих растворов в быту, сформировать целостную картину о взаимосвязи предметов в школе.
Девиз: “Только из союза двух работающих вместе и при помощи друг друга рождаются великие вещи” Антуан де Сент-Экзюпери.
Учитель математики: Для урока необходимо повторить понятие процента.
– Что называют процентом? (1/100 часть числа).
– Выразите в виде десятичной дроби 17%, 40%, 6%.
– Выразите в виде обыкновенной дроби 25%, 30%, 7%.
| 40% | 1/4 |
| 25% | 0,04 |
| 80% | 0,4 |
| 4% | 4/5 |
Одним из основных действий с процентами – нахождение % от числа.
Как найти % от числа? (% записать в виде дроби, умножить число на эту дробь.)
– Найти 10% от 30 (10%=0,1 30·0,1=3).
1) 20% от 70;
2) 6% от 20;
3) х% от 7.
– Что такое раствор? (Однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.)
– Приведите примеры растворов, с которыми вы встречаетесь в повседневной жизни. (уксус, нашатырный спирт, раствор марганцовки, перекись водорода и др.)
– Какое вещество чаще всего используется в качестве растворителя? (Вода)
Часто понятие “раствор” мы связываем, прежде всего, с водой, с водными растворами. Есть и другие растворы: например спиртовые раствор йода, одеколона, лекарственные настойки.
Хотя именно вода является самым распространённым соединением и “растворителем” в природе.
3/4 поверхности Земли покрыто водой.
Человек на 70% состоит из воды.
В сутки человек выделяет 3 литра воды и столько же нужно ввести в организм.
Овощи – 90% воды содержат (рекордсмены — огурцы — 98%)
Рыба 80% (рекордсмен у животных – медуза 98%)
Хлеб – 40%
Молоко – 75%
– Что такое массовая доля растворенного вещества? (Отношение массы растворенного вещества к общей массе раствора.)
– Вспомните формулу для вычисления массовой доли растворенного вещества и производные от нее (w = m (р.в.)/m (р-ра ) ; m (р.в.)= m (р-ра) · w ; m (р-ра) = m (р.в.)/ w )
– По какой формуле можно рассчитать массу раствора? (m(р-ра) = m (р.в.) + m (р-ля)).
Учитель химии предлагает решить учащимся задачу:
Задача №1. Перед посадкой семена томатов дезинфицируют 15%-ным раствором марганцовки. Сколько г марганцовки потребуется для приготовления 500 г такого раствора? (Ответ: 40 г.)
– Давайте посмотрим на эту задачу с точки зрения математики. Какое правило на проценты вы применили при решении этой задачи? (Правило нахождения процента от числа.)
500·0,15=75 (г) – марганцовки.
– Как видите, задачи, которые вы встречаете на химии, можно решать на уроках математики без применения химических формул.
Задачам на растворы в школьной программе уделяется очень мало времени, но эти задачи встречаются на экзаменах в 9 и 11 классах. В этом году на экзамене в 9 классе была задача на смешивание растворов, и она оценивалась в 6 баллов.
Задача №2. При смешивании 10%-го и 30%-го раствора марганцовки получают 200 г 16%-го раствора марганцовки. Сколько граммов каждого раствора взяли?
Можно ли решить эту задачу так быстро?
О чем говорится в этой задаче? (о растворах)
Что происходит с растворами? (смешивают)
| Раствор | %-е содержание | Масса раствора (г) | Масса вещества (г) |
0,1х + 0,3(200-х) = 0,16 · 200
0,1х + 60 – 0,3х = 32
-0,2х = -28
х = 140
140 (г) – 10% раствора
200 – 140 = 60 (г) — 30% раствора.
Ответ: 140 г, 60 г.
Учитель математики. Рассмотрим еще один раствор – это уксусная кислота. Водный раствор уксусной кислоты, полученный из вина (5-8%) называют винным уксусом. Разбавленный (6-10%) раствор уксусной кислоты под названием “столовый уксус” используется для приготовления майонеза, маринадов и т.д. Уксусная эссенция 80% раствор. Ее нельзя применять без разбавления для приготовления пищевых продуктов. “Столовый уксус”, используют для приготовления маринадов, майонеза, салатов и других пищевых продуктов. Очень часто при приготовлении блюд под руками оказывается уксусная эссенция. Как из нее получить столовый уксус. Поможет следующая задача.
Задача №3. Какое количество воды и 80%-го раствора уксусной кислоты следует взять для того, чтобы приготовить 200 г столового уксуса (8%-ый раствор уксусной кислоты.)
%-е содержание
Масса раствора (г)
Масса вещества (г)
Уксусная кислота
Вода
0,08 · 200
0,8х = 0,08 · 200
0,8х = 16
х = 16 : 0,8
х = 20
20 (г) – уксусной кислоты
200 – 20 = 180 (г) – воды.
Ответ: 20 г, 180 г.
Учитель химии. А сейчас мы решим экспериментальную задачу.
Приготовить 20 г 5%-го раствора поваренной соли. (Расчётная часть). Затем выполняем практическую часть. (Напомнить правила Т-Б).
2. Экспериментальная часть (Соблюдать правила техники безопасности).
- Уравновесить весы.
- Взвесить необходимое количество соли.
- Отмерить мерным цилиндром воду.
- Смешать воду и соль в стакане.
Учитель математики. Проведем проверочную работу, в которую включили задачи из сборника для подготовке к экзаменам в 9-м классе.
Проверочная работа
| При смешивании 15%-го и 8% -го раствора кислоты получают 70 г 10%-го раствора кислоты. Сколько граммов каждого раствора взяли? | При смешивании 15%-го и 60% -го раствора соли получают 90 г 40%-го раствора соли. Сколько граммов каждого раствора взяли? |
| 1р 15% = 0,15 х 0,15х | 1р 15%=0,15 х 0,15х |
| 2р 8% = 0,08 70 — х 0,08(70 — х) | 2р 60% = 0,6 90 — х 0,6(90 — х) |
| см 10% = 0,1 70 0,1 · 70 | 3р 40% = 0,4 90 0,4 · 90 |
| 0,15х + 0,08(70 — х) = 0,1 · 70 0,15х + 5,6 — 0,08х = 7 0,07х = 7 — 5,6 0,07х = 1,4 х = 1,4:0,07 х = 20 20(г) – 15%-го раствора. 70 – 20 = 50 (г) — 8% раствора Ответ: 20 гр., 50 г. | 0,15х + 0,6(90 — х) = 0,4 · 90 0,15х + 54 — 0,6х = 36 -0,45х = 36 — 54 -0,45х =-18 х = 18 : 0,45 х = 40 40 (г) -15% раствора. 90 — 40 = 50 (г) — 60% раствора. Ответ: 40 гр., 50 г. |
Подведение итогов урока
– Посмотрите на содержание всех решенных сегодня задач. Что их объединяет? (Задачи на растворы.)
– Действительно, во всех задачах фигурируют водные растворы; расчеты связаны с массовой долей растворенного вещества; и если вы обратили внимание, задачи касаются разных сторон нашего быта.
– Посмотрите на эти задачи с точки зрения математики. Что их объединяет? (Задачи на проценты.)
При решении всех этих задач мы используем правило нахождения процента от числа.
Оценки за урок.
Домашнее задание.
Важное место в рационе питания человека, а особенно детей занимает молоко и молочные продукты. Решим такую задачу:
Задача №1. Какую массу молока 10%-й жирности и пломбира 30%-й жирности необходимо взять для приготовления 100 г 20%-го новогоднего коктейля?
%-е содержание
Масса раствора (г)
Масса вещества (г)
Молоко
Пломбир
10% = 0,1
30% = 0,3
х
100 — х
0,1х
0,3(100 — х)
Коктейль
0,1х + 0,3(100-х) = 0,2 · 100
0,1х + 30 – 0,3х = 20
-0,2х = -10
х = 50
50(г) – молока
100 – 50 = 50(г) – пломбира.
Ответ:50 г молока, 50 г пломбира.
Задача №3. Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?
Раствор
Разбавленный, водный
Растворять, смешивать, решать
Растворы широко встречаются в быту.
Смеси
Наш урок подошел к концу. Сейчас каждый из вас оставит на парте тот смайлик, какое настроение вы приобрели на уроке.
Источник
Задачи с решениями на концентрацию растворов
Концентрация растворов. Растворы неэлектролитов. Растворимость
Задача:
Расчеты по процентной концентрации растворов. Формула, выражающая процентную концентрацию раствора —
где 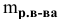
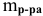
Задача:
Рассчитать процентную концентрацию раствора, полученного растворением 80 г сахара в 160 г воды.
Решение:
Задача:
Рассчитать массы поваренной соли и воды, необходимые для приготовления 250 г 2,5%-ного раствора.
Решение:
Задача:
Рассчитать концентрацию раствора, полученного смешением З00 г 10%-ного раствора хлороводорода и 400г 20%-ного раствора хлороводорода.
Решение:
Определяем массы растворенной 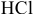
Определяем концентрацию полученного раствора:
Задача:
Какова концентрация серной кислоты в растворе, полученном смешиванием 200г 10%-ного раствора серной кислоты и 100г 5%-ного раствора сульфата натрия?
Решение:
Масса полученного раствора определяется как сумма масс смешанных растворов:
Далее определим концентрацию серной кислоты в полученном растворе:
Задача:
Расчеты по молярной концентрации (молярности) раствора.
Формула для расчета молярности раствора —
где С — молярность раствора, моль/л;
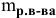
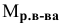
V — объем раствора, мл; если объем выражается в литрах, тогда в формуле исчезает коэффициент 1000.
Задача:
Какая масса серной кислоты необходима для приготовления 2 л 2-молярного раствора?
Решение:
Задача:
250 мл раствора содержат 7г КОН. Какова молярность этого раствора?
Решение:
Задача:
Расчеты по нормальной концентрации (нормальности) раствора.
Для расчета нормальности пользуемся следующей формулой:
где 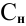
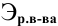
Задача:
Какая масса фосфорной кислоты необходима для приготовления 2 л 0,1 н раствора?
Решение:
Задача:
Расчеты по разбавлению растворов.
Выведем формулу для расчетов при разбавлении растворов, учитывая, что концентрация как исходного, так и приготовленного растворов может быть выражена любым способом 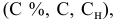
Для раствора, концентрация которого выражена в процентах,
а так как
где 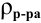
Для молярной концентрации
Для нормальной концентрации
Приравниваем правые части уравнений:
Задача:
Сколько миллилитров 98%-ного раствора серной кислоты
( 
Решение:
Воспользуемся первым членом приведенного выше уравнения для концентрированного исходного раствора кислоты и третьим членом — для приготовления разбавленного раствора серной кислоты:
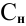
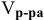
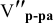
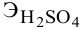
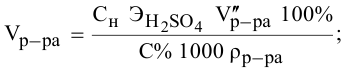
Задача:
Расчеты по переходу от одного способа выражения концентрации данного раствора к другому.
При переходе от одной концентрации данного раствора к другой остаются постоянными не только масса растворенного вещества, но и объем раствора, т.е.
Предыдущая формула принимает следующий вид:
Задача:
Определить молярность 36,5%-ного раствора соляной кислоты (
Решение:
Воспользуется первым и вторым членами последнего уравнения и выведем выражение для определения молярности:
Задача:
Расчеты по законам Рауля. Давление паров разбавленного раствора.
По закону Рауля, понижение давления пара 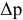
где 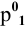
N — мольная доля растворенного вещества,
где 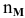
где 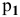
Задача:
Определить давление насыщенных паров раствора, содержащего 45 г глюкозы 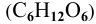
Решение:
Рассчитываем мольную долю растворенного вещества:
Определяем давление паров воды над раствором:
Задача:
Расчеты по понижению температуры замерзания растворов.
По закону Рауля понижение температуры замерзания прямо пропорционально моляльной концентрации раствора:
где 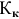
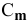
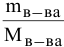
Задача:
Рассчитать температуру замерзания 3%-ного водного раствора этиленгликоля
Решение:
Выведем формулу для перехода от процентной концентрации к моляльности раствора.
Для процентной концентрации
Если принять 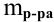
Находим моляльность рассматриваемого раствора:
Рассчитаем понижение температуры замерзания раствора:
Температура замерзания водного раствора
Задача:
Рассчитать температуру кипения 0,1 молярного водного раствора глюкозы ( 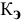
Решение:
Формула для перехода от молярной концентрации к моляльной —
Так как раствор разбавленный, то принимаем 
Определяем повышение температуры кипения раствора:
Температура кипения этого раствора
Задача:
Расчеты по уравнению химической реакции, протекающей в растворе.
Для химического уравнения общего вида
верно следующее соотношение числа эквивалентов:
Если участвующие в реакции вещества взяты в виде растворов и если их концентрации выражены:
а) для вещества А — С %;
б) для вещества В — С (молярность);
в) для вещества С — 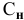
тогда массы и число эквивалентов каждого из веществ, находящихся в определенных объемах растворов этих веществ, определяются по формулам:
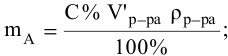
Так как числа эквивалентов, участвующих в реакции веществ, равны между собой, то можно записать:
Если концентрации участвующих в реакции веществ выражены в нормальности, то формула для расчетов приобретает вид:
Задача:
Какой объем 0,2 н раствора щелочи необходим для осаждения 2,708 г хлорида трехвалентного железа в виде гидроксида железа?
Решение:
Предложенный метод не требует обязательного написания уравнения реакции для осуществления таких расчетов.
Задача:
Для нейтрализации 20 мл 2-молярного раствора 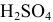
Решение:
Формула для расчета —
Так как 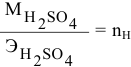
Задача:
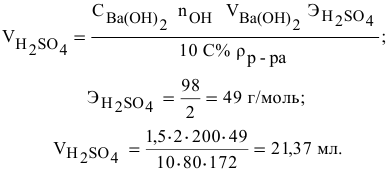
Какой объем 80 %-ного раствора 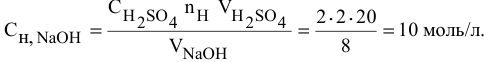
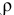
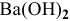
Решение:
Формула для расчета —
Так как 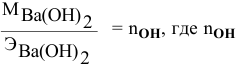
Задача:
Какой объем 0,2 н раствора щелочи необходим для реакции осаждения 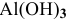
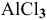
Решение:
Формула для расчета —
Задача:
Смешивается 300 мл 0,5 М раствора хлорида бария со 100 мл 6 %-ного раствора серной кислоты ( 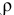
Решение:
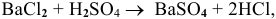
Так как указаны количества обоих реагирующих веществ, то необходимо определить вещество, взятое в избытке.
Таким образом, 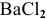
Дальнейший расчет производим по веществу, взятому в недостатке, т.е. по серной кислоте.
Так как
находим массу
Задача:
Для приготовления насыщенного раствора К.С1 при 40°С взято 50г воды и 20г КС1. Какова растворимость К.С1 в воде при данной температуре?
Решение:
Задача:
В 300г горячей воды растворено 219г 


Решение:
Определяем, сколько может быть растворено 
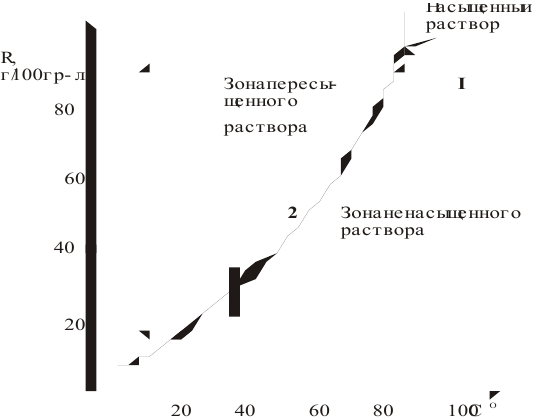
Масса кристаллов — это разность массы растворенного вещества в горячем растворе и массы растворенного вещества в охлажденном растворе (рис.З):
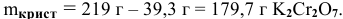
Рис. 3 — Графическое изображение процесса выпадения кристаллов при охлаждении раствора:
1 — участок охлаждения ненасыщенного раствора от заданной температуры до температуры образования насыщенного раствора;
2 — участок охлаждения насыщенного раствора до заданной температуры с уменьшением растворимости вещества, что приводит к его кристаллизации (в данном случае мы предполагаем, что пересыщенный раствор не образуется).
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник