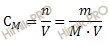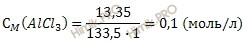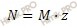- Химик.ПРО – решение задач по химии бесплатно
- Ответ:
- Способ получения основного хлорида алюминия
- Форум химиков
- Приготовление раствора хлорида алюминия
- Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
- Re: Приготовление раствора хлорида алюминия
Химик.ПРО – решение задач по химии бесплатно
Определите молярность и нормальность раствора хлорида алюминия (AlCl3), содержащего в 1 литре 13,35 грамм хлорида алюминия (AlCl3).
Решение задачи
Найдем молярность раствора хлорида алюминия (AlCl3). Для расчета будем использовать формулу нахождения молярной концентрации раствора:
CM – молярная концентрация раствора;
n – химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m – масса растворенного вещества;
V – объем раствора.
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Рассчитаем молярную массу хлорида алюминия (AlCl3):
M (AlCl3) = 27 + 3 ∙ 35,5 = 133,5 (г/моль).
Известные значения подставим в формулу.
Найдем нормальную концентрацию раствора хлорида алюминия (AlCl3) по формуле, устанавливающей связь между нормальной и молярной концентрацией:
N – нормальная концентрация;
M – молярная концентрация;
z – число эквивалентности.
Напомню, что под нормальной концентрацией понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «н», «N»
Учитывая, что число эквивалентности хлорида алюминия (AlCl3) равно 3 (произведение валентности металла на число его атомов в молекуле соли), рассчитаем нормальную концентрацию раствора хлорида алюминия (AlCl3):
N (AlCl3) = 0,1 ∙ 3 = 0,3 (моль-экв/л).
Ответ:
молярность раствора хлорида алюминия равна 0,1 моль/л;
нормальность раствора хлорида алюминия равна 0,3 моль-экв/л.
Источник
Способ получения основного хлорида алюминия
Изобретение предназначено для получения основного хлорида алюминия. Способ заключается в том, что жидкий отход производства изобутилбензола с содержанием хлорида алюминия (AlCl3) от 200 до 300 г/дм 3 подвергают нейтрализации раствором с каустическим отношением, равным единице. Процесс нейтрализации проводят при комнатной температуре. Нейтрализацию раствора хлорида алюминия (AlCl3) алюминатным раствором (АР) проводят при стехиометрическом соотношении компонентов, г-моль, AlCl3:АР:(0,666-1,333):(0,666-1,333) — для получения одно- и двухмолярного низкоосновного раствора основного хлорида алюминия и (0,575-1,150) : (0,719-1,438) — для получения 1,020 и 0,040 молярного высокоосновного раствора основного хлорида алюминия соответственно. Изобретение позволяет снизить себестоимость продукта, энергозатраты, упростить процесс и ликвидировать выделение агрессивного пара HCl. 2 з.п.ф-лы, 1 табл.
Изобретение относится к химической технологии и может быть использовано для получения основного хлорида алюминия, широко используемого для очистки природных и сточных вод.
Основные соли хлорида алюминия, в большинстве случаев, получают путем нейтрализации готового продукта — раствора хлорида алюминия (AlCl3). В качестве нейтрализующего компонента используют металлический алюминий / Патент Японии N 452645, кл. C 01 F 7/56, 1970. Авторское свидетельство СССР N 260624, кл. C 01 F 7/62, 1970/, нефелиновый концентрат /Авторское свидетельство СССР N 435191, кл. C 01 F 7/00, 1974/ и т.д. Нейтрализацию ведут при 80-110 o C с выдержкой 1,5-2 и более часов при постоянном перемешивании. Процесс протекает с потреблением энергии. При этом происходит загрязнение окружающего воздуха агрессивным паром HCl.
Наиболее близким аналогом к изобретению является способ получения основного хлорида алюминия, включающий нейтрализацию раствора хлорида алюминия алюминатным раствором с каустическим отношением, равным единице /А.К. Запольский, А.А. Баран. Коагулянты и флокулянты в процессах очистки воды. Л.: Химия, 1987, с. 92/. Процесс проводят при 50-80 o C.
Недостатком этого способа является использование специально подготовленного сырья — хлорида алюминия.
Задачей, решаемой изобретением, является снижение себестоимости продукта, энергозатрат, упрощение процесса и ликвидация выделения газообразного HCl.
Поставленная задача достигается тем, что в качестве раствора хлорида алюминия используют жидкий отход производства изобутилбензола с содержанием хлорида алюминия (AlCl3) от 20 до 300 г/дм 3 .
Для получения соответствующего раствора основного хлорида алюминия (низкоосновного или высокоосновного, одно- или двухмолярного) нейтрализацию раствора хлорида алюминия (AlCl3) алюминатным раствором (АР) проводят при стехиометрическом соотношении компонентов AlCl3 и АР при комнатной температуре.
На основании рассмотрения реакций нейтрализации следует, что процесс нейтрализации происходит без выделения агрессивного пара HCl.
Рассмотрим реакции нейтрализации.
Для получения низкоосновного (марка 2/3 или основность 66,666) и высокоосновного (марка 5/6 или основность 83,333) раствора основного хлорида алюминия путем нейтрализации раствора AlCl3 алюминатным раствором нейтрализующим компонентом может служить NaOH. Реакция протекает следующим образом: 2AlCl3 + 4NaOH = Al2(OH)4Cl2 + 4NaCl, (1) 2AlCl3 + 5NaOH = Al2(OH)5Cl + 5NaCl. (2) Как видно, реакции протекают без выделения газов.
При получении низкоосновного раствора основного хлорида алюминия (1) следует отношение AlCl3 : NaOH = 1:2 (3) или AlCl3 : Na2O = 1:1 При получении высокоосновного раствора основного хлорида алюминия (2) следует отношение AlCl3 : NaOH = 1:2,5 (4) или
AlCl3 : Na2O = 1:1,25.
Нейтрализующим компонентом может быть и Al(OH)3 (Al2O3 + 3H2O = Al(OH)3):
2AlCl3 + 4Al(OH)3 = 3Al2(OH)4Cl2, (5)
AlCl3 + 5Al(OH)3 = 3Al2(OH)5Cl. (6)
Как видно, эти реакции также протекают без выделения газа.
При получении низкоосновного раствора основного хлорида алюминия (5) следует отношение
AlCl3 : Al(OH)3 = 1:2 (7)
или
AlCl3 + Al2O3 = 1:1.
При получении высокоосновного раствора основного хлорида алюминия (6) следует отношение
AlCl3 : Al(OH)3 = 1:5 (8)
или
AlCl3 : Al2O3 = 1:2,5.
При введении 1 г-моля алюминатного раствора с каустическим отношением, равным единице, вводится 1 г-моль, Na2O, Al2O3 или 1 г-моль Al2O3 и 2 г-моль NaOH.
Из соотношений (3), (7) следует, что при получении низкоосновного раствора основного хлорида алюминия для нейтрализации раствора AlCl3 алюминатный раствор (АР) нужно вводить в г-молях, пропорционально вводимому количеству AlCl3 в г-молях.
Следовательно, стехиометрическое соотношение компонентов
AlCl3:АР
для получения одно- и двухмолярного низкоосновного раствора основного хлорида алюминия составляет:
(0,666 — 1,333) : (0,666 — 1,333), г-моль.
Из соотношений (4) следует, что при получении высокоосновного раствора основного хлорида алюминия для нейтрализации раствора AlCl3, содержащего 1 г-моль AlCl3, нужно ввести 1,25 г-моль алюминатного раствора, а из соотношений (8) следует, что нужно вводить 2,5 г-моль алюминатного раствора, что противоречит соотношению (4), т.к. при этом отношение AlCl3 : NaOH, станет равным 1:5, что недопустимо. Поэтому нужно алюминатный раствор вводить в количестве 1,25 г-моль к одному г-молю AlCl3. В данном случае введенного количества Al2O3 будет недостаточно. Поэтому расчетным путем получено стехиометрическое соотношение компонентов раствора AlCl3 и АР для получения 1,020 и 2,040 молярного высокоосновного раствора основного хлорида алюминия, что составляет:
AlCl3 : АР = 0,575 : 0,719 = 1:1,25 и
1,150:1,438 = 1:1,25, соответственно.
Т.е., AlCl3 : АР = (0,575 — 1,150) : (0,79 — 1,438), г-моль.
Примеры получения основного хлорида алюминия путем нейтрализации отхода производства изобутилбензола с содержанием хлорида алюминия (AlCl3) от 200 до 300 г/дм 3 алюминатным раствором с каустическим отношением, равным единице, приведены в таблице.
При низкой температуре в лаборатории в зимних условиях нейтрализацию проводят на водяной бане при перемешивании смеси.
При получении высокоосновного раствора основного хлорида алюминия с увеличением pH более 4-х единиц и при приближении к нейтральной области коагулянт может превращаться в пасту.
Преимущества предложенного способа: снижение себестоимости, энергозатрат и упрощение процесса за счет перехода к готовому и дешевому сырью — отходу производства изобутилбензола с содержанием AlCl3 от 200 до 300 г/дм 3 . Кроме того, процесс нейтрализации происходит без выделения агрессивного газа HCl и проводят его при комнатной температуре.
1. Способ получения основного хлорида алюминия, включающий нейтрализацию раствора хлорида алюминия алюминатным раствором с каустическим отношением, равным единице, отличающийся тем, что в качестве раствора хлорида алюминия используют жидкий отход производства изобутилбензола с содержанием хлорида алюминия (AlCl3) от 200 до 300 г/дм 3 .
2. Способ по п.1, отличающийся тем, что процесс нейтрализации проводят при комнатной температуре.
3. Способ по п.1, отличающийся тем, что нейтрализацию раствора хлорида алюминия (AlCl3) алюминатным раствором (AP) проводят при стехиометрическом соотношении компонентов, г-моль, AlCl3 : AP : (0,666 — 1,333) : (0,666 — 1,333) — для получения одно- и двухмолярного низкоосновного раствора основного хлорида алюминия и (0,575 — 1,150) : (0,719 — 1,438) для получения 1,020 и 2,040 молярного высокоосновного раствора основного хлорида алюминия, соответственно.
Источник
Форум химиков
Приготовление раствора хлорида алюминия
Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Ср апр 30, 2014 7:04 pm
Добрый день. Подскажите как безопасно приготовить 25%раствор хлорида алюминия в больших объемах. Как уловить хлористый водород, который летит при добавлении воды.
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение Iskander » Ср апр 30, 2014 7:18 pm
Вы что, растворяте безводный хлорид алюминия
Это же варварство, ведь есть продажные растворы для водоподготовки!
Но если уж хочется, то советую каждую новую порцию грузить в уже приготовленный 25% раствор, повышая его концентрацию, скажем, до 30%. Далее охлаждаем, разбавляем до 25% и сливаем часть раствора.
Re: Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Чт май 01, 2014 5:29 am
Согласен, что это не очень гуманно. Но к сожалению здесь играет роль и цена. К сожалению дешевле сделать из безводного хлорида алюминия. А как в промышленности готовят раствор хлорида алюминия не подскажите. Может сверху сделать орошение водой для улавливания паров хлорист ого водорода.
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение avor » Чт май 01, 2014 6:52 am
Re: Приготовление раствора хлорида алюминия
Сообщение Iskander » Чт май 01, 2014 8:36 am
Какие объёмы планируемого производства?
avor, это ж надо ещё где-то добыть приличного гидроксида.
Re: Приготовление раствора хлорида алюминия
Сообщение avor » Чт май 01, 2014 10:58 am
Re: Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Чт май 01, 2014 2:53 pm
Надо перелопатить 16 тонн безводного хлорида алюминия . Попробовал при помощи маточного раствора. Пока из того что предложили и сам нашел пожалуй самый оптимальный вариант. Но маточный раствор тоже надо делать тоже геморрой.
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение Iskander » Чт май 01, 2014 4:25 pm
Маточник делается только один раз, а дальше циркулирует по системе.
Например, сравнительно долго и геморройно делается 1 тонна маточника. Далее в него добавляется сперва 200 кг хлорида алюминия, а после его растворения — 600 кг воды. Далее сливаем 800 кг готового продукта, охлаждаем маточник и повторяем операцию ещё на 200 кг хлорида. В идеальном раскладе за сутки можно перелопатить до тонны хлорида алюминия. Как подвариант — порциями вносится 300 кг хлорида и 600 кг воды, соответственно. Далее сливаем концентрат и разбавляем до 25%.
Re: Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Чт май 01, 2014 4:44 pm
Iskander Спасибо за совет. Завтра будем колдовать. Температура конечно поднимается до 100 градусов в лаборатории, но деваться некуда. Праздники весело у меня проходят . Охлаждать реактор будем водой.
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Чт май 01, 2014 4:49 pm
Кстати в самом начале приготовления маточного раствора что посоветуешь загружать первым воду или хлорид алюминия?
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Чт май 01, 2014 4:51 pm
Я склоняюсь к варианту хлорид алюминия добавлять малыми порциями в воду.
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение Iskander » Чт май 01, 2014 5:21 pm
Re: Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Чт май 01, 2014 5:54 pm
Iskander Спасибо за совет. Как сделаю первую закладку отпишусь.
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение Дима_02 » Вт май 06, 2014 2:25 pm
Итак попробовали. К сожалению теория с практикой расходится. Дополнительно сделали трубу с кольцами рашига и орошением плюс охлаждения реактора. Но к сожалению скорость приготовления очень маленькая. Где то половина бочки за полдня.
[ Post made via iPad ]
Re: Приготовление раствора хлорида алюминия
Сообщение himdim2012 » Чт май 08, 2014 11:50 pm
может я не много не понимаю или отстал от жизни, ну нельзя ли в какую нибудь закрытую ячейку/бак насыпать 16 тонн хлорида алюминия и добавить необходимое количество воды и все отрецикулировать насосом? В чем проблема? Если НСl будет лететь то он останется в системе. Зачем так извращаться с кольцами Рашига?
И вам нужен точно хлорид алюминия? Судя по постановке задачи вы хотите получить (поли)оксихлорид алюминия. Их технология маленько отличается.
А насчет цен согласен, дешевле готовить самим чем покупать готовый раствор.
— Вас Кузьмой зовут?
— Кузенькой, можно Кузькой, маленький я ещё, семь веков всего, восьмой пошел.
Из м/ф «Домовенок Кузя»
Re: Приготовление раствора хлорида алюминия
Сообщение antabu » Пт май 09, 2014 9:56 am
Re: Приготовление раствора хлорида алюминия
Сообщение Iskander » Пт май 09, 2014 4:52 pm
Это да. И это создаёт проблемы
Может, попробовать схему «эксикатора»? В бочку насыпаем центнер хлорида и в центр кучи ставим ёмкость с водой, скажем 10 л. Бочку закрываем и оставляем на недельку для переноса воды через пар на хлорид. Потом полученную кашу разбавляем маточником и водой. Ещё как вариант — гидратация хлорида при помощи кристаллогидрата хлорида алюминия, наработанного ранее, пересыпая слоями кристаллогидрат и безводный хлорид. После «созревания» смеси, когда образуется частично гидратированный продукт, снова разбавляем маточником или водой. Если бы была возможность наработать много льда, то можно было бы организовать хорошее охлаждение маточника, скажем до -5 градусов прямо в процессе.
Re: Приготовление раствора хлорида алюминия
Сообщение Гесс » Пт май 09, 2014 6:42 pm
Re: Приготовление раствора хлорида алюминия
Сообщение himdim2012 » Пт май 09, 2014 7:44 pm
— Вас Кузьмой зовут?
— Кузенькой, можно Кузькой, маленький я ещё, семь веков всего, восьмой пошел.
Из м/ф «Домовенок Кузя»
Re: Приготовление раствора хлорида алюминия
Сообщение Iskander » Пт май 09, 2014 8:29 pm
Источник