- Хлороформ в домашних условиях: способы получения, физические свойства, использование в быту и опасность
- История
- Физические свойства
- Пути получения
- Получение хлороформа в домашних условиях
- Применение
- Осторожно — опасное вещество!
- Хлороформ
- Хлороформ
- Содержание
- История
- Физические свойства
- Химические свойства
- Получение
- Применение
- Очистка
- Воздействие на организм
- Примечания
- Полезное
- Смотреть что такое «Хлороформ» в других словарях:
Хлороформ в домашних условиях: способы получения, физические свойства, использование в быту и опасность
Что такое хлороформ? Это химическое соединение, представляющее собой летучую жидкость, бесцветную, с резким эфирным запахом и сладким привкусом. Вещество не растворяется в воде, не является горючим, может смешиваться с большинством растворителей.
Ядовито, при воздействии ультрафиолетовых лучей и при контакте с кислородом медленно разлагается, преобразуясь в еще более опасные вещества, среди которых фосген и хлор.
Используется в промышленных и медицинских целях.
История
Впервые химическое вещество было получено в 1831 году немецким химиком Самуэлем Гутри. Основную формулу и название для соединения установил французский ученый Дюма в 1834 году.
Долгое время хлороформ использовали в промышленных целях, в основном как растворитель.
В медицине впервые вещество было использовано в 1847 году в качестве наркоза английским врачом Симпсоном.
До России открытие дошло только через 50 лет, и настоящий медицинский хлороформ в домашних условиях вывел Борис Збарский в 1916 году. Как средство для наркоза получил широкое применение после операций Николая Пирогова.
Физические свойства
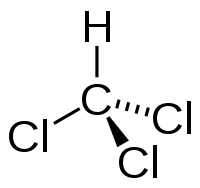
- Формула соединения — CHCl3.
- Преломление — 1,44858 при температуре 15°C.
- Температура кипения — +61,152°C.
- Кристаллизация при 63,55°C.
- Растворяется в воде только при температуре свыше 31°C в незначительном количестве.
В хлороформе, используемом в медицинских целях и поступающем в ограниченную продажу, содержится до 2% этилового спирта, который выступает в роли связующего звена между компонентами и не дает соединению разлагаться на солнечном свету и выделять опасные вещества.
Пути получения
В промышленных масштабах жидкость добывают путем хлорирования.
Хлороформ получают нагреванием хлора и метана (или метансодержащих веществ, метилхлорида) при температуре от 400 °C. В результате образуется смесь, состоящая из нескольких соединений, разделение которых происходит методом дистилляции.
В лабораторных исследованиях хлороформ также добывают реакцией гипохлорита кальция и ацетона. В результате выделяются два вида жидкостей, также разделяемых дистилляцией.
Хлороформ в домашних условиях извлекается из разных веществ несколькими путями.
При соединении хлорной извести с этиловым спиртом, ацетоном или ацетальдегидом.
При нагревании трихлоруксусной кислоты.
При работе с веществами принимаются все меры предосторожности. Покров кожи должен быть закрыт специальной одеждой, обязательно наличие перчаток, очков и защитной маски для предотвращения вдыхания паров соединения.
Получение хлороформа в домашних условиях
Получить хлороформ можно из чистой хлорной извести или продуктов, ее содержащих, например, специальных средств для уборки дома. Самым известным является жидкость «Белизна».
Вещество необходимо смешать с ацетоном в стеклянной или пластиковой посуде в соотношении 1 часть ацетона на 30 частей «Белизны». После отстаивания разделить получившуюся жидкость с помощью капельной воронки на воду и хлороформ.
В случае наличия гидроксида натрия (каустической соды, NaOH) можно провести электролиз в домашних условиях. В стеклянную или пластиковую тару необходимо налить спирт (желательно этиловый), добавить соли и тщательно перемешать до полного растворения. Соль выступает в качестве усилителя проводящих способностей. Добавить каустическую соду, опустить два электрода, соединенных с источником питания. После вскипания раствора необходимо следить за тем, насколько быстро будет происходить расслоение жидкости на воду (наверху) и хлороформ (внизу).
Нагрев трихлоруксусную кислоту до температуры +75 °C и выпарив углекислый газ, вы также получите хлороформ. В домашних условиях необходимо предпринять определенные меры, чтобы обеспечить свою безопасность — требуется надеть специальную защитную маску, чтобы не надышаться вредными веществами, а при работе с кислотой следует использовать толстые резиновые перчатки.
Применение
Изначально хлороформ использовался в качестве растворителя, в большинстве своем — для каучука и нефтепродуктов.
В 19-20-м вв. — в качестве наркоза при проведении множества операций.
В настоящее время хлороформ используется:
- для получения более сложных веществ (фреона, хладона);
- в качестве растворителя;
- для производства пестицидов;
- при изготовлении красителей.
Осторожно — опасное вещество!
Хлороформ — чрезвычайно опасное вещество, точно такое же, как и его составляющие. Поэтому тщательно взвесьте все «за» и «против», перед тем как узнавать, как сделать в домашних условиях хлороформ. Ведь существует много безопасных аналогов этого вещества.
Хлороформ — вредное и опасное соединение. Оно воздействует на весь организм в целом и при обращении с ним необходимо применять меры предосторожности.
Хлороформ — полуэфирное вещество и очень быстро распространяется по воздуху. При воздействии на легкие быстро впитывается в кровь, вызывая отрицательную реакцию у всего организма.
Центральная нервная система под влиянием вещества подавляется. При вдыхании небольшого количества чувствуется головокружение, появляется ощущение общей усталости, может возникнуть головная боль и рвота. При долгом воздействии человек теряет сознание.
Длительное влияние даже в малых дозах вызывает заболевания печени и почек.
Если сильно увеличить дозу хлороформа и оставить человека под его воздействием — возможен летальный исход.
При проведении исследований на крысах выяснилось, что длительное использование в малых дозах приводит к выкидышам, а рожденные животные имеют большой процент генетических отклонений.
Если вы решили получить хлороформ в домашних условиях, необходимо быть максимально осторожным. Кроме свойств самого вещества следует учесть, что существует возможность отравления фосгеном, который вызывает еще более тяжелые последствия для человеческого организма.
Источник
Хлороформ
На воздухе при действии света хлороформ медленно реагирует с кислородом и другими окислителями. Главными продуктами, которые при этом образуются, являются карбонилхлорид (фосген)! хлор и хлористый водород.
Имеются сведения о несчастных случаях отравления фосгеном при работе с хлороформом, который в течение долгого времени хранился в теплом месте. Небольшие количества этилового спирта стабилизируют хлороформ; Вайсбергер и Фасолд показали, что аналогичное действие оказывает диметиламиноазобензол. Хромовая смесь окисляет хлороформ до фосгена и хлора. При взаимодействии концентрированной азотной кислоты с хлороформом образуются небольшие количества хлорпикрина. Щелочи реагируют с хлороформом различными путями. При очистке не рекомендуется нагревать хлороформ со щелочами.
Основные промышленные методы получения хлороформа в США в настоящее время состоят в хлорировании и окислении ацетона, а также в хлорировании метана и хлорметана.
Описанные в литературе методы очистки хлороформа можно разделить на методы, в которых для удаления спиртов используется концентрированная серная кислота, и методы, в которых серная кислота не используется. Каждый из методов имеет свои особенности. Ниже приведены некоторые из методов обоих типов.
Очистка от карбонилхлорид а. Содержащийся в виде примеси карбонилхлорид медленно реагирует с водой, спиртами и щелочами и быстро реагирует с фенолятом натрия даже при небольших концентрациях. Гилло показал, что хлороформ трудно очищать ввиду его нестабильности и чувствительности по отношению к свету и действию кислорода. Он нашел, что содержание карбонилхлорида всегда превосходит 0.0003%.
Очистка от этилового спирта. Для большинства препаративных и аналитических целей этиловый спирт может быть удален пяти- или шестикратным промыванием половинным количеством воды с последующей осушкой.
Бадд считает, что лучший метод очистки от этилового спирта состоит во встряхивании хлороформа с концентрированной серной кислотой. Морган и Лоури промывали хлороформ несколько раз концентрированной серной кислотой, разбавленным раствором едкого натра, а затем водой со льдом. Промытый хлороформ сушили над карбонатом калия и сохраняли в заполненной доверху склянке из коричневого стекла; непосредственно перед использованием требуемое количество хлороформа перегоняли.
С целью получения препарата, предназначаемого для определения теплоемкости, Вильяме и Дэниельс промывали хлороформ разбавленным раствором едкого натра и водой, сушили сначала над прокаленным хлористым кальцием, а затем над пятиокисью фосфора, после чего подвергали фракционированной перегонке, фогель промывал хлороформ водой до нейтральной реакции на лакмус, сушил над сульфатом кальция и перегонял на колонке Видмера, целиком собранной из стекла; полученный препарат использовали для изучения физических свойств.
Гросс и Сейлор промывали хлороформ в течение 1 часа раствором едкого натра и дважды дистиллированной водой. Затем его обрабатывали тремя порциями концентрированной серной кислоты, два раза дистиллированной водой, один раз ртутью и, наконец, снова дистиллированной водой; после этого хлороформ сушили над хлористым кальцием и перегоняли на колонке высотой 1 м. Полученный препарат использовали для измерений растворимости.
Согласно данным Ричардса и Уолласа, промывка хлороформа серной кислотой, едким натром и водой приводит к частичному окислению его до карбонилхлорида. Авторы получали препарат хлороформа для измерений теплоемкости, подвергая его фракционированной перегонке над хлористым кальцием, до тех пор пока температура кипения и показатель преломления не становились постоянными.
Вальден, У лих и Вернер очищали хлороформ для проведения электрохимических измерений. Они оставляли хлороформ стоять в течение нескольких недель над хлористым кальцием, затем перегоняли его и сушили несколько раз над сульфатом натрия или карбонатом калия, перегоняя после каждой осушки. Авторы рекомендуют проводить перегонку, медленно пропуская через жидкость не содержащий углекислого газа воздух. Вальден измерял электропроводность хлороформа, предварительно промытого водой, осушенного кальцинированной содой или пятиокисью фосфора и подвергнутого фракционированной перегонке над кальцинированной содой.
Шайбе, Мей и Фишер очищали хлороформ, предназначаемый для проведения оптических измерений, по методу, предложенному Анщутцем.
Критерии чистоты. В любых препаратах продажного хлороформа содержится этиловый спирт, который добавляется. Для его стабилизации. Количество спирта может меняться в пределах от 0.5 до 1%. Различие между чистым реактивом и препаратом, отвечающим требованиям фармакопеи, настолько незначительно что каждый из них может быть использован
Сборник «Химические реактивы»
Фармакопея США XIV
Справочник технических препаратов
Прозрачный, бесцветный, обладает эфирным запахом и обжигающим приторным вкусом
Источник
Хлороформ
| Хлороформ | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | CHCl3 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 119,38 г/моль |
| Плотность | 1,483 г/см³ |
| Термические свойства | |
| Температура плавления | −63,5 °C |
| Температура кипения | 61,2 °C |
| Оптические свойства | |
| Показатель преломления | 1,4467 |
| Классификация | |
| Рег. номер CAS | 67-66-3 |
| SMILES | ClC(Cl)Cl |
| Безопасность | |
| Токсичность | токсично |
Хлорофо́рм (он же трихлормета́н, метилтрихлори́д, хладо́н 20) — органическое химическое соединение с формулой CHCl3. При нормальных условиях бесцветная летучая жидкость c эфирным запахом и сладким вкусом. Практически нерастворим в воде — образует с ней растворы с массовой долей до 0,23 %, — смешивается с большинством органических растворителей. Негорюч. Возможны отравления фосгеном при работе с хлороформом, который долго хранился в тёплом месте [1] .
Содержание
История
Хлороформ был впервые получен в 1831 году независимо в качестве растворителя каучука Самуэлем Гутри (Samuel Guthry) затем Либихом (Justus von Liebig) и Суберейном (Eugene Soubeiran).
Формулу хлороформа установил французский химик Дюма (Dumas). Он же и придумал в 1834 г. название «хлороформ», благодаря свойству этого соединения образовывать муравьиную кислоту при гидролизе (лат. formica переводится как «муравей»).
В клинической практике в качестве общего анестетика хлороформ первым применил Холмс Кут (Holmes Coote) в 1847 г., в широкую практику он был внедрён акушером Джеймсом Симпсоном (James Simpson), который использовал хлороформ для уменьшения боли при родах.
В России изобретение медицинского хлороформа принадлежит учёному Борису Збарскому. Открытие химик совершил в 1916 году, когда проживал на Урале в селе Всеволодо-Вильва в Пермском крае.
Физические свойства
- Показатель преломления: 1,44858 при 15 °C.
- Температура кристаллизации: −63,55 C°
- Температура кипения: 61,152 C°
- Дипольный момент: 1,15 Дебай
- Диэлектрическая проницаемость: 4,806 при 20 °C
Химические свойства
Образует азеотропную смесь с водой (т. кип. 56,2 °C, 97,4 % хлороформа).
Получение
В промышленности хлороформ производят хлорированием метана или хлорметана. Реакционную смесь нагревают до температуры 400—500 °C. При этом происходит серия химических реакций. Подобное происходит также при освещении смеси ультрафиолетом.



Результатом процесса является смесь, состоящая из метилхлорида, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется дистилляцией.
В лаборатории хлороформ можно получить также по реакции между ацетоном или этанолом и хлорной известью.
Также получить хлороформ в домашних условиях можно путём нагревания трихлоруксусной кислоты до 75 °C.
Поступающий в продажу хлороформ содержит этиловый спирт (1—2 %) в качестве стабилизатора, который связывает образующийся при длительном хранении на свету и в присутствии кислорода фосген. Хлороформ применяют в пробе Бейльштейна, в этой реакции наблюдается окрашивание пламени в голубовато-зелёный цвет ионами меди.
Применение
В конце XIX и начале XX веков хлороформ использовался как анестетик при проведении хирургических операций. Впервые как средство для наркоза хлороформ был применён при хирургических операциях английским врачом Симпсоном (1848 г.). В России хлороформ как средство для общего наркоза впервые применил Н. И. Пирогов. Однако в данной роли хлороформ впоследствии был заменён более безопасными веществами.
Хлороформ используется для производства хлордифторметана — фреона (хладона) 22 путём реакции обмена атомов хлора на фтор при обработке хлороформа безводным фтористым водородом в присутствии хлорида сурьмы(V) (по реакции Свартса) [2] [3] :
Хлороформ также используется в качестве растворителя в фармакологической промышленности, а также для производства красителей и пестицидов. Хлороформ, содержащий дейтерий (CDCl3) — наиболее общий растворитель, используемый в ядерном магнитном резонансе (ЯМР).
Очистка
Процесс очистки делится на ряд этапов. Сперва хлороформ встряхивают с концентрированной серной кислотой, промывают водой, сушат над хлоридом кальция либо сульфатом магния и перегоняют. Проверить на чистоту хлороформ можно испарением с фильтровальной бумаги: после хлороформа не должно оставаться запаха. Затхлый, резкий, раздражающий запах говорит о наличии примесей хлора, хлороводорода или фосгена.
Воздействие на организм
Вдыхание хлороформа пагубно влияет на работу центральной нервной системы. Вдыхание около 900 частей хлороформа на 1 миллион частей воздуха за короткое время может вызвать головокружение, усталость и головную боль. Постоянное воздействие хлороформа может вызвать заболевания печени и почек. Приблизительно 10 % населения Земли имеют аллергическую реакцию на хлороформ, приводящую к повышению температуры тела (до 40 °C). Часто вызывает рвоту (частота послеоперационной рвоты достигала 75—80 %).
Исследования на животных показали, что у беременных крыс и мышей, которые дышали смесью, содержащей 30 частей хлороформа на 1 миллион частей воздуха, происходили выкидыши. Также такое наблюдалось у крыс, которым давали хлороформ через рот. Следующие поколения крыс и мышей, которые вдыхали хлороформ, имели больший процент врождённых дефектов, чем у здоровых особей.
Влияние хлороформа на размножение у людей не достаточно хорошо изучено. При длительном воздействии на дыхательные пути и слизистые оболочки человека (2—10 минут) возможен летальный исход. Предположительно мутагенен и канцерогенен. Данные свойства проявляются только при превышении концентрации хлороформа в воздухе.
Примечания
- ↑Хлороформ ⌬ органические растворители на Chemical Region
- ↑ Промышленные фторорганические продукты: справочное издание / Б.Н. Максимов, В.Г. Барабанов, И.Л. Серушкин и др.. — 2-е, перераб. и доп.. — СПб: «Химия», 1996. — 544 с. — ISBN 5-7245-1043-X
- ↑Верещагина Н.С., Голубев А.Н., Дедов А.С., Захаров В.Ю. Российский химический журнал.Журнал российского химического общества им. Д.И. Менделеева. — 2000. — Т. XLIV, вып. 2. — С. 110—114.
- Обновить статью, актуализировать данные.
- Проверить достоверность указанной в статье информации.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Хлороформ» в других словарях:
хлороформ — хлороформ … Орфографический словарь-справочник
ХЛОРОФОРМ — (ново лат., от греч. chloros хлор, и лат. forma вид). Жидкое, бесцветное вещество, эфирного запаха, остро сладкого вкуса, имеющее свойство усыплять и приводить в бесчувственное состояние. Словарь иностранных слов, вошедших в состав русского языка … Словарь иностранных слов русского языка
ХЛОРОФОРМ — ( Сhloroformium ). Трихлорметан. Синонимы: Chloroformium Anaesthesicum, Аnеsthetic Сhloroform. Бесцветная, прозрачная, тяжелая, подвижная, летучая жидкость с характерным запахом и сладким жгучим вкусом. Смешивается во всех соотношениях с… … Словарь медицинских препаратов
ХЛОРОФОРМ — ХЛОРОФОРМ, Chloroformium (ФУИ), три хлорметан, СНС13, бесцветная прозрачная жидкость своеобразного сладковатого запаха и жгучего вкуса. Уд. в. 1,502 (при 15°), темп. кип. 61 62°. X. смешивается во всех пропорциях со спиртом, эфиром,… … Большая медицинская энциклопедия
ХЛОРОФОРМ — (трихлорметан) СНСl3, бесцветная жидкость, tкип 61,2 .С. Хороший растворитель жиров, смол и других веществ; исходное сырье для получения хладонов. Входит в составы для растирания, используемые при мышечных и невралгических болях. Специально… … Большой Энциклопедический словарь
Хлороформ — (хим.). Х., или трихлорометан, CHCl3 получается перегонкой спирта с белильной известью. Для этой цели употребляют железные цилиндрические сосуды вышиной около 1,5 м и в диаметре около 2 м; они имеют мешалку, трубки для пропускания пара и воды и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
хлороформ — а, м. chloroforme m. Летучая жидкость, содержащая хлор, с характерным запахом и сладким вкусом, сильное наркотическое средство. БАС 1. Эта жидкость, года за три пред сим открытая Субейраном, возбудила всеобщее любопытство по своему… … Исторический словарь галлицизмов русского языка
Хлороформ — ХЛОРОФОРМ, CHCl3, бесцветная тяжёлая жидкость, tкип 61,2°C. Растворитель жиров, смол и других веществ; исходное сырьё для получения хладонов. Входит в составы для растирания, используемые при мышечных и невралгических болях. Специально очищенный… … Иллюстрированный энциклопедический словарь
ХЛОРОФОРМ — (Трихлорметан, СНСl3), бесцветная летучая жидкость со сладковатым запахом, которую получают хлорированием метана. Ранее служил основным анестезирующим средством. Используется в производстве фтороуглеродов, в медицине (например, при рвоте), а… … Научно-технический энциклопедический словарь
ХЛОРОФОРМ — ХЛОРОФОРМ, хлороформа, мн. нет, муж. (от греч. chloros зеленый и лат. acidum formicum муравьиная кислота) (мед.). Бесцветная летучая жидкость с сладковатым запахом, содержащая хлор, употр. как средство для общего наркоза. Толковый словарь Ушакова … Толковый словарь Ушакова
Источник