Карбонат кальция: способы получения и химические свойства
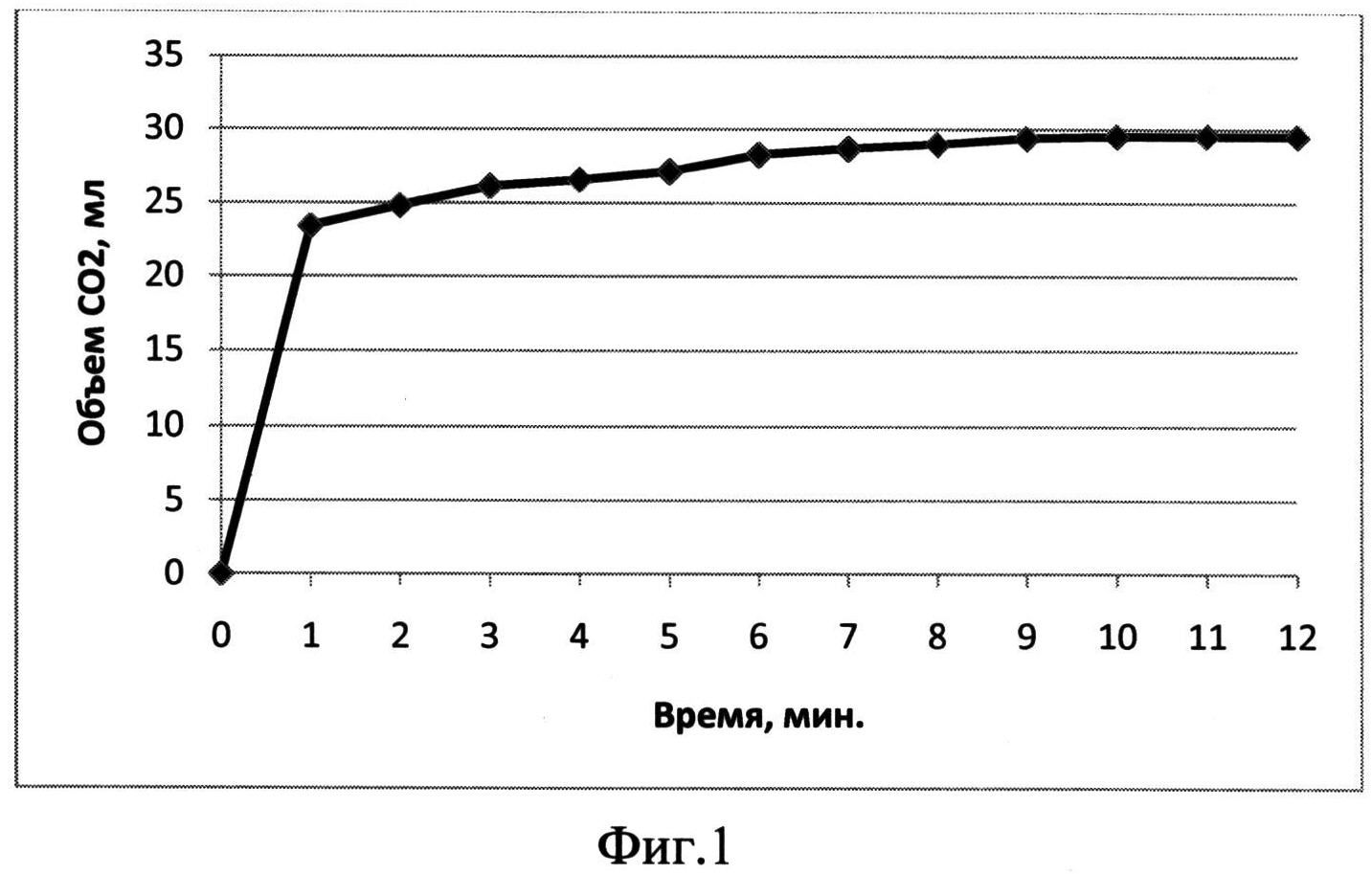
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция , образуется карбонат кальция и хлорид натрия:
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
Источник
Как приготовить раствор карбоната кальция
Изобретение относится к способам получения карбонатов кальция и может быть использовано в фармацевтической промышленности, в парфюмерии и при изготовлении пищевых добавок.
Известен способ получения осажденного карбоната кальция (GB №921077, МПК C01F 11/18, опубл. 13.03.1963 г.), согласно которому карбонат кальция получают реакцией водных растворов солей кальция, например нитрата или хлорида, с водными растворами карбоната аммония, натрия или калия в присутствии водорастворимых фторидов, например фторидов натрия, калия или аммония. Фторид используется предпочтительно в пропорции 0,05-5 вес. частей на 100 вес. частей карбоната. По окончании осаждения получаемой реакционной смеси ее перемешивают в течение 2-3-х минут и затем фильтруют, причем фильтрат не содержит измеримых количеств фтора.
Основной недостаток этого способа заключается в том, что карбонат кальция, полученный таким образом, содержит большое количество фтора (до 5%). Однако употребление большого количества фтора перорально, особенно детьми, вредно для здоровья.
Наиболее близким к предложенному способу по существу является выбранный нами за прототип способ получения тонкодисперсного карбоната кальция (RU 2314999, МПК C01F 11/18, опубл. 20.01.2008 г.), включающий осаждение карбоната кальция реакцией водных растворов солей кальция с водными растворами карбонатов и отделение карбоната кальция от раствора фильтрованием, при этом реакцию проводят в присутствии катионного поверхностно-активного вещества при температуре не ниже 85°С и при воздействии ультразвуком.
Основной недостаток этого способа заключается в том, что полученный этим способом карбонат кальция не повышает биодоступность триглицеридов, что показывают приведенные ниже результаты экспериментов (табл.1, образец 15).
Основным техническим результатом предложенного изобретения является повышение биодоступности триглицеридов за счет эмульгирующего действия на них полученного заявляемым способом карбоната кальция, а также за счет увеличения в 2-3 раза глубины гидролиза триглицеридов на карбонате кальция при малых значениях их перекисного числа.
Указанный технический результат заявляемого способа достигается тем, что в способе получения карбоната кальция, включающем осаждение карбоната кальция реакцией водных растворов солей кальция с водными растворами карбонатов в присутствии поверхностно-активного вещества при температуре не ниже 85°С и отделение карбоната кальция от раствора фильтрованием, согласно предложенному решению в водные растворы карбонатов добавляют растворимые фосфаты в молярном соотношении фосфатов к карбонатам 1:100-1:20, используют неионогенное поверхностно-активное вещество, а в водные растворы солей кальция добавляют жидкое стекло в молярном соотношении жидкого стекла к солям кальция 1:1000-1:100, причем в качестве водных растворов карбонатов используют растворы карбоната калия или карбоната натрия, в качестве растворимых фосфатов используют гидрофосфат калия или дигидрофосфат калия, а в качестве водных растворов солей кальция используют растворы хлорида кальция или нитрата кальция.
Примеры конкретного выполнения
Пример 1. К 200 мл 0,1 М раствора карбоната калия добавляют дигидрофосфат калия в молярном соотношении фосфата к карбонату 1:100 и 0,04 г неионогенного ПАВ Твин-80. К 200 мл 0,1 М раствора нитрата кальция добавляют жидкое стекло в молярном соотношении жидкого стекла к соли кальция 1:180. Осаждение карбоната кальция проводят реакцией водного раствора соли кальция с водным раствором карбоната при температуре 85°С. Затем проводят отделение карбоната кальция от раствора фильтрованием, осадок сушат и получают порошок карбоната кальция (табл.1, образец 3).
Пример 2. К 100 мл 1 М раствора карбоната натрия добавляют гидрофосфат калия в молярном соотношении фосфата к карбонату 1:30 и 0,03 г неионогенного ПАВ Твин-40. К 100 мл 1 М раствора соли кальция CaCl2 добавляют жидкое стекло в молярном соотношении жидкого стекла к соли кальция 1:1000. Осаждение карбоната кальция проводят реакцией водного раствора соли кальция с водным раствором карбоната при температуре 85°С. Затем проводят отделение карбоната кальция от раствора фильтрованием, осадок сушат и получают порошок карбоната кальция (табл.1, образец 9).
В качестве неионогенного ПАВ могут быть использованы также Твин-60, Твин-20 и СПЭНы, так как их свойства аналогичны.
Полученный заявленным способом карбонат кальция обладает способностью повышать биодоступность триглицеридов при их пероральном приеме. Для проверки этого в порошок карбоната кальция добавляют до насыщения триглицерид — рыбий жир — методом стеклянной палочки, описанным в ГОСТ 21119.8-75 (ИСО 787-5-80), и измеряют маслоемкость. Маслоемкость карбоната кальция, полученного в примерах 1 и 2, для рыбьего жира составила 55,8 г/100 г и 67,1 г/100 г соответственно.
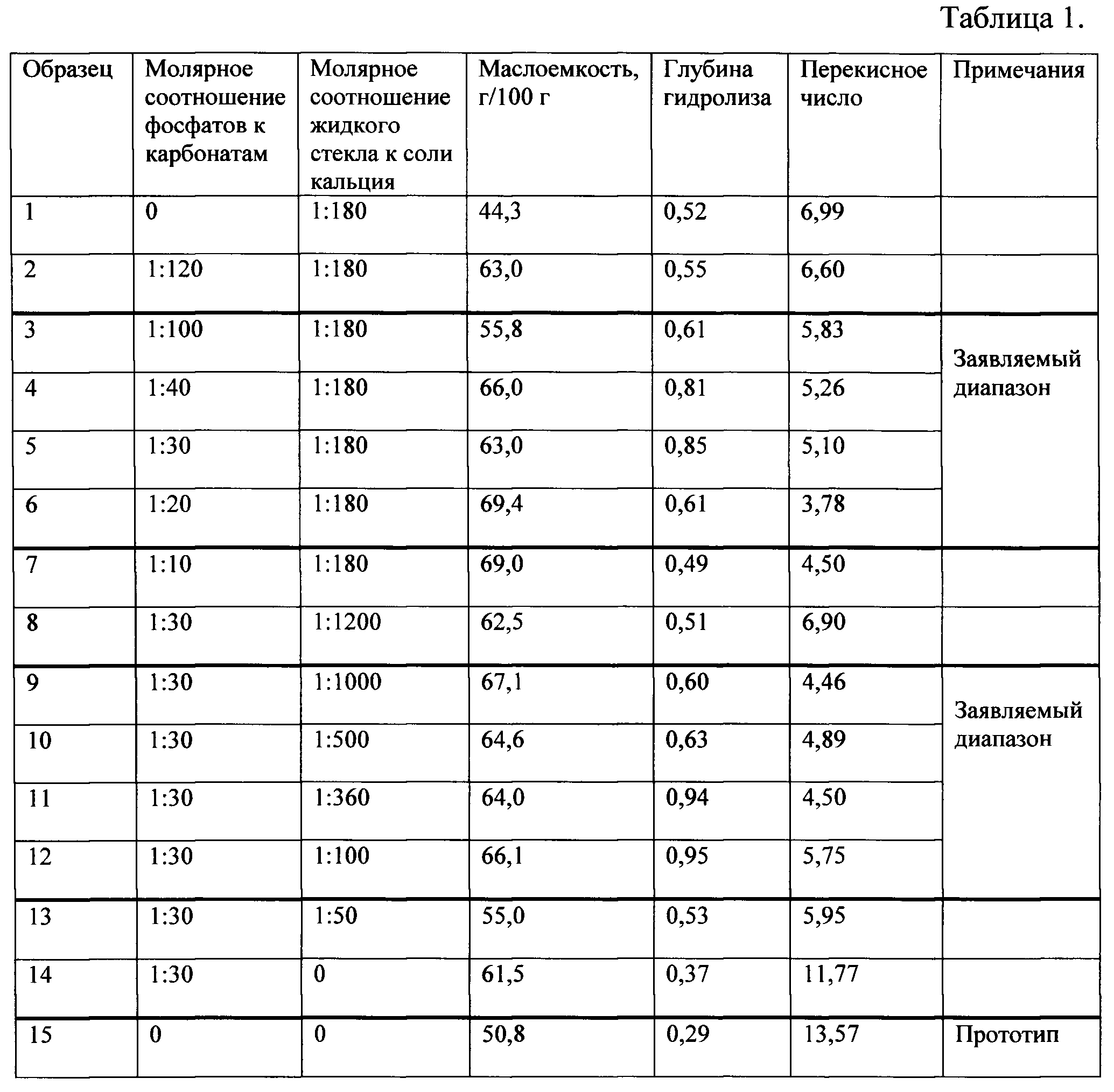
Затем порошку карбоната кальция, насыщенного рыбьим жиром, придают форму таблетки и проводят ее растворение при температуре 37°С в растворе HCl с добавкой ацидинпепсина (рН 2). Известно, что скорость растворения таблетки лекарственного вещества определяет скорость и полноту всасывания лекарственного вещества в крови, т.е. биодоступность препарата [Э.А.Коржавых, А.С.Румянцев. Таблетки и их разновидности. // Российские аптеки, 2003, №12. — С.16-20]. Следовательно, повышая растворимость таблетки в желудочном соке, можно увеличивать биодоступность находящихся в ней веществ. Кинетика растворения в растворе соляной кислоты полученного заявленным способом карбоната кальция (образец 3) приведена на фиг. 1.
Как видно из фиг. 1, таблетка из карбоната кальция, насыщенного рыбьим жиром, растворяется в растворе соляной кислоты в течение 10 мин. При этом образуется однородная эмульсия белого цвета, состоящая из очень мелких капель рыбьего жира.
В организме человека эмульгирующее действие на триглицериды оказывают соли желчных кислот, которые резко уменьшают поверхностное натяжение на поверхности раздела жир/вода. Это облегчает воздействие на жиры липазы панкреатического сока, которая действует только на те триглицериды, которые находятся в форме эмульсии [Т.Т.Березов, Б.Ф.Коровкин. Биологическая химия. — М.: Медицина, 1998. — с. 188]. Эмульгирование триглицеридов на карбонате кальция, полученном заявляемым способом, приводит к расщеплению и всасыванию их уже в желудке, что повышает биодоступность триглицеридов и жирорастворимых веществ, в том числе витаминов А, Е, D, F и К.
Кроме того, увеличение биодоступности рыбьего жира достигают также вследствие того, что на карбонате кальция, полученном заявляемым способом, происходит гидролиз рыбьего жира, т.е. разложение жира с выделением свободных жирных кислот, в результате продукты гидролиза могут всасываться в желудке и 12-перстной кишке. При этом перекисное число значительно не увеличивается, а это означает, что нежелательного окисления жиров практически не происходит. Обычно гидролиз жиров в организме происходит под действием липазы панкреатического сока, и всасывание продуктов гидролиза идет только в тонком кишечнике [там же, с. 363].
Глубину гидролиза рыбьего жира, смешанного с карбонатом кальция, полученным заявляемым способом, определяют по известной методике [Определение глубины гидролиза жира / Лабораторный практикум по технологии переработки жиров. — М.: ВО Агропромиздат, 1991. — С.98], а перекисное число — по ГОСТу [ГОСТ Р 51487-99. Масла растительные и животные. Метод определения перекисного числа]. Результаты измерений для образцов карбоната кальция, полученных при различных молярных соотношениях исходных компонентов, приведены в табл.1.
Как видно из табл.1, величина глубины гидролиза триглицеридов на карбонате кальция, полученном по заявляемому способу, в 2-3 раза больше по сравнению с прототипом. При этом значения перекисного числа минимальны.
Результаты измерений глубины гидролиза и перекисного числа для образца 5 при использовании в качестве триглицеридов льняного масла, витамина Е и чесночного масла представлены в табл.2.
Таким образом, предложенное изобретение обеспечивает повышение биодоступности триглицеридов за счет эмульгирующего действия на них полученного заявляемым способом карбоната кальция, а также за счет увеличения в 2-3 раза глубины гидролиза триглицеридов на карбонате кальция при малых значениях их перекисного числа.
Способ получения карбоната кальция, включающий осаждение карбоната кальция реакцией водных растворов солей кальция с водными растворами карбонатов в присутствии поверхностно-активного вещества при температуре не ниже 85°С и отделение карбоната кальция от раствора фильтрованием, отличающийся тем, что в водные растворы карбонатов добавляют растворимые фосфаты в молярном соотношении фосфатов к карбонатам 1:100-1:20, используют неионогенное поверхностно-активное вещество, а в водные растворы солей кальция добавляют жидкое стекло в молярном соотношении жидкого стекла к солям кальция 1:1000-1:100, причем в качестве водных растворов карбонатов используют растворы карбоната калия или карбоната натрия, в качестве растворимых фосфатов используют гидрофосфат калия или дигидрофосфат калия, а в качестве водных растворов солей кальция используют растворы хлорида кальция или нитрата кальция.
Источник
Карбонат кальция
| Карбонат кальция | |||
|---|---|---|---|
| |||
 | |||
| Систематическое наименование | карбонат кальция | ||
| Традиционные названия | углекислый кальций | ||
| Хим. формула | CaCO3 | ||
| Состояние | твёрдые белые кристаллы | ||
| Молярная масса | 100.0869 г/моль | ||
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ | ||
| Температура | |||
| • плавления | (кальцит) 825 °C, (арагонит) 1339 °C | ||
| • разложения | 900−1000 °C | ||
| Давление пара | 0 ± 1 мм рт.ст. | ||
| Константа диссоциации кислоты pKa | 9.0 | ||
| Растворимость | |||
| • в воде | (25 °C) 0,0014 г | ||
| Показатель преломления | 1,60 | ||
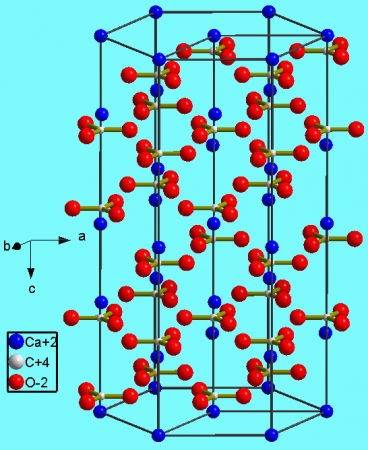
| Кристаллическая структура | тригональная, пространств. гр. 2/m | ||
| ГОСТ | ГОСТ 4530-76 | ||
| Рег. номер CAS | 471-34-1 | ||
| PubChem | 10112 | ||
| Рег. номер EINECS | 207-439-9 | ||
| SMILES | |||
| Кодекс Алиментариус | E170 | ||
| RTECS | FF9335000 | ||
| ChEBI | 3311 | ||
| ChemSpider | 9708 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3 .
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Содержание
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
Источник