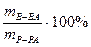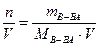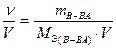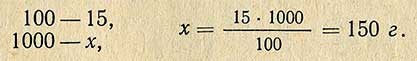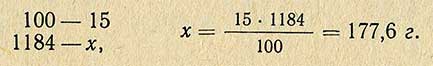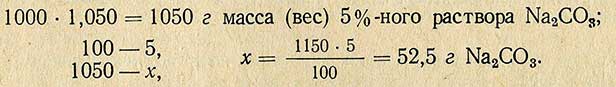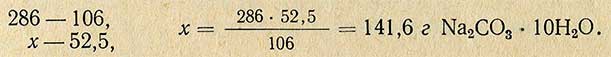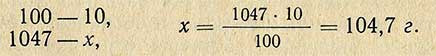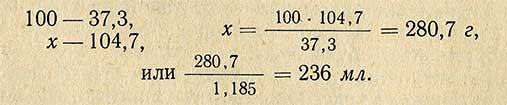Приготовление раствора кислоты заданной концентрации



Теоретические основы. Растворы — это гомогенные системы переменного состава. Они состоят из растворителя и растворенного вещества, соотношение между которыми определяется концентрацией раствора.
Способы выражения концентрации раствора:
а) массовая доля раствора (процентная концентрация) показывает массу растворенного вещества в 100 г раствора

(например, 3% раствор NaOH или w(NaOH)=3%, w(NaOH)=0,03);

СМ =
(например 2 М раствор HCl или СМ (HCl)= 2 моль/л);
в) молярная концентрация эквивалента (нормальная концентрация или нормальность) показывает количество эквивалентов вещества в 1 л раствора

(например, 0,1N раствор НNO3 или CN(НNO3)= 0,1 моль/л).
Цель работы. По плотности исходного раствора соляной кислоты, экспериментально определенной с помощью ареометра, найти по таблице его концентрацию. Рассчитать объем концентрированного раствора соляной кислоты и воды, необходимые для приготовления требуемого объема кислоты заданной концентрации. Приготовить раствор кислоты.
Порядок работы.
1. Налейте исходный раствор кислоты в цилиндр без делений примерно на половину его объема.
2. Осмотрите ареометры. Ареометр, рассчитанный на измерение меньших плотностей, опустите в раствор кислоты в мерном цилиндре. Если шкала ареометра полностью находится над поверхностью, замените его на другой — для измерения больших плотностей. Для снятия показаний на шкалу смотрят несколько снизу, сквозь толщу раствора. Верхняя видимая при этом метка соответствует плотности раствора (r).
3. В таблице зависимости плотности раствора от концентрации (см. приложение 2) найдите массовую долю раствора соляной кислоты. При необходимости проведите интерполяцию (см. приложение 3).
4. Рассчитайте объемы исходного раствора Vисх и дистиллированной воды, необходимые для приготовления 250 мл 0,1 N раствора соляной кислоты.
5. Мерным цилиндром объемом 10 мл отмерьте в склянку рассчитанный объем исходного раствора НCl и мерным цилиндром объемом 250 мл — рассчитанный объем дистиллированной воды.
6. Закройте склянку пробкой и перемешайте содержимое, опрокидывая склянку не менее 20 раз.
7. На листе бумаги запишите: “HCl 
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Задание: приготовить 250 мл 0,1 N раствора соляной кислоты. Образец концентрированной кислоты № . .
4. Характеристика исходного раствора соляной кислоты:
плотность r = .
массовая доля исходного раствора кислоты w = . .
а) масса соляной кислоты, содержащаяся в 250 мл 0,1 N раствора соляной кислоты
mHCl = MЭ (HCl) 
б) масса исходного раствора соляной кислоты, содержащая рассчитанное количество соляной кислоты
mисх .р-ра = 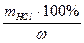
в) объем исходного раствора соляной кислоты
Vисх.р-ра = mисх. р-ра / r = .
г) объем дистиллированной воды
Vводы = 250 — Vисх .р-ра = .
Источник
Растворы процентной концентрации
Приготовление растворов. Раствором называют однородные смеси двух или более веществ. Концентрацию раствора выражают по-разному:
в весовых процентах, т.е. по количеству граммов вещества, содержащегося в 100 г раствора;
в объемных процентах, т.е. по количеству единиц объема (мл) вещества в 100 мл раствора;
молярностью, т.е. количеством грамм-молей вещества, находящегося в 1 л раствора (молярные растворы);
нормальностью, т.е. количеством грамм-эквивалентов раствореного вещества в 1 л раствора.
Растворы процентной концентрации. Процентные растворы готовят как приблизительные, при этом навеску вещества отвешивают на технохимических весах, а объемы отмеривают измерительными цилиндрами.
Для приготовления процентных растворов пользуются несколькими приемами.
Пример. Необходимо приготовить 1 кг 15%-ного раствора хлористого натрия. Сколько необходимо для этого взять соли? Расчет проводится согласно пропорции:
Следовательно воды для этого необходимо взять 1000-150 = 850 г.
В тех случаях, когда надо приготовить 1 л 15%-ного раствора хлористого натрия, необходимое количество соли рассчитывают другим способом. По справочнику находят плотность этого раствора и, умножив ее на заданный объем, получают массу необходимого количества раствора: 1000-1,184 = 1184 г.
Следовательно, необходимое количество хлористого натрия различно для приготовления 1 кг и 1 л раствора. В тех случаях, когда приготовляют растворы из реактивов, содержащих в составе кристаллизационную воду, следует ее учитывать при расчете необходимого количества реактива.
Пример. Необходимо приготовить 1000 мл 5%-ного раствора Na2CO3 плотностью 1,050 из соли, содержащей кристаллизационную воду (Na2CO3-10H2O)
Молекулярная масса (вес) Na2CO3 равна 106 г, молекулярная масса (вес) Na2CO3-10H2O равна 286 г, отсюда рассчитывают необходимое количество Na2CO3-10H2O для приготовления 5%-ного раствора:
Методом разбавления растворы приготовляют следующим образом.
Пример. Необходимо приготовить 1 л 10%-ного раствора HCl из раствора кислоты относительной плотностью 1,185 (37,3%). Относительная плотность 10%-ного раствора 1,047 (по справочной таблице), следовательно, масса (вес) 1 л такого раствора равна 1000X1,047 = 1047 г. В этом количестве раствора должно содержаться чистого хлористого водорода
Чтобы определить, сколько необходимо взять 37,3%-ной кислоты, составляем пропорцию:
При приготовлении растворов путем разбавления или смешивания двух растворов для упрощения расчетов применяют способ диагональной схемы или «правило креста». На пересечении двух линий пишется заданная концентрация, а у обоих концов слева — концентрация исходных растворов, для растворителя она равна нулю.
Источник
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ
ТЕМА: Растворы. Способы выражения концентрации. Приготовление раствора заданной концентрации.
Цель: Научиться навыкам проведения расчетов, необходимых для приготовления растворов различных концентраций и умению готовить такие растворы.
Задачи:
1. Ознакомиться со способами выражения концентрации растворов.
2. Разобрать обучающие задачи по расчету концентрации растворов.
3. Подготовиться к лабораторной работе «Приготовление раствора соли заданной концентрации».
Студент должен знать:
1. до изучения темы: Понятия массовой доли, количества вещества, концентрации раствора и их взаимную связь.
2. после изучения темы: Понятия: раствор, растворитель, растворенное вещество; особенности структуры воды в жидком и твердом состояниях; растворимость твердых веществ, газов в воде; факторы, влияющие на растворимость; способы выражения концентрации растворов: по растворению точной навески (объема) сухого вещества, кристаллогидрата, газа; из концентрированного раствора путем его разбавления; из разбавленного раствора путем его концентрирования.
Студент должен уметь: Проводить необходимые расчеты для приготовления раствора с заданной концентрацией раствора. Пользоваться аналитическими весами, мерной посудой (пипетки, бюретки, мерные пробирки, цилиндры, мензурки) и химическими приборами (ареометр).
Теоретическое введение
Растворы играют важную роль в живой и неживой природе, а также в науке и технике.
Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами.
Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации:
1. Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
2. Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации кг/м 3 , г/л.
3. Титр Т – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см 3 .
4. Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения — моль/м 3 , (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1М; 0,5 моль/л, обозначают 0,5 М.
5. Молярная концентрация эквивалентов сэк (нормальная концентрация) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, сэк(KOH) = 1 моль/л, сэк(1/2H2SO4) = 1 моль/л, сэк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н.
6. Моляльность b — это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности — моль/кг. Например, b(HCl/H2O) = 2 моль/кг.
7. Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1).
Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду: мерные колбы, пипетки и бюретки.
Мерные колбы – тонкостенные плоскодонные сосуды с длинным узким горлом, на котором нанесена метка в виде кольцевой черты. На каждой колбе обозначены ее емкость и температура, при которой эта емкость измерена. Колба должна плотно закрываться пробкой (рис.1).
Рис. 1 Мерная посуда
а — мерная колба; б – пипетки; в – бюретка.
Пипетки используют для отбора определенного объема пробы жидкости.
Пипетки Мора представляют собой стеклянные трубки с расширением посередине. Нижний конец оттянут в капилляр, на верхнем конце нанесена метка, до которой следует набирать измеряемую жидкость. На пипетке указана объемность.
Широко применяют также градуированные пипетки различной емкости, на наружной стенке которых нанесены деления. Для наполнения пипетки нижний конец ее опускают в жидкость и втягивают последнюю при помощи груши или специального приспособления. Жидкость набирают так, чтобы она поднялась на 2-3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем правой руки, придерживая в то же время пипетку большим и средним пальцами. Затем ослабляют нажим указательного пальца, в результате чего жидкость будет медленно вытекать из пипетки. В тот момент, когда нижний мениск (уровень) жидкости окажется на одном уровне с меткой, палец снова прижимают. Введя пипетку в сосуд, отнимают указательный палец и дают жидкости стечь по стенке сосуда. После того, как жидкость вытечет, пипетку держат еще 5секунд прислоненной к стенке сосуда, слегка поворачивая вокруг оси.
Бюретки применяют при титровании, для измерения точных объемов и т.д.
ЛАБОРАТОРНАЯ РАБОТА
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ
Опыт 1. Приготовление растворов кислот заданной концентрации
Раствор готовится разбавлением более концентрированного раствора исходной кислоты.
В соответствии со своим вариантом (таблица 1) рассчитайте (с точностью до десятых долей миллилитра) объемы кислот, необходимые для приготовления указанного объема раствора с заданной концентрацией.
Таблица 1. Варианты для выполнения опыта 1
| Вариант | Н2SO4 | HNO3 | HCl |
| 0,1М | 0,01н | 12% | |
| 0,01н | 0,1М | 8% | |
| 0,001М | 0,05н | 4% | |
| 0,05н | 0,001М | 6% | |
| 0,005М | 0,025н | 2% | |
| 0,025н | 0,005М | 10% | |
| 20% | 1М | 0,01н | |
| 26% | 0,02н | 0,1М | |
| 30% | 0,01М | 0,05н | |
| 38% | 0,25н | 0,001М | |
| 40% | 0,005М | 0,025н | |
| 0,025н | 60% | 0,005М | |
| 0,8М | 56% | 1н | |
| 0,5н | 18% | 2М | |
| 0,75н | 10% | 0,5М |
Пользуясь таблицей «Плотность растворов некоторых кислот при 20°С», определите процентную концентрацию исходной кислоты.
Плотность растворов некоторых кислот при 20°С (г/мл)
| Массовая доля, % | H2SO4 | HNO3 | HCl |
| 1.0116 | 1.0091 | 1.0081 | |
| 1.0250 | 1.0202 | 1.0179 | |
| 1.0385 | 1.0314 | 1.0278 | |
| 1.0522 | 1.0427 | 1.0377 | |
| 1.0661 | 1.0543 | 1.0476 | |
| 1.0802 | 1.0660 | 1.0576 | |
| 1.0947 | 1.0780 | 1.0676 | |
| 1.1094 | 1.0901 | 1.0777 | |
| 1.1245 | 1.1025 | 1.0878 | |
| 1.1398 | 1.1150 | 1.0980 | |
| 1.1554 | 1.1277 | 1.1083 | |
| 1.1714 | 1.1406 | 1.1185 | |
| 1.1872 | 1.1536 | 1.1288 | |
| 1.2031 | 1.1668 | 1.1391 | |
| 1.2191 | 1.1801 | 1.1492 | |
| 1.2353 | 1.1934 | 1.1594 | |
| 1.2518 | 1.2068 | 1.1693 | |
| 1.2685 | 1.2022 | 1.1791 | |
| 1.2855 | 1.2335 | 1.1886 | |
| 1.3028 | 1.2466 | 1.1977 | |
| 1.3205 | 1.259 | ||
| 1.3386 | 1.272 | ||
| 1.3570 | 1.285 | ||
| 1.3759 | 1.297 | ||
| 1.3952 | 1.310 | ||
| 1.4149 | 1.322 | ||
| 1.4351 | 1.333 | ||
| 1.4558 | 1.345 | ||
| 1.4770 | 1.356 | ||
| 1.4987 | 1.367 | ||
| 1.520 | 1.377 | ||
| 1.542 | 1.386 | ||
| 1.565 | 1.396 | ||
| 1.587 | 1.405 | ||
| 1.6105 | 1.413 | ||
| 1.634 | 1.422 | ||
| 1.657 | 1.430 | ||
| 1.681 | 1.437 | ||
| 1.704 | 1.445 | ||
| 1.7272 | 1.452 | ||
| 1.749 | 1.459 | ||
| 1.769 | 1.465 | ||
| 1.802 | 1.477 | ||
| 1.8144 | 1.482 | ||
| 1.8240 | 1.487 | ||
| 1.8312 | 1.409 | ||
| 1.8355 | 1.497 | ||
| 1.8361 | 1.505 | ||
| 1.8305 | 1.513 |
Пример 1. Нужно узнать объем 96% Н2SO4 (ρ=1,8355 г/мл), необходимый для приготовления 500мл 1М раствораН2SO4.
См = 
Вычислим, в какой массе 96% раствора содержится 49г Н2SO4:
ω%= 


Переведем массу 96% раствора Н2SO4 в объем, учитывая плотность:
ρ= 

Если необходимо приготовить раствор Н2SO4 с заданной нормальностью, расчеты ведут аналогично, но при расчете необходимой массы кислоты вместо формулы 1 пользуются формулой:
Сн = 
Пример 2. Нужно узнать объем 36% HCl (ρ=1,1791 г/мл), необходимый для приготовления 250 мл 20% раствора НСl (ρ= 1,0980 г/мл).
Найдем массу 250 мл 20% раствора НСl:
ρ= 
Узнаем массу кислоты, необходимую для приготовления 247,5 г 20% раствора НСl:
ω%= 
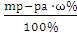

Вычислим, в какой массе 36% раствора содержится 54,9 г НСl:
ω%= 


Переведем массу 36% раствора НСl в объем, учитывая плотность:
ρ= 

Результат запишите в таблицу
| № | Объем раствора кислоты | Объем воды |
Проверьте правильность своих расчетов, показав их преподавателю.
Растворы готовятся в мерной колбе объемом 100 мл. Внимание! Разбавление концентрированных кислот (особенно Н2SO4) следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Запомните: Сначала вода, потом – кислота! Иначе случится большая беда! Мерную колбу примерно наполовину заполните дистиллированной водой. Отберите вычисленный объем исходной кислоты в пипетку и перенесите кислоту в мерную колбу. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться. Аккуратно доведите объем раствора до метки дистиллированной водой. Закройте колбу пробкой и, придерживая пробку пальцем, тщательно перемешайте, переворачивая колбу 8-10 раз вверх дном так, чтобы воздушный пузырь перемещался через всю колбу.
Опыт 2. Приготовление раствора соли с заданной массовой долей (%) из навески соли
Рассчитайте, сколько граммов соли и воды потребуются для приготовления 100 г раствора соли заданной концентрации в соответствии со своим вариантом (таблица 3).
Таблица 3. Варианты для выполнения опыта 2
| Вариант | КВr | MgSO4∙7Н2О | NaH2PO4∙2Н2О |
| 1% | 14% | 4% | |
| 3% | 10% | 7% | |
| 5% | 12% | 1% | |
| 8% | 6% | 10% | |
| 10% | 3% | 15% | |
| 14% | 1% | 9% | |
| 0,5% | 24% | 2% | |
| 20% | 0,5% | 7% | |
| 2% | 20% | 0,5% | |
| 40% | 5% | 20% | |
| 9% | 16% | 5% | |
| 24% | 5% | 16% | |
| 6% | 18% | 3% | |
| 4% | 20% | 32% | |
| 30% | 7% | 40% |
Пример 1. Нужно узнать какую массу медного купороса CuSO4∙5Н2О и какой объем воды необходимо взять для приготовления 500 г раствора с массовой долей 16 %.
Найдем массу CuSO4, необходимую для приготовления 500г 16% раствора:
ω%= 


М(CuSO4) = 64∙2+32+16∙4=160 г/моль.
Учитывая, что приготовление раствора производится из кристаллогидрата CuSO4∙5Н2О, составим пропорцию:
х= 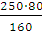
Находим массу воды:
значит m(Н2О)= m(р-ра) — m(CuSO4∙5Н2О)=500-125=375 г или 375 мл.
В том случае, если раствор готовится из безводной соли, используют формулы 1 и 2 и не прибегают к составлению пропорции:
m (CuSO4)= 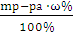
Результат запишите в таблицу
| № | Масса навески соли | Масса воды |
Проверьте правильность расчета, показав его преподавателю.
Взвесьте на лабораторных весах нужное количество соли и высыпьте ее в стакан. Вылейте в этот стакан необходимое количество воды. Воду необходимо приливать постепенно, все время перемешивая раствор. После полного растворения соли приготовленный раствор перелейте в цилиндр и измерьте ареометром его плотность. По плотности с помощью таблицы «Плотность растворов некоторых солей при 20°С» определите массовую долю соли в приготовленном растворе. Совпадает ли она с рассчитанной вами?
Плотность растворов некоторых солей при 20°С(г/мл)
Источник