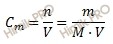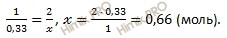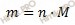- Методика приготовления раствора тиосульфата натрия.
- Химик.ПРО – решение задач по химии бесплатно
- Решение задачи
- Ответ:
- 1 Приготовление и стандартизация рабочего раствора тиосульфата натрия (Na2s2o3)
- Экспериментальная часть. Приготовление и стандартизация раствора С(Na2S2O3)=0,1 моль/дм3
- Лабораторная работа №2. Метод иодометрии. Приготовление точного раствора Na2S2O3 и крахмала.
Методика приготовления раствора тиосульфата натрия.
0,1 н. раствор тиосульфата натрия готовят, взвешивая навеску Na2S2O3*5H2O, также при- близительно равную 0,1 моль. Навеску растворяют в 500 мл воды, добавляют 0,1 г Na2CO3 и доводят водой до 1000 мл.
Стандартные растворы тиосульфата натрия нельзя готовить по точной навеске, так как кристаллический пентагидрат Na2S2O3•5Н2О при хранении частично обезвоживается. Поэтому вначале готовят раствор с приблизительной концентрацией тиосульфата натрия, а затем его стандартизуют.
Растворы тиосульфата натрия при хранении изменяют свой титр.
1)неустойчивость тиосульфат-ионов, которые разлагаются в кислой среде с выделением свободной серы (раствор мутнеет):
и окисляются кислородом воздуха также с выделением свободной серы:
Кроме того поглощают СО2 из воздуха
Растворы тиосульфата натрия наиболее устойчивы при рН= 9—10, поэтому для стабилизации растворов в них вводят небольшое количество карбоната натрия Na2CО3, или гидросульфата натрия NaHSO4,т.к. в их присутствии реакции замедляются(равновесие смещается влево).
2)Тиосульфат-ионы в водном растворе разлагаются на свету и в присутствии микроорганизмов.






Затем приготовленный раствор стандартизуют. Стандартизацию проводят по иодату калия КIO3, бромату калия КВrО3, дихромату калия К2Сr2О7 и другим окислителям. Чаще всего растворы тиосульфата натрия стандартизуют по стандартному раствору дихромата калия.
Дата добавления: 2015-11-18 ; просмотров: 4935 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Химик.ПРО – решение задач по химии бесплатно
Для промывания желудка при многих видах отравлений в качестве антидота принимают раствор тиосульфата натрия (Nа2S2O3) молярной концентрации 0,33 моль/л. Сколько грамм тиосульфата натрия (Nа2S2O3) потребуется для приготовления 2 литров такого раствора тиосульфата натрия.
Решение задачи
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
Задачу можно решить через вышеуказанную формулу или путем составления пропорции.
Найдем, сколько моль содержится в 2 л раствора тиосульфата натрия (Nа2S2O3), составим пропорцию:
в 1 л раствора тиосульфата натрия должно содержаться 0,33 моль Nа2S2O3
в 2 л раствора тиосульфата натрия должно содержаться х моль Nа2S2O3
Используя таблицу Менделеева, рассчитаем молярную массу тиосульфата натрия (Nа2S2O3) в растворе тиосульфата натрия:
M (Nа2S2O3) = 2 ⋅ 23 + 2 ⋅ 32 + 3 ⋅ 16 = 158 (г/моль).
По формуле, устанавливающей связь между массой и химическим количеством вещества, найдем массу тиосульфата натрия (Nа2S2O3) в растворе тиосульфата натрия:
Ответ:
масса тиосульфата натрия равна 104,28 грамм.
Источник
1 Приготовление и стандартизация рабочего раствора тиосульфата натрия (Na2s2o3)
Раствор тиосульфата натрия готовят объёмом
300 см 3 с молярной концентрацией эквивалента
0,05 моль/дм 3 из раствора с молярной концентрацией эквивалента
0,1 моль/дм 3 путем разбавления дистиллированной водой в соотношении 1:1.
В качестве индикатора используют свежеприготовленный водный раствор крахмала с массовой долей 0,1 %.
Стандартизацию раствора Na2S2O3 проводят по первичному стандарту дихромата калия титрованием по замещению, методом пипетирования.
Схема 10. Определение концентрации Na2S2O3


Результаты стандартизации раствора тиосульфата натрия
Источник
Экспериментальная часть. Приготовление и стандартизация раствора С(Na2S2O3)=0,1 моль/дм3



Приготовление и стандартизация раствора С(Na2S2O3)=0,1 моль/дм 3
Реактивы:
4. 2M раствор HCl
5. 1% р-р Крахмала
6. Дистиллированная вода
Приборы:
1. Мерная колба 100см 3 ;
2. Мерный цилиндр вместимостью 25см 3 ;
3. Коническая колба для титрования 250 см 3
4. Пипетка 10 мл
4. Бюретка на 25 мл
Ход работы:
Рабочий раствор тиосульфата натрия готовят по навеске, исходя из заданной концентрации раствора и его объема. Для приготовления 200 мл 0,1 м раствора тиосульфата натрия отвешивают в бюксе на технических весах 5 г тиосульфата натрия. Взятую навеску растворяют в 200 мл дистиллированной воды и добавляют 0,02 г соды. Раствор хранят в склянке из темного стекла.
Определение точной концентрации раствора тиосульфата натрия проводится по 2—3 точным навескам дихромата калия полумикрометодом (бюретка объемом 25 мл, цена деления 0,1 мл). Навеску дихромата калия рассчитывают с учетом объема мерной колбы, пипетки, бюретки и концентрации приготовленного раствора тиосульфата натрия. Учитывая, что на титрование аликвоты раствора дихромата калия должно пойти 10 мл 0,1 М тио сульфата натрия и соотношение объема мерной колбы и пипетки
100 : 10, рассчитываем массу дихромата калия:
Точная навеска дихромата калия лежит в пределах 0,47—0,51 г.Пробирку с дихроматом калия взвешивают на аналитических весах, отсыпают дихромат через воронку в мерную колбу на 100 мл и взвешивают пробирку с дихроматом калия. По разности взвешиваний находят навеску дихромата калия. Дистиллированной водой смывают дихромат калия с воронки в колбу, взбалтывают со держимое колбы до полного растворения дихромата калия
и только после этого доливают воду до метки. Раствор хорошо перемешивают. Пипетку на 10 мл промывают раствором дихромата калия
и отбирают 1/10 часть его в колбу для титрования объемом на 250 мл, добавляют 5 мл 10 % раствора KI и 5 мл 2 М раствора HCl. Колбу закрывают часовым стеклом и оставляют на 5 мин в темном месте. Затем к раствору добавляют 50 мл воды и титруют раствором тиосульфата натрия, добавляя его по каплям и хорошо перемешивая раствор. Когда окраска раствора из бурой перейдет в бледно-желтую, добавляют 50 капель раствора крахмала
(2—3 мл) и продолжают титрование до перехода синей окраски раствора в бледно-зеленую, почти бесцветную. При втором и последующих титрованиях крахмал добавляется возможно ближе к концу титрования. Отсчет объема раствора тиосульфата натрия ведется с точностью до ±0,005 мл. Титрование аликвотной части раствора дихромата калия проводят 3—4 раза и вычисляют среднее значение объема тиосульфата натрия (Vср.), относительное отклонение от среднего не более 0,5 %. По экспериментальным данным рассчитывают титр тиосульфата натрия по дихромату калия.
Источник
Лабораторная работа №2. Метод иодометрии. Приготовление точного раствора Na2S2O3 и крахмала.
Лабораторная работа №2.
Требования безопасности перед началом работы:
Ознакомиться с инструкцией по технике безопасности на рабочем месте и получить дополнительный инструктаж, о чем делается соответствующая запись в журнале инструктажа по технике безопасности.
Привести в порядок свою рабочую одежду.
Проверить освещение рабочего места – оно должно быть достаточным, свет не должен слепить глаза.
Проверить отсутствие внешних повреждений электроустановки, наличие и исправность контрольных, измерительных и сигнальных приборов, тумблеров, переключателей и т.п.
Убедиться в целостности крышек электророзеток и выключателей, электровилки и подводящего электрокабеля.
Убедиться в наличии и целостности заземляющего проводника корпуса электроустановки.
Проверить наличие и исправность средств индивидуальной защиты, отсутствие их внешних повреждений.
Внимательно осмотреть рабочее место и привести его в порядок, убрать посторонние предметы.
производить работу установки без разрешения руководителя;
включать силовые и осветительные рубильники без разрешения руководителя;
входить в силовые и моторные отделения без особого разрешения руководителя работ;
включать схему, работающую под напряжением, без предварительной проверки и без разрешения руководителя;
работать с незаземленным оборудованием. Отключать и обрывать провода защитного заземления;
снимать и перевешивать предупреждающие и запрещающие плакаты .
Иодометрия- титриметрический метод анализа, основанный на реакциях, в ходе которых элементный иод восстановливается до иодид ионов или иодид-ионы окисляются в элементный иод:
Иод-окислитель средней силы. Методом иодометриии можно определить и восстановители и окислители.
Сильные востановители легко окисляются свободным иодом. Иодометрическое определение этих восстановителей проводят методом прямого титрования анализируемой пробы раствором иода. В случаях, когда реакция между восстановителем и иодом идет медленно, иодометрическое определение этих восстановителей проводят методом обратного титрования.
Окисление иодида протекает медленно, поэтому прямое титрование окислителей раствором иодида нецелесообразно. Для анализа окислителей используют метод титрования по замещению- добавляют к окислителю избыток иодида калия. . В результате реакции образуется свободный иод в количестве, эквивалентном количеству анализируемого окислителя. Выделившийся иод оттитровывают раствором тиосульфата натрия.
Тиосульфат натрия реагирует с иодом по реакции:
Из уравнения реакции видно, что фактор эквивалентности для тиосульфата натрия равен единице и молярная масса эквивалента Na 2 S 2 O 3 равна его молекулярной массе М ( Na 2 S 2 O 3 *5Н 2 О ) = 249,2 г/моль. Фактор эквивалентности для иода равен ½ и молярная масса эквивалента I 2 равна его атомной массе – ½ М ( I 2 ) =126,9 г/моль.
При иодометрии в качестве индикатора применяют крахмал, образующий в присутствии иода интенсивно окрашенное синее соединение. При титровании раствором иода в точке эквивалентности первая избыточная капля титранта вызывает появление синей окраски. При титровании иода раствором тиосульфата натрия в точке эквивалентности синий раствор обесцвечивается. В этом случае крахмал добавляют к конце титрования, когда иода остается в растворе очень мало, поскольку крахмал хорошо адсорбирует (поглощает) иод .
Приготовление рабочего раствора тиосульфата натрия и крахмала.
2.1. Аппаратура и рективы и вспомогательные устройства.
2.1.1. Весы лабораторные электронные типа ВЛТЭ-500 по ГОСТ Р 53228-2008, 2-го класса точности, наибольший предел взвешивания 500 г, цена деления 0,01г
Колба мерная 1,2 -250-2 по ГОСТ 1770.
Цилиндр 4-100-2 по ГОСТ1770.
Стакан химический по ГОСТ 25336
Натрий серноватистокислый (тиосульфат натрия) 5-водный по ГОСТ 27068.
Крахмал растворимый по ГОСТ 10163, раствор с массовой долей 0,5%.
Вода дистиллированная по ГОСТ 6709.
Приготовление раствора тиосульфата натрия молярной концентрации С( Na 2 S 2 O 3 ) = 0,1 мол/дм 3 (0,1н).
6,23±0,01г 5-водного тиосульфата натрия взвешивают в стаканчике и количественно переносят в мерную колбу вместимостью 250см 3 , стаканчик несколько раз промывают дистиллированной водой и переносят в мерную колбу. Объем в мерной колбе доводят до метки дистиллированной водой и хорошо перемешивают.
Приготовление раствора крахмала с массовой долей 0,5%.
0,5 г крахмала размешивают с 10см 3 холодной дистиллированной воды, смесь медленно вливают при постоянном перемешивании в 100 см 3 кипящей дистиллированной воды и кипятят 2-3 минуты. Раствор применяют свежеприготовленный.
Источник