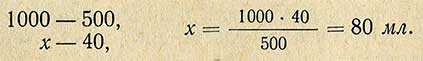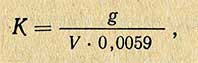Приготовление титрованного раствора NaOH
Грамм-эквивалент NaOH равен 40 г, следовательно, для приготовления 1 л 1 н. раствора требуется 40 г этого реактива. В 1 л 0,5 н. раствора соответственно должно содержаться 20 г, 0,1 н. — 4 г и т.д. Для приготовления раствора используют химически чистый реактив NaOH, растворяя его в дистиллированной воде в объеме, равном массе (весу) реактива, получая при этом насыщенный раствор NaOH.
Приготовленный раствор оставляют в склянке с резиновой пробкой на 2-3 недели для осаждения примеси карбоната натрия. После этого проверяют концентрацию полученного раствора путем титрования пробы определенного объема в присутствии индикатора метилового оранжевого. На основании полученных данных устанавливают необходимое количество насыщенного раствора NaOH для приготовления титрованного раствора.
Пример расчета. Требуется приготовить 10 л 0,1 н. раствора NaOH, для этого необходимо 10 X 4 = 40 г NaOH. Согласно проверке концентрации насыщенного раствора установлено, что в 1 л содержится 500 г NaOH. Следовательно, необходимые 40 г NaOH содержатся в следующем объеме (мл) насыщенного раствора:
Для приготовления 0,1 н. раствора необходимо взять 80 мл насыщенного раствора и довести дистиллированной водой (освобожденной от CO2 кипячением) до 10 л. Насыщенный раствор очень осторожно сливают с осадка сифоном.
Титрованный раствор щелочи хранят в склянке с пробкой, снабженной хлоркальциевой трубкой с натронной известью, для защиты от углекислого газа воздуха. Титр раствора щелочи устанавливают по янтарной кислоте или по титрованному раствору соляной кислоты.
Для установления титра 0,1 н. раствора NaOH по янтарной кислоте берут с точностью до 0,0001 г 3-4 навески химически чистой высушенной до постоянной массы (веса) кислоты по 0,20-0,25 г.
Навеску янтарной кислоты переносят в коническую колбу емкостью 250 мл и растворяют в 25-50 мл дистиллированной воды. Прибавляют к этому раствору 3-4 капли индикатора фенолфталеина и титруют раствором едкого натра до неисчезающего в течение 50-60 сек розового окрашивания. Коэффициент поправки К для титрованного раствора NaOH рассчитывают по следующей формуле:
где g — навеска янтарной кислоты, г; V — объем едкого натра, израсходованного на титрование, мл; 0,0059 — количество янтарной кислоты, соответствующее 1 мл точно 0,1 н. раствора NaCl.
Источник
Приготовление и стандартизация рабочего раствора NaOH
Цель работы – приготовление 0,1 н. раствора NaOH путем разбавления более концентрированного раствора и установление точной концентрации приготовленного раствора (стандартизация).
Сущность работы. Для установления точной концентрации раствора NaOH используют в качестве установочного вещества H2C2O4 · 2H2O (щавелевую кислоту), которая с NaOH взаимодействует по уравнению реакции:
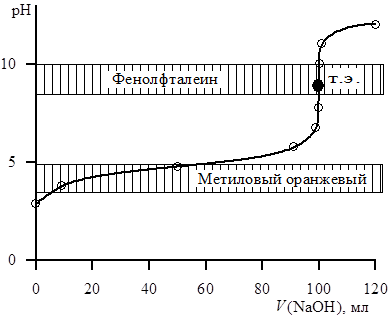
Таким образом, в точке эквивалентности рН раствора определяется присутствием соли слабой кислоты. Анализ кривой титрования (рис. 4.2) показывает, что т. э. находится в области рН >7.
Рис. 4.2. Кривая титрования 0,1 н. раствора H2C2O4
0,1 н. раствором NaOH
Скачок титрования для 0,1 н. растворов соответствует изменению рН от 8 до 10. Для этого титрования пригоден фенолфталеин. Индикаторы метиловый оранжевый, метиловый красный непригодны для данного титрования. Фактор эквивалентности H2C2O4 равен 
Приборы и посуда: технические и аналитические весы; мерные цилиндры (10–20 мл, 250 мл и 500 мл); денсиметр (ареометр); склянка с этикеткой для хранения рабочего раствора; мерная колба; пипетка; бюретка; конические колбы для титрования; тигель.
Реактивы: H2C2O4 · 2H2O (х. ч.), концентрированный раствор NaOH, индикатор – фенолфталеин.
1. Приготовление рабочего раствора NaOH.
Для определения плотности концентрированного раствора NaOH в мерный цилиндр помещают денсиметр и осторожно приливают испытуемый раствор до всплытия денсиметра. Отсчет показаний денсиметра проводят по верхнему делению шкалы, выступающему на уровне поверхности жидкости. Измерив таким образом плотность концентрированного раствора NaOH, по справочнику находят массовую долю (%) или молярную концентрацию (моль/л) NaOH в растворе. Затем рассчитывают объем концентрированного раствора, необходимый для приготовления 500 мл 0,1 н. раствора NaOH.
В мерный цилиндр вместимостью 500 мл предварительно наливают небольшое количество дистиллированной воды (
100 мл) и вносят рассчитанный объем концентрированного раствора NaOH, отмеренный мерным цилиндром. Объем раствора доводят дистиллированной водой до 500 мл. Приготовленный раствор тщательно перемешивают, переливают через воронку в склянку для хранения, закрывают пробкой и наклеивают на склянку этикетку.
2. Установление точной концентрации приготовленного раствора NaOH (стандартизация).
Для стандартизации приготовленного раствора NaOH в качестве установочного вещества используют H2C2O4 · 2H2O (щавелевую кислоту). Рассчитывают ориентировочную массу H2C2O4 · 2H2O, необходимую для приготовления 100,0 мл 0,1 н. раствора.
На технических весах взвешивают пустой тигель, затем вносят в него рассчитанную массу щавелевой кислоты (±10% от расчетного), переносят тигель с веществом на аналитические весы и снова взвешивают. Навеску аккуратно пересыпают через сухую воронку в мерную колбу. Пустой тигель с оставшимися на стенках частицами щавелевой кислоты взвешивают на аналитических весах. По разности двух взвешиваний находят точную массу H2C2O4 · 2H2O, перенесенную в мерную колбу. Струей дистиллированной воды смывают навеску в мерную колбу и добавляют воды до 

Вымытую бюретку промывают небольшим количеством приготовленного раствора щелочи и заполняют через воронку этим же раствором щелочи выше нулевой отметки. Подняв кверху стеклянный кончик бюретки и нажав на шарик, удаляют пузырьки воздуха из трубки. Затем, убрав воронку, доводят объем раствора в бюретке до нуля по нижнему мениску. На основание штатива кладут лист белой бумаги.
Промывают пипетку небольшим количеством раствора щавелевой кислоты. Раствор набирают при помощи резиновой груши или других специальных устройств.
В чистую коническую колбу помещают аликвоту раствора H2C2O4 · 2H2O, прибавляют 1–2 капли фенолфталеина и титруют, перемешивая содержимое колбы плавными круговыми движениями. Вначале раствор щелочи добавляют небольшими порциями, а затем по каплям до появления бледно-розовой окраски от одной избыточной капли щелочи. Титрование повторяют до тех пор, пока объемы щелочи в параллельных пробах будут отличаться не более чем на 0,1 мл. Все результаты записывают в рабочий журнал. Рассчитывают среднее значение объема раствора NaOH, пошедшего на титрование, и вычисляют точную (до 4-х значащих цифр) концентрацию приготовленного раствора щелочи.
Лабораторная работа № 4
Определение содержания К2СО3
Цель работы – определить массу К2СО3 в растворе, г.
К2СО3 является двухкислотным основанием с константами основности Кb,1 = 2,1 · 10 –4 и Кb,2 = 2,1 · 10 –8 . Поскольку отношение Кb,1/Кb,2=10 4 , то на кривой титрования К2СО3 наблюдаются два отчетливых скачка титрования (рис. 4.3).
Первая т. э. (рН = 8,34) соответствует уравнению
и может быть зафиксирована с помощью фенолфталеина (ΔрН = 8–10). Фактор эквивалентности К2СО3 в этой реакции равен 1.
Вторая т. э. на кривой титрования К2СО3 раствором НСl наблюдается при рН = 4,25 и соответствует уравнению
Для фиксирования второй т. э. пригоден метиловый оранжевый (ΔрН = 3,1–4,4). В этом случае fэкв (К2СО3) равен 
Рис. 4.3. Кривая титрования 0,1 н. раствора К2СО3
0,1 н. раствором НСl
Приборы и посуда: мерная колба; пипетка; бюретка; конические колбы для титрования.
Реактивы: стандартный раствор HCl, индикаторы – фенолфталеин и метиловый оранжевый.
В мерную колбу получают у лаборантов анализируемый раствор, доводят объем до метки дистиллированной водой, тщательно перемешивают. Аликвотную часть анализируемого раствора с помощью пипетки помещают в коническую колбу Прибавляют 1–2 капли индикатора (фенолфталеина или метилового оранжевого) и титруют стандартным раствором HCl до изменения окраски индикатора.
Титрование с каждым индикатором повторяют не менее 3 раз до получения сходимых результатов. По полученным результатам рассчитывают массу К2СО3 в анализируемом растворе, г.
Лабораторная работа № 5
Определение содержания H3PО4
Цель работы – определить массу H3PО4 в растворе, г.
Сущность работы. H3PО4 является трехосновной кислотой с константами кислотности: Ка,1 = 7,1 · 10 –3 ; Ка,2 = 6,2 · 10 –8 ; Ка,3 = 5,0 · 10 –13 . Поскольку значение Ка,3 –7 и отношение Ка,1/Ка,2
10 5 , то на кривой титрования H3PО4 наблюдается два скачка титрования (рис. 4.4).
Первый скачок соответствует оттитровыванию кислоты по 1-й ступени.
Второй скачок соответствует оттитровыванию H3PО4 по 2-й ступени.
1-я т. э. соответствует рН = 4,5. В этой области лежит интервал перехода окраски метилового оранжевого (ΔрН = 3,1–4,4).
2-я т. э. соответствует рН = 9,2. В этой области лежит интервал перехода окраски фенолфталеина (ΔрН = 8–10).
Таким образом, c метиловым оранжевым H3PО4 оттитровывается щелочью как одноосновная кислота, а с фенолфталеином – как двухосновная. Фактор эквивалентности H3PО4 при титровании с метиловым оранжевым равен 1, а с фенолфталеином – 
Приборы и посуда: мерная колба; пипетка; бюретка; конические колбы для титрования.
Реактивы: Стандартный раствор NaOH, индикаторы – фенолфталеин и метиловый оранжевый.
Рис. 4.4. Кривая титрования 0,1 н. раствора H3PО4
0,1 н. раствором NaOH
В мерную колбу получают у лаборантов анализируемый раствор. Дистиллированной водой доводят объем раствора до метки, тщательно перемешивают. Ополаскивают и заполняют бюретку щелочью. Отбирают пипеткой аликвотную часть анализируемого раствора из мерной колбы и переносят в коническую колбу для титрования. Прибавляют 1–2 капли индикатора (метилового оранжевого или фенолфталеина) и титруют стандартным раствором щелочи до перехода окраски.
Титрование с каждым индикатором проводят не менее 3 раз до получения сходимых результатов. По полученным результатам рассчитывают массу H3PО4 в анализируемом растворе, г.
Источник
Химические методы исследования свойств
Работа 2. Приготовление раствора гидроксида натрия и
установление его концентрации
Цель работы: освоить метод нейтрализации; ознакомиться с проведением расчетов и приготовлением растворов способом разбавления, приготовить раствор гидроксида натрия, установить его концентрацию.
Сущность работы. Раствор гидроксида натрия готовят способом разбавления. Титриметрическое определение его концентрации основано на реакции нейтрализации раствором кислоты: NaOH + HCl → NaCl + H 2 O. Фиксирование конечной точки титрования проводят с помощью кислотно-основного индикатора метилового оранжевого, который в щелочной среде имеет желтую окраску, в кислой – розовую. Титрование заканчивают при появлении оранжевой окраски раствора.
Оборудование и реактивы: бюретка вместимостью 25,00 см 3 ; мерные колбы вместимостью 100,00 см 3 ; колбы конические для титрования вместимостью 100–250 см 3 ; стакан для слива; мерный цилиндр вместимостью 10,00 см 3 ; мерная пипетка вместимостью 5–25 см 3 ; фиксанал HСl (0,1 моль); раствор NaOH, концентрированный; индикатор метиловый оранжевый, = 0,1%.
Методика выполнения анализа
1. Приготовление рабочего раствора гидроксида натрия.
Раствор гидроксида натрия готовят способом разбавления. Для этого рассчитывают объем концентрированного раствора, необходимый для приготовления 100 см 3 раствора с С экв (NaOH) = 0,1 моль/дм 3 . Сначала вычисляют массу по данным для разбавленного раствора:
где С экв (NaOH) – молярная концентрация эквивалентов раствора NaOH, моль/дм 3 ; М экв (NaOH) – молярная масса эквивалентов NaOH, г/моль; V м.к. – вместимость мерной колбы, дм 3 .
Такая же масса NaOH должна содержаться и в объеме концентрированного раствора, который будет взят для разбавления. Объем концентрированного раствора NaOH рассчитывают из формулы для вычисления массовой доли:
Вычисленный объем измеряют мерным цилиндром, переносят в мерную колбу, доводят раствор дистиллированной водой до метки по нижнему краю мениска, затем тщательно перемешивают.
2. Приготовление раствора HС l из фиксанала.
Фиксаналы – это изготовленные в заводских условиях стеклянные ампулы, содержащие определенное количество моль эквивалентов химически чистого вещества в сухом виде или в виде раствора. В данной работе используется фиксанал, содержащий HCl в количестве n экв = 0,1000 моль. Приготовление раствора из фиксанала сводится к тому, чтобы количественно перенести содержимое ампулы в мерную колбу определенной вместимости. Расчет объема мерной колбы ведут по формулам:
Находящиеся в коробке фиксаналы и бойки обязательно моют сначала водопроводной водой, а затем ополаскивают дистиллированной. В мерную колбу вставляют чистую воронку, опускают в нее боек с «воротничком» длинным концом вниз. Осторожно, легким ударом об этот боек пробивают тонкое дно фиксанала. Не изменяя положения ампулы над воронкой, вторым бойком пробивают верхнее углубление на ней. Содержимое ампулы выливается или высыпается в мерную колбу. Ампулу продолжают держать в том же положении. Тщательно ополаскивают внутреннюю поверхность ампулы струей из промывалки. После чего воронку и бойки промывают дистиллированной водой и вынимают их из колбы. Доводят до метки (по нижнему краю мениска) уровень раствора дистиллированной водой. Колбу плотно закрывают пробкой и тщательно перемешивают раствор.
3. Установление концентрации рабочего раствора гидроксида натрия.
Аликвотную часть раствора NaOH ( V ал.ч. ) отбирают мерной пипеткой, которую подготавливают следующим образом: маленький стаканчик ополаскивают раствором NaOH, затем наливают 1/3 стаканчика и ополаскивают пипетку этим раствором 2 – 3 раза. Выливают остатки раствора. Наливают свежий раствор, отбирают аликвотную часть, переносят в колбу для титрования, добавляют 1–2 капли индикатора метилового оранжевого и титруют приготовленным раствором HCl из бюретки до перехода окраски раствора из желтой в оранжевую. Записывают объем титранта с точностью до второго знака после запятой. Для повышения точности результатов анализа, титрование проводят 3 – 4 раза. В расчетную формулу подставляют среднее значение объема, при вычислении которого учитывают только те объемы, которые отличаются друг от друга не более, чем на 0,10 см 3 . Концентрацию раствора NaOH рассчитывают, используя выражение закона эквивалентов:
Работа 3. Определение аммиака в солях аммония методом
Цель работы : определить содержание аммиака в солях аммония методом обратного титрования.
Сущность работы. Аммониевые соли проявляют свойства очень слабых кислот, поэтому их прямое титрование невозможно; используют косвенные методы – метод обратного титрования или метод замещения. Определение аммиака методом обратного титрования проводят следующим образом: к раствору соли аммония добавляют точно измеренное количество щелочи в избытке. Часть щелочи вступает в реакцию:
Раствор кипятят до полного удаления аммиака. Избыток щелочи остается в растворе, его титруют раствором кислоты.
Зная количество щелочи, введенное в раствор соли аммония и оставшееся после удаления аммиака, вычисляют содержание аммиака.
Оборудование и реактивы : аналитические весы; бюретка вместимостью 25,00 см 3 ; бюретка вместимостью 50,00 см 3 ; мерная колба вместимостью 250,00 см 3 ; стакан вместимостью 150,00 см 3 ; колба коническая для титрования; мерный цилиндр вместимостью 10 см 3 ; мерная пипетка вместимостью 5 – 10 см 3 ; соляная кислота, C экв (HCl) 0,1 моль/дм 3 ; раствор NaOH, C экв (NaOH) 0,1 моль/дм 3 ; хлорид аммония, ч.д.а. или х.ч.; индикатор метиловый оранжевый; красная лакмусовая бумага.
Методика выполнения анализа
В колбе для титрования получают раствор соли аммония, добавляют точно отмеренный объем титрованного раствора NaOH (2030 см 3 ) и кипятят до полного удаления аммиака. Для проверки полноты удаления аммиака через некоторое время в пары вносят красную лакмусовую бумажку, смоченную в дистиллированной воде. Если аммиак удален полностью, лакмусовая бумажка не должна синеть. После полного удаления аммиака раствор охлаждают, ополаскивают внутренние стенки колбы дистиллированной водой и титруют раствором хлороводородной кислоты с индикатором метиловым оранжевым до перехода окраски раствора из желтой в оранжевую. При расчете массы аммиака в растворе соли аммония, используют формулу:
где С экв. (NaOH) – молярная концентрация эквивалентов раствора NaOH, моль/дм 3 ; V (NaOH) объем раствора NaOH, см 3 ; С экв. (HCl) – молярная концентрация эквивалентов раствора HCl, моль/дм 3 ; V (HCl) объем рабочего раствора, израсходованный на титрование, см 3 ; М экв. (NH 3 ) – молярная масса эквивалентов аммиака, г/моль.
Работа 4. Определение титруемой кислотности или
щелочности продовольственного сырья и пищевых продуктов
Цель работы: освоить методики определения показателей кислотности или щелочности сырья и пищевых продуктов.
Сущность работы. Кислотность продовольственного сырья и пищевых продуктов обусловлена наличием в них различных пищевых кислот (уксусная, молочная, яблочная, лимонная, винная) или их кислых солей. Для фиксирования точки эквивалентности используют индикатор – фенолфталеин.
Щелочность определяют в изделиях, приготовленных с введением щелочных химических разрыхрытелей (гидрокарбоната натрия, карбоната аммония). При титровании водной вытяжки из навески мучных кондитерских изделий в качестве индикатора используют бромтимоловый синий.
Оборудование и реактивы: бюретка вместимостью 25,00 см 3 ; колба для титрования вместимостью 100 см 3 или 250 см 3 ; пипетка вместимостью 10,00 см 3 ; раствор гидроксида калия (или гидроксида натрия), С осн. = 0,1000 моль/дм 3 ; хлороводородная или серная кислота; С к-ты = 0,1000 моль/дм 3 ; индикаторы – фенолфталеин, бромтимоловый синий; гептагидрат сульфата кобальта,
СоSO 4 · 7H 2 O, ч.д.а.
Методика выполнения анализа
1. Определение титруемой кислотности молока.
Кислотность молока и молочных продуктов обусловлена наличием в них молочной кислоты, гидрофосфатов и гидрокарбонатов. Повышение кислотности вызывает нежелательные изменения свойств молока, одно из которых – снижение устойчивости белков к нагреванию, поэтому молоко с кислотностью 21 °Т принимают как несортовое, а молоко свыше 22 °Т не подлежит сдаче на молочные заводы.
Кислотность молока и молочных продуктов выражают в градусах Тернера (°Т) (объем раствора щелочи с молярной концентрацией 0,1000 моль/дм 3 , израсходованный на титрование 100,00 см 3 молока или 100 г молочного продукта).
Источник