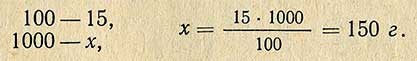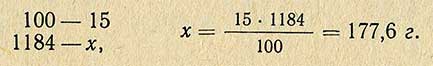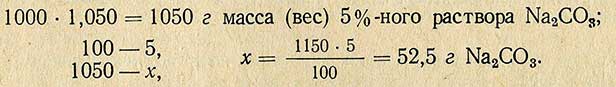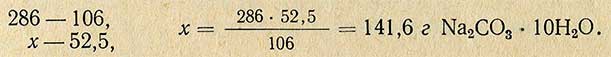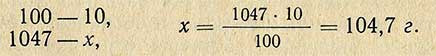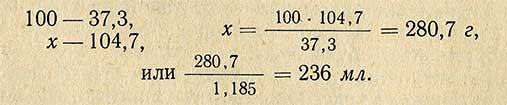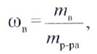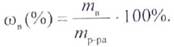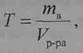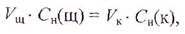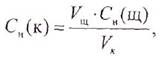Растворы процентной концентрации
Приготовление растворов. Раствором называют однородные смеси двух или более веществ. Концентрацию раствора выражают по-разному:
в весовых процентах, т.е. по количеству граммов вещества, содержащегося в 100 г раствора;
в объемных процентах, т.е. по количеству единиц объема (мл) вещества в 100 мл раствора;
молярностью, т.е. количеством грамм-молей вещества, находящегося в 1 л раствора (молярные растворы);
нормальностью, т.е. количеством грамм-эквивалентов раствореного вещества в 1 л раствора.
Растворы процентной концентрации. Процентные растворы готовят как приблизительные, при этом навеску вещества отвешивают на технохимических весах, а объемы отмеривают измерительными цилиндрами.
Для приготовления процентных растворов пользуются несколькими приемами.
Пример. Необходимо приготовить 1 кг 15%-ного раствора хлористого натрия. Сколько необходимо для этого взять соли? Расчет проводится согласно пропорции:
Следовательно воды для этого необходимо взять 1000-150 = 850 г.
В тех случаях, когда надо приготовить 1 л 15%-ного раствора хлористого натрия, необходимое количество соли рассчитывают другим способом. По справочнику находят плотность этого раствора и, умножив ее на заданный объем, получают массу необходимого количества раствора: 1000-1,184 = 1184 г.
Следовательно, необходимое количество хлористого натрия различно для приготовления 1 кг и 1 л раствора. В тех случаях, когда приготовляют растворы из реактивов, содержащих в составе кристаллизационную воду, следует ее учитывать при расчете необходимого количества реактива.
Пример. Необходимо приготовить 1000 мл 5%-ного раствора Na2CO3 плотностью 1,050 из соли, содержащей кристаллизационную воду (Na2CO3-10H2O)
Молекулярная масса (вес) Na2CO3 равна 106 г, молекулярная масса (вес) Na2CO3-10H2O равна 286 г, отсюда рассчитывают необходимое количество Na2CO3-10H2O для приготовления 5%-ного раствора:
Методом разбавления растворы приготовляют следующим образом.
Пример. Необходимо приготовить 1 л 10%-ного раствора HCl из раствора кислоты относительной плотностью 1,185 (37,3%). Относительная плотность 10%-ного раствора 1,047 (по справочной таблице), следовательно, масса (вес) 1 л такого раствора равна 1000X1,047 = 1047 г. В этом количестве раствора должно содержаться чистого хлористого водорода
Чтобы определить, сколько необходимо взять 37,3%-ной кислоты, составляем пропорцию:
При приготовлении растворов путем разбавления или смешивания двух растворов для упрощения расчетов применяют способ диагональной схемы или «правило креста». На пересечении двух линий пишется заданная концентрация, а у обоих концов слева — концентрация исходных растворов, для растворителя она равна нулю.
Источник
Способы приготовления растворов
Содержание
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
Приготовление раствора по точной навеске
По точной навеске готовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом.
Основные этапы работы:
- рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г;
- взвешивают точную навеску на аналитических весах;
- взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
- если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают.
Приготовление раствора по приблизительной навеске
По приблизительной навеске готовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
Приготовление раствора из фиксанала
Из фиксанала (норма-дозы, стандарт-титра) готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество вещества (nэкв) в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу:
Приготовление раствора разбавлением концентрированного раствора
Разбавлением концентрированных растворов готовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации.
Все расчеты ведут с точностью не более чем до 0,01. Точную концентрацию устанавливают титрованием.
Установка титра
Установка титра – одна из важных операций лабораторной техники. От правильности приготовления титрованного раствора зависит и результат анализа. Так как каждый анализ почти всегда сопровождается титрованием, каждый работник лаборатории должен хорошо освоить технику проведения этой операции. Нужно помнить несколько правил, относящихся к титрованным растворам.
1. Титрованные растворы должны быть по возможности свежими. Длительное хранение их не должно допускаться. Для каждого раствора есть свой предельный срок хранения.
2. Титрованные растворы при стоянии изменяют свой титр, поэтому их следует иногда проверять. Если же делают особенно ответственный анализ, проверка титра раствора обязательна.
3. При приготовлении растворов марганцовокислого калия титр их следует устанавливать не ранее, чем через 3—4 дня после приготовления. То же относится ко всём другим растворам, способным изменяться со временем или при соприкосновении с воздухом, стеклом и пр.
4. Титрованные растворы щелочей лучше хранить в бутылях, покрытых внутри парафином, а также защищать их от действия двуокиси углерода воздуха (хлоркальциевая трубка с натронной известью или аскаритом).
5. Все бутыли с титрованными растворами должны иметь четкую надпись с указанием вещества, нормальности, поправки, времени изготовления раствора и даты проверки титра.
Во время титрования колбу нужно держать левой рукой, а правой рукой управлять краном бюретки, давая стекать жидкости равномерно. При титровании очень большое значение имеет скорость, поэтому, при повторном титровании одного и того же раствора, нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т. е. в одно и то же время вытекало бы определенное количество жидкости. Для перемешивания титруемого раствора очень удобно применять магнитные мешалки. В этом случае титрование можно вести как в обычной конической колбе, так и в специальных, приспособленных для титрования темноокрашенных жидкостей.
Общие рекомендации
Подведем итог сказанному о приготовлении растворов.
1. Все водные растворы следует готовить только на дистиллированной воде. При приготовлении водных растворов солей заданной концентрации нужно учитывать также кристаллизационную воду.
2. Приготовляя точные растворы, нельзя наливать в мерную колбу сразу все нужное количество воды.
3. Мерные колбы калиброваны на определенный объем лишь при температуре, указанной на колбе. Поэтому точный объем жидкости можно получить только при стандартной температуре.
4. Так как приготовить растворы точно заданной концентрации трудно, то, прежде чем пользоваться раствором, надо установить его концентрацию или поправку на нормальность.
5. Необходимо наклеивать этикетки (или делать надпись специальным карандашом) на сосудах с растворами.
6. Все растворы следует готовить только в хорошо вымытой посуде. Надо заботиться о том, чтобы приготовленные растворы не загрязнялись каким-либо образом. Нельзя путать пробки от посуды, содержащей растворы разных веществ.
7. Растворы, которые могут портиться от действия света, такие, как марганцовокислый калий, азотнокислое серебро и др., нужно хранить только в темных склянках. Для некоторых веществ можно употреблять желтые склянки, для других же сосуды необходимо оклеивать черной бумагой, но не покрывать стекло черным лаком: лаковая пленка всегда немного пропускает свет. Если черной бумаги нет, бутыль или другой сосуд следует оклеить плотной бумагой и бумагу покрыть черным лаком.
8. Растворы щелочей нужно хранить так, чтобы на них не действовала двуокись углерода. Для этого в пробку вставляют хлоркальциевую трубку, наполненную натронной известью или другим твердым поглотителем двуокиси углерода.
9. Растворы щелочей следует готовить вначале очень концентрированными и разбавлять их до нужной концентрации только после отстаивания и фильтрования.
10. Надо быть осторожным с растворами, которые могут вредно действовать на кожу рук, одежду или обувь.
11. Все растворы нужно проверять. Точные растворы – путем установки титра, приблизительные – по плотности или иным путем.
12. Растворы (за исключением точных) после приготовления следует обязательно профильтровывать. Это относится одинаково и к водным растворам, и к растворам в органических жидкостях.
13. При приготовлении растворов в органических жидкостях надо применять только чистые растворители и, когда нужно, – безводные. Если растворитель чем-либо загрязнен, его следует перегнать или очистить от примесей каким-либо другим способом.
Источник
ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ



Растворами называются гомогенные системы переменного состава, состоящие из двух или большего числа компонентов и продуктов их взаимодействия.
Под компонентами подразумеваются растворенные вещества и растворитель.
Важнейшей характеристикой раствора является концентрация.
Относительное содержание растворенного вещества в растворе можно выразить через размерные величины — концентрации и безразмерные — доли.
В зависимости от целей использования раствора применяют различные способы выражения концентрации, основные из которых рассмотрены ниже.
1. Массовая доля и процентная концентрация
Массовой долей (ω) называется отношение массы растворенного вещества к массе раствора:
где тв — масса растворенного вещества, г; m(p-pa)- масса раствора, г.
При выражении этой величины в процентах она называется
2. Молярная концентрация (молярность)
Молярная концентрация (См)- это отношение количества (числа молей) вещества к объему раствора, выраженному в литрах.
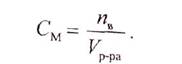 |
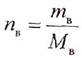 |
— количество вещества (моль), то:
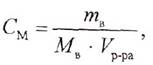 |
где См — молярная концентрация раствора, моль/л;
тв — масса растворенного вещества, г;
Мв — молярная масса растворенного вещества, г/моль; Vр-ра — объем раствора, л.
3. Молярная концентрация эквивалента (нормальность)
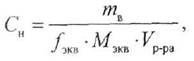
Нормальность (Сн) — это количество эквивалентов растворенного вещества, содержащееся в 1 литре раствора:
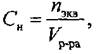 |
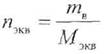 |
— количество эквивалентов вещества, моль.
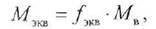 |
где сн — нормальность раствора, моль/л;
ть — масса растворенного вещества, г;
fэкв — фактор эквивалентности;
Мэкв — молярная масса эквивалента, моль/л; Vр-ра — объем раствора, л.
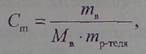 |
| 4. Моляльная концентрация (моляльность) |
| Моляльная концентрация (Cm) определяется числом молей растворенного вещества в 1000 граммах (1 кг) растворителя: |
где тв — масса растворенного вещества, г;
Mв — молярная масса растворенного вещества, г/моль; mр-теля— масса растворителя, г.
5. Титр раствора
Титр раствора (7) определяется массой растворенного вещества в 1 мл раствора:
где Т—титр раствора, г/мл;
тв — масса растворенного вещества, г; Vр-ра — объем раствора, мл.
Опыт 1. Приготовление раствора соляной кислоты заданной концентрации
Раствор готовится разбавлением более концентрированного раствора исходной кислоты.
Для определения концентрации раствора исходной соляной кислоты измерьте ареометром ее плотность (ρ, г/см ). Для этого кислоту налейте в цилиндр, опустите в нее ареометр. Отметьте деление шкалы ареометра, совпадающее с нижним мениском жидкости в цилиндре. Это и есть плотность раствора. Пользуясь табл. 1, определите процентную концентрацию исходной соляной кислоты (ωисх, %).
Далее рассчитайте (с точностью до десятых долей миллилитра) объем исходной кислоты, необходимый для приготовления 100 мл раствора с концентрацией, указанной преподавателем. Проверьте правильность расчета, показав его преподавателю.
Раствор готовится в мерной колбе объемом 100 мл. Мерную колбу примерно наполовину заполните дистиллированной водой.
| пипетку и пере- |
Отберите вычисленный объем исходной кислоты в
несите кислоту в мерную колбу. Аккуратно доведите объем раствора до риски дистиллированной водой. Закройте колбу пробкой и, придерживая пробку пальцем, тщательно перемешайте, переворачивая колбу 8-10 раз вверх дном так, чтобы воздушный пузырь перемещался через всю колбу.
Таблица 1 растворов некоторых кислот и оснований при 20°С
| Массовая доля, % | Н2SO4 | HNO3 | HCI | NaOH | NH3 |
| 1.012 | 1,009 | 1.008 | 1,021 | 0.990 | |
| 1,025 | 1,020 | 1,018 | 1,043 | 0,981 | |
| 1,038 | 1,031 | 1,023 | 1,065 | 0,973 | |
| 1,052 | 1,043 | 1,038 | 1,087 | 0,965 | |
| 1,066 | 1,054 | 1,047 | 1,109 | 0,958 | |
| 1,080 | 1,066 | 1,057 | 1,131 | 0,950 | |
| 1,095 | 1,078 | 1,069 | 1,153 | 0,943 | |
| 1,109 | 1,090 | 1,078 | 1,175 | 0,936 | |
| 1,124 | 1,103 | 1,088 | 1,197 | 0,930 | |
| 1,139 | 1,115 | 1,098 | 1,219 | 0,923 | |
| 1,155 | 1,128 | 1,108 | 1,241 | 0,916 | |
| 1,170 | 1,140 | 1,119 | 1,263 | 0,910 | |
| 1,186 | 1,153 | 1,129 | 1,285 | 0,904 | |
| 1,202 | 1,167 | 1,139 | 1,306 | 0,898 | |
| 1,219 | 1,180 | 1,149 | 1,328 | 0,892 | |
| 1,235 | 1,193 | 1,158 | 1,349 | 0,886 | |
| 1,252 | 1,207 | 1,169 | 1,370 | ||
| 1,268 | 1,221 | 1,179 | 1,390 | ||
| 1,286 | 1,234 | 1,189 | 1,410 | ||
| 1,303 | 1,246 | 1,198 | 1,430 | ||
| 1,321 | 1,259 | 1,449 | |||
| 1,337 | 1,272 | 1,469 | |||
| 1,357 | 1,285 | 1,487 | |||
| 1,376 | 1,298 | 1,507 | |||
| 1,395 | 1,310 | 1,525 | |||
| 1,415 | 1,322 | 1,543 | |||
| 1,435 | 1,334 |
Опыт 2. Определение концентрации кислоты методом титрования

Перед началом титрования бюретку сполосните раствором щелочи, выданным для работы. Нормальность раствора щелочи указана на этикетке склянки.
Заполните бюретку щелочью несколько выше нулевого деления. Установите уровень щелочи (по нижнему мениску) на нулевом делении бюретки. Если нулевая отметка находится значительно выше уровня глаз, титрование можно вести от другого деления, например от 10 мл.
Проведите ориентировочное титрование. Для этого в пипетку с помощью груши наберите 10 мл (аликвотную часть) приготовленного раствора кислоты. Из пипетки кислоту вылейте в коническую колбу для титрования, внесите туда 2-3 капли индикатора фенолфталеина. Из бюретки по каплям прилейте щелочь, постоянно перемешивая содержимое колбы кругообразными движениями. Титрование проведите на белом фоне, подложив под колбу лист белой бумаги. Как только раствор станет от прибавления одной капли щелочи бледно-розовым, добавление щелочи прекратите и запишите объем щелочи, пошедший на титрование.
Титрование надо будет повторить еще два раза. Каждый раз перед титрованием новой пробы кислоты подливайте щелочь в бюретку до нулевой отметки или до того уровня, с которого начали титровать в первом опыте. После каждого титрования объем щелочи с точностью до десятых долей миллилитра записывайте в таблицу. Эти объемы не должны отличаться более чем на 0,1 мл. Если результаты титрования отличаются на большую величину, титрование следует повторить.
Рассчитайте нормальную концентрацию приготовленного раствора кислоты, используя закон эквивалентов: вещества взаимодействуют друг с другом в эквивалентных количествах, т. е. число эквивалентов щелочи, пошедшее на титрование (Nщ), равно числу эквивалентов кислоты, взятой для анализа (NK):
Число эквивалентов растворенного вещества в данном объеме раствора (V) равно произведению объема раствора на его нормальность, т. е.
где V- объем раствора, л;
Сн — нормальность раствора, моль/л. Тогда:
где Сн(к) и Сн(щ) — нормальные концентрации кислоты и щелочи, моль/л;
Vщ — средний объем щелочи, пошедший на титрование, л;
VK — объем кислоты, взятый для титрования (объем пипетки), л.
Расчет концентрации кислоты произведите с точностью до
четвертого знака после запятой.
При оформлении результатов опыта:
1. Запишите плотность (рисх) и процентную концентрацию (ωиех, %) исходного раствора.
2. Приведите расчет объема исходной кислоты (Vисх), необходимого для приготовления заданного раствора,
3. Запишите объем кислоты, взятый для титрования (объем пипетки, Vк), нормальность раствора щелочи Сн(щ). Затем заполните табл. 2.
| Объем кислоты, взятый для титрования, Vk , мл | Объем щелочи, пошедший на каждое титрование, Vщ, мл | 1 Средний объем щелочи, Vщ ср, мл |
| i ■. . — |
Опыт 3. Приготовление раствора соли с заданной массо
вой долей (ω соли, %)
Получите у преподавателя задание. Рассчитайте, сколько
граммов соли и какой объем воды потребуются для приготовления
100 мл раствора соли заданной концентрации.
Взвесьте на лабораторных весах нужное количество соли и высыпьте ее в мерную колбу, предварительно налив в нее небольшой объем воды. Затем дистиллированной водой доведите объем раствора в колбе до метки (воду необходимо приливать постепенно, все время перемешивая раствор). Приготовленный раствор из колбы отлейте в цилиндр и измерьте ареометром его плотность. По плотности с помощью табл. 3 определите массовую долю соли в приготовленном растворе. (Совпадает ли она с рассчитанной вами?)
Таблица 3 Плотность растворов некоторых солей при 20°С
| Массовая доля, % | NaCl | KCl | NH4C1 | Na2S04 | (NH4)2SO4 | A12(S04)3 | Na2SO4.10H2O |
| 1,007 | 1,05 | 1,01 | 1,007 | 1,004 | 1,009 | 1,004 | |
| 1,014 | 1,011 | 1,004 | 1,016 | 1,010 | 1,019 | 1,008 | |
| 1,022 | 1,017 | 1,008 | 1,026 | 1,016 | 1,029 | 1,012 | |
| 1,029 | 1,024 | 1,011 | 1,035 | 1,022 | 1,040 | 1,016 | |
| 1,036 | 1,030 | 1,014 | 1,044 | 1,028 | 1,050 | 1,020 | |
| 1,044 | 1,037 | 1,017 | 1,053 | 1.034 | 1,061 | 1,024 | |
| 1,051 | 1,043 | 1,020 | 1,063 | 1.040 | 1,072 | 1,028 | |
| 1,058 | 1,050 | 1,023 | 1,072 | 1,046 | 1,083 | 1,032 | |
| 1,065 | 1,056 | 1,026 | 1,082 | 1,051 | 1,094 | 1,036 | |
| 1,073 | 1,063 | 1,029 | 1,091 | 1,057 | 1,105 | 1,040 | |
| И | 1,081 | 1,070 | 1,031 | 1,101 J | 1,063 | 1,117 | 1,044 |
| 1,089 | 1,077 | 1,034 | 1,111 | 1,06 | 1,129 | 1,048 | |
| 1,096 | 1,083 | 1,037 | 1,121 | 1,075 | 1,140 | 1,052 | |
| 1,104 | 1,090 | 1,040 | 1,131 | 1,081 | 1,152 | 1,056 | |
| 1,119 | 1,104 | 1,046 | 1,141 | 1,092 | 1,176 | 1,064 | |
| 1,135 | 1,113 | 1,051 | 1,104 | 1,201 | 1,072 | ||
| 1,143 | 1,126 | 1,054 | 1,109 | 1,213 | 1,077 | ||
| 1,151 | 1.133 | 1,057 | 1,115 | 1,226 | 1,081 | ||
| 1,159 | 1,140 | 1,059 | 1,121 | 1,239 | 1,085 | ||
| 1,062 | 1,127 | 1,252 | |||||
| 1,067 | 1,257 | ||||||
| 1,073 | 1,306 | ||||||
| 1,333 |
Рассчитайте молярную, нормальную концентрации и титр приготовленного раствора. Результаты опыта сведите в табл. 4.
Результаты опыта приготовления раствора соли
| Масса, г | Плотность раствора, р, г/мл | Концентрация Приготовленного раствора соли | ||
| соли | воды | молярная, См, моль/л | нормальная, Сн, моль/л | титр, г/мл |
Задания для самоконтроля
1. Содержание сульфата железа (II) в растворе (пл. 1,122 г/см )
составляет 12%. Вычислите молярную концентрацию и молярную
концентрацию эквивалента сульфата железа (И) в растворе.
2. На нейтрализацию 50 мл раствора КОН пошло 10 мл 0,8н раствора НС1. Рассчитайте нормальность раствора щелочи.
3. Для приготовления 0,025М раствора хлорида кальция используют СаСl2 в ампулах с массовой долей 0,45% (пл. 1,04 г/см).
Сколько мл этого раствора необходимо для приготовления 500 мл 0,02 5М раствора?
Источник