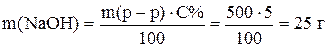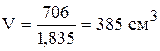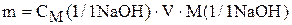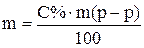Способы приготовления растворов заданной концентрации



С помощью технических или аналитических весов (в зависимости от заданной точности приготовления) отвешивают расчетное количество твердого вещества, переносят в мерную посуду, растворяют в небольшом количестве воды и доливают дистиллированную воду до отметки заданного объема (доводят до метки). Растворы можно готовить также разбавлением более концентрированных растворов.
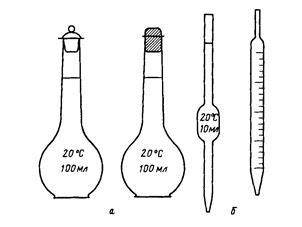
Рис. 1. Мерные колбы (а), пипетки (б)
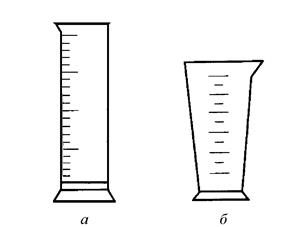
Рис. 2. Мерный цилиндр (а), мерный стакан (мензурка) (б)
Пример 1. Приготовить 0,5 дм 3 15 г/дм 3 раствора гидроксида натрия. Рассчитаем массу вещества по уравнению (1)
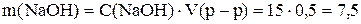
Навеску 7,5 г растворяем в мерной колбе на 500 см 3 .
Приготовление растворов с заданной массовой долей. Растворы готовят в химически стойкой посуде без градуировки объема. С помощью технических или аналитических весов отвешивают расчетное количество твердого вещества, переносят в мерную посуду и растворяют в расчетном количестве воды. Такие растворы можно готовить разбавлением концентрированных или смешением концентрированных и более разбавленных (или воды) растворов.
Пример 2. Приготовить 500 г 5% раствора гидроксида натрия. По уравнению (2) рассчитаем массу NaOH
Масса воды равна
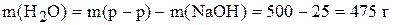
Таким образом, для приготовления раствора надо растворить 25 г твердого NaOH в 475 г воды.
Пример 3. Приготовить 3 кг 30% раствора серной кислоты из 95% и 10% раствора. Для приготовления необходимо рассчитать массы обоих растворов. Ранее для этого рекомендовали использовать правило «креста», в настоящее время с развитием вычислительной техники проще решить систему двух уравнений или воспользоваться готовой формулой. Введем обозначения x – необходимая масса 95% кислоты; y — необходимая масса 10% кислоты; m – масса конечного раствора, С%(1) – массовая доля 95% кислоты; С%(2) – массовая доля 10% кислоты; С%(к) – массовая доля приготовляемой кислоты.
Сумма масс кислоты в исходных растворах равна массе кислоты в конечном растворе, сумма масс растворов исходных кислот равна массе приготовляемой кислоты. Тогда получим систему из двух уравнений
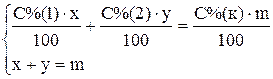
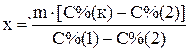
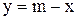
Подставив численные значения, получим:
х = 706 г; y = 2294 г.
Часто удобнее пользоваться не массой, а объемом растворов. В этом случае по справочнику определяют плотность исходных растворов и рассчитывают их объемы:
Для 95% кислоты 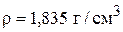
Для 10% кислоты 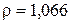
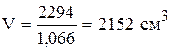
Таким образом, для приготовления 3 кг 30% раствора серной кислоты необходимо отмерить 385 см 3 95% кислоты и прибавить 2152 см 3 10% кислоты.
Если в качестве второго раствора берут чистую воду, то принимают С%(2) = 0.
Приготовление растворов с заданной молярной концентрацией или молярной концентрацией эквивалента. Растворы готовят в специальной мерной посуде: мерных колбах, мерных цилиндрах (рис. 1, 2). С помощью технических или аналитических весов отвешивают расчетное количество твердого вещества, переносят в мерную посуду, растворяют в небольшом количестве воды и доливают дистиллированную воду до отметки заданного объема (доводят до метки). Такие растворы можно готовить также разбавлением более концентрированных растворов.
Пример 4. Приготовить 250 см 3 раствора NaOH с концентрацией 0,5 н из 10% раствора, r = 1,11 г/см 3 .
Массу NaOH, необходимую для приготовления раствора рассчитаем из уравнения (3)
Такая же масса NaOH должна содержаться в пробе 10% раствора
Приравняв правые части уравнений получим
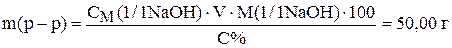
Рассчитаем объем раствора
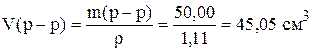
Таким образом, для приготовления раствора необходимо в мерную колбу на 250 см 3 отмерить 45,05 см 3 раствора NaOH с концентрацией 10%, довести до метки дистиллированной водой, и перемешать.
Источник
Формулы для пересчета концентраций растворов
В приводимой ниже таблице приняты следующие обозначения:
М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.

* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора.
РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ
Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше.
Растворение вещества в воде
Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда:
(I) 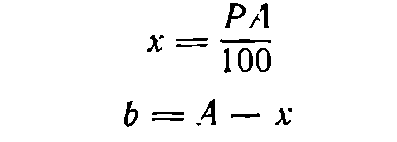
(2)
где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г.
Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
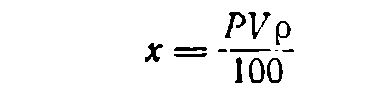
(3)
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу:
(4) 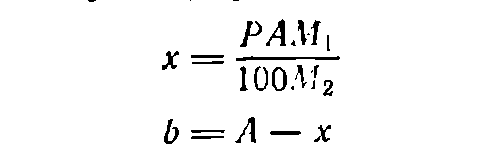
(5)
где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г.
Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
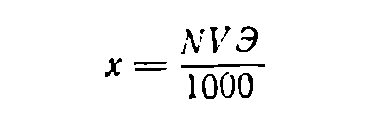
(6)
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
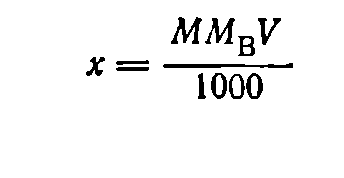
(7)
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл.
Разбавление раствора водой
Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2.
(9) 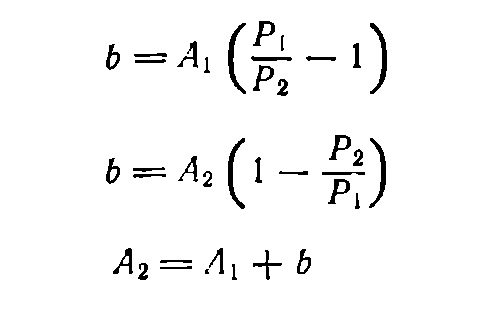
(10)
В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
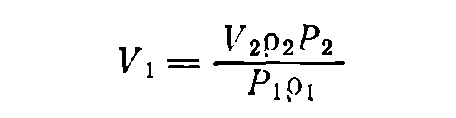
(11)
Объем воды (в мл) для разбавления: b = V2 — V1
Смешивание двух растворов различной концентрации
Пусть требуется приготовить раствор заданной концентрации из двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Чтобы определить, в каких пропорциях следует смешивать растворы, пользуются «правилом креста», которое наглядно показано на следующем примере:
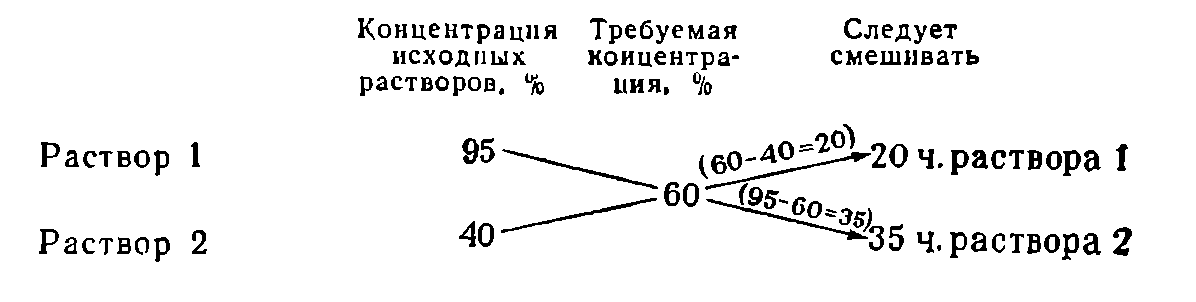
Смешиваемые растворы можно измерять в объемных или массовых частях в зависимости от того, в объемных или массовых процентах выражают концентрацию растворов.
«Правило креста» можно применять и в случаях разбавления раствора чистым растворителем. При этом концентрацию вещества в чистом растворителе считают равной нулю:

Для получения более концентрированного раствора растворением в нем дополнительного количества компонента твердое вещество условно считают раствором с концентрацией 100%: 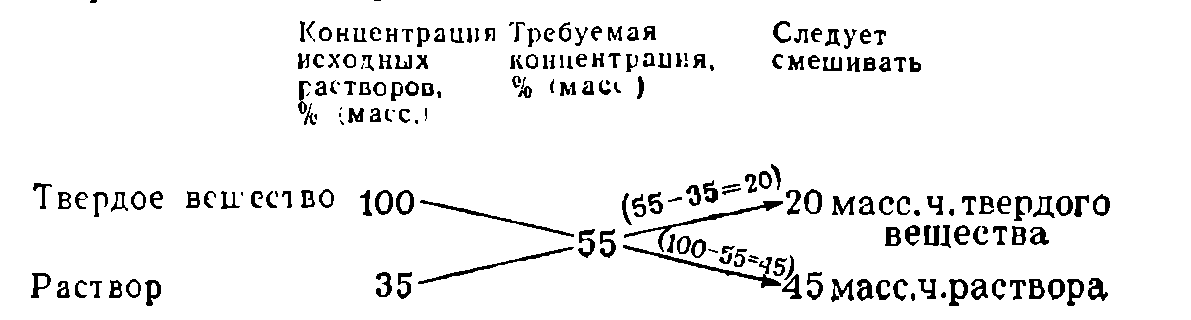
Источник
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ
ТЕМА: Растворы. Способы выражения концентрации. Приготовление раствора заданной концентрации.
Цель: Научиться навыкам проведения расчетов, необходимых для приготовления растворов различных концентраций и умению готовить такие растворы.
Задачи:
1. Ознакомиться со способами выражения концентрации растворов.
2. Разобрать обучающие задачи по расчету концентрации растворов.
3. Подготовиться к лабораторной работе «Приготовление раствора соли заданной концентрации».
Студент должен знать:
1. до изучения темы: Понятия массовой доли, количества вещества, концентрации раствора и их взаимную связь.
2. после изучения темы: Понятия: раствор, растворитель, растворенное вещество; особенности структуры воды в жидком и твердом состояниях; растворимость твердых веществ, газов в воде; факторы, влияющие на растворимость; способы выражения концентрации растворов: по растворению точной навески (объема) сухого вещества, кристаллогидрата, газа; из концентрированного раствора путем его разбавления; из разбавленного раствора путем его концентрирования.
Студент должен уметь: Проводить необходимые расчеты для приготовления раствора с заданной концентрацией раствора. Пользоваться аналитическими весами, мерной посудой (пипетки, бюретки, мерные пробирки, цилиндры, мензурки) и химическими приборами (ареометр).
Теоретическое введение
Растворы играют важную роль в живой и неживой природе, а также в науке и технике.
Большинство физиологических процессов в организмах человека, животных и в растениях, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном (воздух), жидком и твердом (сплавы, цветные стекла) агрегатных состояниях. Чаще всего приходится работать с жидкими растворами.
Содержание данного вещества в единице массы или объема раствора называется концентрацией раствора. На практике наиболее часто пользуются следующими способами выражения концентрации:
1. Массовая доля – отношение массы данного компонента в растворе к общей массе этого раствора. Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млнˉ1). Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
2. Массовая концентрация – отношение массы компонента, содержащегося в растворе, к объему этого раствора. Единицы измерения массовой концентрации кг/м 3 , г/л.
3. Титр Т – число граммов растворенного вещества в 1 мл раствора. Единицы измерения титра – г/мл, кг/см 3 .
4. Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения — моль/м 3 , (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1М; 0,5 моль/л, обозначают 0,5 М.
5. Молярная концентрация эквивалентов сэк (нормальная концентрация) – это отношение количества вещества эквивалентов (моль) к объему раствора (л). Единица измерения нормальной концентрации моль/л. Например, сэк(KOH) = 1 моль/л, сэк(1/2H2SO4) = 1 моль/л, сэк(1/3 AlCl3) = 1 моль/л. Раствор в 1 л которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н.
6. Моляльность b — это отношение количества растворенного вещества (в молях) к массе m растворителя. Единица измерения моляльности — моль/кг. Например, b(HCl/H2O) = 2 моль/кг.
7. Молярная доля – отношение числа молей растворенного вещества к общему числу молей вещества и растворителя. Молярная доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных долях (млн-1).
Для приготовления растворов определенной концентрации, для точного измерения объемов применяют мерную посуду: мерные колбы, пипетки и бюретки.
Мерные колбы – тонкостенные плоскодонные сосуды с длинным узким горлом, на котором нанесена метка в виде кольцевой черты. На каждой колбе обозначены ее емкость и температура, при которой эта емкость измерена. Колба должна плотно закрываться пробкой (рис.1).
Рис. 1 Мерная посуда
а — мерная колба; б – пипетки; в – бюретка.
Пипетки используют для отбора определенного объема пробы жидкости.
Пипетки Мора представляют собой стеклянные трубки с расширением посередине. Нижний конец оттянут в капилляр, на верхнем конце нанесена метка, до которой следует набирать измеряемую жидкость. На пипетке указана объемность.
Широко применяют также градуированные пипетки различной емкости, на наружной стенке которых нанесены деления. Для наполнения пипетки нижний конец ее опускают в жидкость и втягивают последнюю при помощи груши или специального приспособления. Жидкость набирают так, чтобы она поднялась на 2-3 см выше метки, затем быстро закрывают верхнее отверстие указательным пальцем правой руки, придерживая в то же время пипетку большим и средним пальцами. Затем ослабляют нажим указательного пальца, в результате чего жидкость будет медленно вытекать из пипетки. В тот момент, когда нижний мениск (уровень) жидкости окажется на одном уровне с меткой, палец снова прижимают. Введя пипетку в сосуд, отнимают указательный палец и дают жидкости стечь по стенке сосуда. После того, как жидкость вытечет, пипетку держат еще 5секунд прислоненной к стенке сосуда, слегка поворачивая вокруг оси.
Бюретки применяют при титровании, для измерения точных объемов и т.д.
ЛАБОРАТОРНАЯ РАБОТА
ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ
Опыт 1. Приготовление растворов кислот заданной концентрации
Раствор готовится разбавлением более концентрированного раствора исходной кислоты.
В соответствии со своим вариантом (таблица 1) рассчитайте (с точностью до десятых долей миллилитра) объемы кислот, необходимые для приготовления указанного объема раствора с заданной концентрацией.
Таблица 1. Варианты для выполнения опыта 1
| Вариант | Н2SO4 | HNO3 | HCl |
| 0,1М | 0,01н | 12% | |
| 0,01н | 0,1М | 8% | |
| 0,001М | 0,05н | 4% | |
| 0,05н | 0,001М | 6% | |
| 0,005М | 0,025н | 2% | |
| 0,025н | 0,005М | 10% | |
| 20% | 1М | 0,01н | |
| 26% | 0,02н | 0,1М | |
| 30% | 0,01М | 0,05н | |
| 38% | 0,25н | 0,001М | |
| 40% | 0,005М | 0,025н | |
| 0,025н | 60% | 0,005М | |
| 0,8М | 56% | 1н | |
| 0,5н | 18% | 2М | |
| 0,75н | 10% | 0,5М |
Пользуясь таблицей «Плотность растворов некоторых кислот при 20°С», определите процентную концентрацию исходной кислоты.
Плотность растворов некоторых кислот при 20°С (г/мл)
| Массовая доля, % | H2SO4 | HNO3 | HCl |
| 1.0116 | 1.0091 | 1.0081 | |
| 1.0250 | 1.0202 | 1.0179 | |
| 1.0385 | 1.0314 | 1.0278 | |
| 1.0522 | 1.0427 | 1.0377 | |
| 1.0661 | 1.0543 | 1.0476 | |
| 1.0802 | 1.0660 | 1.0576 | |
| 1.0947 | 1.0780 | 1.0676 | |
| 1.1094 | 1.0901 | 1.0777 | |
| 1.1245 | 1.1025 | 1.0878 | |
| 1.1398 | 1.1150 | 1.0980 | |
| 1.1554 | 1.1277 | 1.1083 | |
| 1.1714 | 1.1406 | 1.1185 | |
| 1.1872 | 1.1536 | 1.1288 | |
| 1.2031 | 1.1668 | 1.1391 | |
| 1.2191 | 1.1801 | 1.1492 | |
| 1.2353 | 1.1934 | 1.1594 | |
| 1.2518 | 1.2068 | 1.1693 | |
| 1.2685 | 1.2022 | 1.1791 | |
| 1.2855 | 1.2335 | 1.1886 | |
| 1.3028 | 1.2466 | 1.1977 | |
| 1.3205 | 1.259 | ||
| 1.3386 | 1.272 | ||
| 1.3570 | 1.285 | ||
| 1.3759 | 1.297 | ||
| 1.3952 | 1.310 | ||
| 1.4149 | 1.322 | ||
| 1.4351 | 1.333 | ||
| 1.4558 | 1.345 | ||
| 1.4770 | 1.356 | ||
| 1.4987 | 1.367 | ||
| 1.520 | 1.377 | ||
| 1.542 | 1.386 | ||
| 1.565 | 1.396 | ||
| 1.587 | 1.405 | ||
| 1.6105 | 1.413 | ||
| 1.634 | 1.422 | ||
| 1.657 | 1.430 | ||
| 1.681 | 1.437 | ||
| 1.704 | 1.445 | ||
| 1.7272 | 1.452 | ||
| 1.749 | 1.459 | ||
| 1.769 | 1.465 | ||
| 1.802 | 1.477 | ||
| 1.8144 | 1.482 | ||
| 1.8240 | 1.487 | ||
| 1.8312 | 1.409 | ||
| 1.8355 | 1.497 | ||
| 1.8361 | 1.505 | ||
| 1.8305 | 1.513 |
Пример 1. Нужно узнать объем 96% Н2SO4 (ρ=1,8355 г/мл), необходимый для приготовления 500мл 1М раствораН2SO4.
См = 
Вычислим, в какой массе 96% раствора содержится 49г Н2SO4:
ω%= 


Переведем массу 96% раствора Н2SO4 в объем, учитывая плотность:
ρ= 

Если необходимо приготовить раствор Н2SO4 с заданной нормальностью, расчеты ведут аналогично, но при расчете необходимой массы кислоты вместо формулы 1 пользуются формулой:
Сн = 
Пример 2. Нужно узнать объем 36% HCl (ρ=1,1791 г/мл), необходимый для приготовления 250 мл 20% раствора НСl (ρ= 1,0980 г/мл).
Найдем массу 250 мл 20% раствора НСl:
ρ= 
Узнаем массу кислоты, необходимую для приготовления 247,5 г 20% раствора НСl:
ω%= 
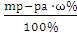

Вычислим, в какой массе 36% раствора содержится 54,9 г НСl:
ω%= 


Переведем массу 36% раствора НСl в объем, учитывая плотность:
ρ= 

Результат запишите в таблицу
| № | Объем раствора кислоты | Объем воды |
Проверьте правильность своих расчетов, показав их преподавателю.
Растворы готовятся в мерной колбе объемом 100 мл. Внимание! Разбавление концентрированных кислот (особенно Н2SO4) следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Запомните: Сначала вода, потом – кислота! Иначе случится большая беда! Мерную колбу примерно наполовину заполните дистиллированной водой. Отберите вычисленный объем исходной кислоты в пипетку и перенесите кислоту в мерную колбу. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться. Аккуратно доведите объем раствора до метки дистиллированной водой. Закройте колбу пробкой и, придерживая пробку пальцем, тщательно перемешайте, переворачивая колбу 8-10 раз вверх дном так, чтобы воздушный пузырь перемещался через всю колбу.
Опыт 2. Приготовление раствора соли с заданной массовой долей (%) из навески соли
Рассчитайте, сколько граммов соли и воды потребуются для приготовления 100 г раствора соли заданной концентрации в соответствии со своим вариантом (таблица 3).
Таблица 3. Варианты для выполнения опыта 2
| Вариант | КВr | MgSO4∙7Н2О | NaH2PO4∙2Н2О |
| 1% | 14% | 4% | |
| 3% | 10% | 7% | |
| 5% | 12% | 1% | |
| 8% | 6% | 10% | |
| 10% | 3% | 15% | |
| 14% | 1% | 9% | |
| 0,5% | 24% | 2% | |
| 20% | 0,5% | 7% | |
| 2% | 20% | 0,5% | |
| 40% | 5% | 20% | |
| 9% | 16% | 5% | |
| 24% | 5% | 16% | |
| 6% | 18% | 3% | |
| 4% | 20% | 32% | |
| 30% | 7% | 40% |
Пример 1. Нужно узнать какую массу медного купороса CuSO4∙5Н2О и какой объем воды необходимо взять для приготовления 500 г раствора с массовой долей 16 %.
Найдем массу CuSO4, необходимую для приготовления 500г 16% раствора:
ω%= 


М(CuSO4) = 64∙2+32+16∙4=160 г/моль.
Учитывая, что приготовление раствора производится из кристаллогидрата CuSO4∙5Н2О, составим пропорцию:
х= 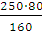
Находим массу воды:
значит m(Н2О)= m(р-ра) — m(CuSO4∙5Н2О)=500-125=375 г или 375 мл.
В том случае, если раствор готовится из безводной соли, используют формулы 1 и 2 и не прибегают к составлению пропорции:
m (CuSO4)= 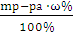
Результат запишите в таблицу
| № | Масса навески соли | Масса воды |
Проверьте правильность расчета, показав его преподавателю.
Взвесьте на лабораторных весах нужное количество соли и высыпьте ее в стакан. Вылейте в этот стакан необходимое количество воды. Воду необходимо приливать постепенно, все время перемешивая раствор. После полного растворения соли приготовленный раствор перелейте в цилиндр и измерьте ареометром его плотность. По плотности с помощью таблицы «Плотность растворов некоторых солей при 20°С» определите массовую долю соли в приготовленном растворе. Совпадает ли она с рассчитанной вами?
Плотность растворов некоторых солей при 20°С(г/мл)
Источник