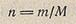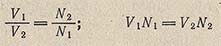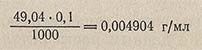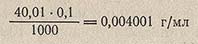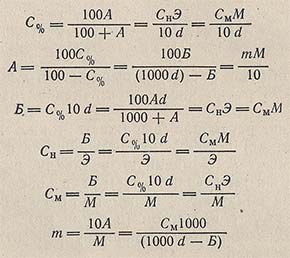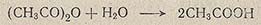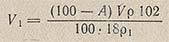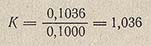- Растворы щелочей
- Приготовление растворов
- Способы выражения концентрации растворов
- Формулы перехода от одних выражений концентрации растворов к другим
- Растворимость
- Техника приготовления растворов
- Приготовление водных растворов кислот приблизительной концентрации
- Приготовление безводного раствора хлорной кислоты
- Приготовление растворов щелочей
- Приготовление водного раствора аммиака
- Приготовление рабочих растворов точной концентрации
Растворы щелочей
Приблизительные растворы. Наиболее употребительными растворами щелочей в лабораторной практике являются растворы едкого натра NaOH. Растворы едкого кали KOH готовят редко, растворы же аммиака почти всегда покупают готовыми.
Едкий натр (или едкое кали) имеется в продаже в виде препаратов: технического, чистого и химически чистого. Разница между ними состоит в процентном содержании NaOH (или KOH)1 а следовательно, и примесей. Технический * NaOH содержит значительные количества NaCl, Na2CO3, Na2SiO3, Fe2O3 и т. д. Чистый реактив содержит минимальное количество этих примесей, а хими- » чески чистый реактив содержит только следы их.
Технический едкий натр продают отлитым в железные бочки, чистый — пластинчатыми кусками, а химически чистый —в виде палочек или таблеток.
При растворении щелочи происходит сильное разогревание, в особенности в тех местах, где лежат куски ее. Чтобы растворение шло быстрее, раствор следует все время перемешивать стеклянной палочкой.
Применять стеклянную посуду при растворении щелочи не рекомендуется, потому что она может легко разбиться и работающий может пострадать, так как концентрированный раствор щелочи разъедает кожу, обувь и одежду. Если приходится готовить малые количества щелочи, то можно растворять ее и в стеклянной посуде.
Куски щелочи голыми руками брать нельзя, их следует брать тигельными щипцами, специальным пинцетом или в крайнем случае руками, но обязательно в резиновых перчатках.
Вначале рекомендуется готовить концентрированные растворы щелочи плотности 1,35—1,45 г/см3, т. е. 32— 40%-ные. В подобных концентрированных растворах
* В технике едкий натр часто называют каустической содой.
щелочи многие примеси не растворяются и при отстаивании раствора оседают на дно. Отстаивание концентрированного раствора щелочи продолжается несколько дней (не меньше двух) *. Отстоявшийся раствор осторожно сливают, лучше всего сифоном, в другой сосуд, а осадок выбрасывают или употребляют для мытья посуды.
Если в лаборатории приходится часто и в больших количествах готовить растворы щелочи, то применяют следующий прием. Сначала полностью растворяют щелочь в фарфоровой чашке, и когда раствор немного остынет (до 40—50° С), его через воронку сливают в стеклянную бутыль подходящей емкости. Бутыль хорошо закрывают резиновой пробкой, снабженной отверстием, в которое вставляют хлоркальциевую трубку, наполненную натронной известью (для поглощения двуокиси углерода). Когда щелочь отстоится и на дне образуется резко отграниченный слой осадка (в 1—2 см от дна), верхний слой раствора сливают в другую бутыль. В резиновую пробку последней вставляют две трубки, одна из которых должна входить приблизительно на 1/3 высоты бутыли, а другая должна быть на 1—2 см ниже пробки (рис. 350).
На наружный конец длинной стеклянной трубки насаживают резиновую трубку со стеклянным концом, который опускают в бутыль с отстоявшейся щелочью. Нижний конец этой трубки следует изогнуть так, как показано на рис. 350. Такой конец препятствует захвату осадка со дна бутыли даже в том случае, если конец трубки коснется осадка. Короткую трубку соединяют с вакуум-насосом. Включив насос, отстоявшийся раствор быстро и безопасно перекачивают в другую бутыль. При Переливании щелочи нужно следить, чтобы трубка, опущенная в сосуд с отстоявшейся щелочью, не поднимала осадок со дна. Поэтому ее в начале переливания держат достаточно высоко над осадком, постепенно опуская к концу переливания.
После этого определяют ареометром плотность раствора и по таблице находят процентное содержание щелочи. Если нужно приготовить более разбавленный раствор, то разбавление проводят, применяя описанные выше способы расчета.
* Естественно, что раствор едкого натра должен отстаиваться без доступа к нему двуокиси углерода. Концентрированные растворы щелочей сильно выщелачивают стекло бутылей, поэтому внутренняячасть бутыли должна быть покрыта парафином или смесью церезина и вазелина или же сплавом парафина с полиэтиленом (см. гл. 3 «Пробки и обращение с ними»).
Для покрытия стенок бутыли парафином несколько кусков его помещают внутрь бутыли и последнюю нагревают в сушильном шкафу или же над электрической плитой или газовой горелкой (осторожно) до 60—8O0C Когда парафин расплавится, бутыль поворачивают и распределяют расплавленную массу тонким слоем по всей внутренней поверхности.
Парафиновый или церезиновый слой можно нанести, применяя раствор этих веществ в авиационном бензине. Парафин вначале растворяют в бензине, полученный раствор наливают в бутыль, которая должна быть покрыта внутри парафином. Стенки бутыли обмывают внесенным раствором парафина, медленно поворачивая ее «о оси в горизонтальном положении. Когда на стекле образуется парафиновая пленка, бутыль продувают воздухом до полного вытеснения паров бензина. Затем бутыль один-два раза споласкивают водой. Только после этого ее можно заполнять щелочью или другой жидкостью.
Обработка бутылей для хранения щелочей особенно важна для аналитических лабораторий, так как предотвращает загрязнение титрованных растворов продуктами выщелачивания стекла.
Точные растворы. Приготовление точных растворов отличается тем, что для них берут химически чистую щелочь, растворяют ее, как указано выше, и определяют содержание щелочи титрованием точным раствором кислоты.

Титр раствора щекочи (т. е. точную концентрацию раствора) лучше всего устанавливать по раствору щавелевой кислоты (C2H2O4 •2H2O)*.
Продажную щавелевую кислоту следует один-два раза перекристаллизовывать и только после этого применять для приготовления точного раствора. Это двухосновная кислота и,следовательно, ее эквивалентный вес равен половине молекулярного. Так как последний равен 126,0665, то эквивалентный вес ее будет:

Приготовляя 0,1 и. раствор NaOH, мы должны иметь раствор щавелевой кислоты такой же нормальности, для чего на 1 л раствора ее нужно взять:

Но для установки титра такое количество раствора не нужно; достаточно приготовить 100 мл или максимум 250 мл. Для этого на аналитических весах отвешивают около 0,63 г (для 100 мл) перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака.
Начинающие работники при взятии навесок для установки титра часто стараются отвесить точно указанное в руководстве количество вещества (в нашем случае 0,6303 г). Этого делать ни в коем случае не надо,так как такое отвешивание неминуемо требует многократных от-
* Так как едкий натр легко поглощает двуокись углерода, то в щелочи всегда присутствует углекислый натрий. Приготовив раствор едкого натра, обязательно устанавливают его концентрацию путем титрования растворов точных навесок органической кислоты, как, например, щавелевая, яблочная и др. Поэтому нет необходимости разбавлять концентрированный раствор в мерной колбе с доведением уровня раствора точно до метки; можно, перелив его в ту бутыль, где он будет храниться, добавить воду мерным цилиндром. Следует иметь в виду, что при приготовлении растворов едких щелочей основное внимание должно быть уделено защите растворов от двуокиси углерода воздуха. Всякое сокращение операций, при которых раствор может соприкасаться с воздухом, весьма желательно, сыпаний и досыпаний вещества в тару. В результате часть вещества попадает на чашки весов и на наружную стенку тары и точно отвешенное количество вещества не удастся полностью перенести в мерную колбу. Поэтому приготовленный раствор будет неточным. Наконец, очень многие вещества изменяются на воздухе (теряют кристаллизационную воду или, как говорят, «выветриваются», поглощают из воздуха двуокись углерода и т. д.). Следовательно, чем дольше продолжается взвешивание; тем больше возможность загрязнения вещества. Поэтому сначала на технохимических весах берут навеску, сходя-> щуюся с требуемой в двух первых десятичных знаках, а затем на аналитических весах определяют точную массу. Навеску растворяют в соответствующем объеме растворителя.
Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в нашем случае будет равна не 0,1 н., а немного меньше. При таком способе несколько усложняется расчет, но достигается большая точность и значительная экономия времени.
Когда раствор будет готов, берут из него пипеткой 20 мл, переносят в коническую колбу, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пример. На титрование израсходовано 22,05 мл раствора щелочи Вычислить его титр и нормальность.
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0.6303 г. Следовательно, концентрация раствора ее не точно 0,1 н., а равна

Чтобы вычислить нормальность раствора щелочи, следует воспользоваться соотношением N[Vi = /V2-V2, т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность неизвестного раствора. В нашем случае известным является раствор щавелевой кислоты, следовательно

Нормальность раствора щелочи равна 0,08955.
Чтобы вычислить титр, или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр раствора щелочи будет:

В тех случаях, когда требуются особо чистые растворы едкого натра, их готовят или из спиртовых растворов NaOH, или из амальгамы натрия.
Металлический натрий растворяют в максимально обезвоженном этиловом спирте. Спиртовый раствор готовят приблизительно 5%-ным. Небольшой стакан, наполненный до половины и не больше чем на 3U его объема чистым керосином или лигроином, тарируют на техно-химических весгГх дробью или гирьками. Из банки, в которой хранится металлический натрий под керосином или лигроином, берут пинцетом или ножом кусочки натрия и, обрезав наружные корки ножом, переносят в тарированный стакан, отвешивая нужное количество. При этой операции гири и тару ставят на левую чашку весов, а стакан с керосином — на правую чашку. *
Иногда вместо металлического натрия применяют металлический калий или растворяют в спирте гидроокись натрия или калия. Следует помнить, что растворимость при 28° С в этиловом спирте NaOH меньше, чем растворимость КОН, почти вдвое (соответственно 14,7 г/100 г и 27,9 г/100 г).
Спиртовые растворы щелочей обычно имеют слабожелтую окраску, вызываемую осмолепием при действии щелочи на примеси, особенно непредельных соединений, которые могут присутствовать в спирте.
Для приготовления бесцветных растворов КОН, не желтеющих и не темнеющих при употреблении и хранении, рекомендован следующий прием. Около 5 мл бу-тилата алюминия прибавляют при перемешивании к 1 л этилового спирта при температуре около 20° С. Этой смеси дают стоять несколько недель, но не меньше месяца, после чего спирт осторожно сливают (лучше всего с применением сифона для декантации) и добавляют к нему требуемое количество КОН. Бутилат алюминия вызывает выпадение в осадок всех примесей, от которых зависит пожелтение или даже потемнение спиртовых растворов щелочей.
Для получения раствора NaOH можно пользоваться также амальгамой натрия. Для ее приготовления отвешивают 2,5 г металлического натрия и 100 г ртути. Ртуть наливают в пробирку, последнюю помещают в стакан, поставленный в фарфоровую чашку. Предварительно заготавливают несколько стеклянных палочек с оттянутым концом (длина палочек 35—40 см). На палочку надевают кусок асбеста так, чтобы при опускании палочки пробирка закрывалась асбестом. При шэмощи этой палочки вынимают из керосина кусочек металлического натрия величиной с горошину, быстро вытирают его фильтровальной бумагой и вносят в ртуть. Следует учитывать, что при этом возможна легкая вспышка. Постепенно вносят в ртуть весь металлический натрий. Получаемая амальгама (раствор металла в ртути) должна быть жидкой, но она может постепенно затвердеть. Жидкую амальгаму выливают в сосуд с водой, предварительно освобожденной от двуокиси углерода. Сосуд следует снабдить отводной трубкой с клапаном Бунзена. Если амальгама затвердеет, пробирку нужно разбить и кусочки амальгамы поместить в воду, не содержащую двуокиси углерода. Через два дня раствор едкого натра сливают со ртути и устанавливают его нормальность, как описано выше.
О приготовлении растворов, титр которых устанавливают по определяемому веществу, см. выше.
Для приготовления точных растворов щелочей используют также ионообменный способ. Аниониты могут быть применены для очистки растворов едкого натра и едкого кали от карбонатов и для приготовления точных растворов едкого натра и едкого кали, исходя из точных навесок хлористого натрия или хлористого калия.
Если нужно отделить только карбонаты и не загрязнять раствор ионами хлора, первые порции раствора, прошедшего через колонку в Cl-форме, отбрасывают до тех пор, пока хлорид-ион не перестанет обнаруживаться в пробе раствора.
Насыщенный карбонат-ионами анионит можно снова перевести в С1-форму обычным приемом, т. е. пропуская через колонку с соляной кислотой, затем колонку хорошо промывают водой.
Для получения точного раствора’ едкого натра или едкого кали рассчитанную навеску хлористого натрия или хлористого калия, отвешенную на аналитических весах, растворяют в дистиллированной или деминерализованной воде и полученный раствор пропускают через хро-матографическую колонку, наполненную анио-нитом в ОН-форме. Из колонки будет вытекать раствор щелочи рассчитанной концентрации.
Точные растворы NaOH или KOH лучше всего сохранять в полиэтиленовой посуде, на которую щелочи не действуют, или в стеклянной посуде парафинированной внутри.
Источник
Приготовление растворов
Растворы — однородные системы, образованные двумя или большим числом компонентов. Компонент, содержание которого в растворе преобладает, обычно называют растворителем; компонент с меньшим содержанием называют растворенным веществом.
Способы выражения концентрации растворов
Количественное содержание компонента раствора, отнесенное к определенной массе или к определенному объему раствора или растворителя, называется концентрацией этого компонента. При этом содержание растворенного вещества обычно выражают в единицах массы, в молях или в эквивалентах.
Процентная концентрация (по массе) — это число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. (Ниже процентная концентрация обозначена С%.) Так, 20% водный раствор КОН содержит 20 единиц массы КОН и 80 единиц массы воды.
Молярная концентрация (молярность) выражается числом молей растворенного вещества в 1 л раствора и обозначается буквой М или См.
Моль — единица количества вещества. Моль — это количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода 12С (6,022*10 в 23). Масса вещества, содержащаяся в 1 моле данного простого или сложного вещества, называется мольной массой. Мольная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная масса.
Число молей простого или сложного вещества n находят из отношения массы m этого вещества в рассматриваемой системе к его мольной массе М:
Произведение объема раствора, выраженного в миллилитрах, на его молярность равно числу миллимолей растворенного вещества.
Эквивалентная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора и обозначается буквами N, н. или Сн.
Эквивалентом вещества называется такое его количество, которое в данной реакции равноценно (эквивалентно) 1 молю атомов водорода (1,0079 г). Масса 1 эквивалента называется эквивалентной массой.
Выражение концентрации растворов в единицах нормальности значительно упрощает вычисление объемов растворов количественно реагирующих друг с другом веществ. Эти объемы обратно пропорциональны их концентрациям, выраженным в единицах нормальности:
Произведение объема раствора, выраженного в миллилитрах, на его нормальность равно числу миллиэквивалентов растворенного вещества.
Концентрацию растворов выражают также через титр, т. е. массой (в г или мг) вещества, содержащегося в 1 мл раствора, и обозначают буквой Т. Найденную величину называют титром по растворенному (рабочему) веществу. В аналитической практике пользуются также титром по анализируемому веществу, т. е. массой (в г или мг) анализируемого вещества, эквивалентной тому количеству реагента, которое содержится в 1 мл раствора.
Например, титр 0,1 н H2SO4 (эквивалентная масса H2SO4 = 49,04 г/моль) равен:
При титровании этим раствором NaOH титр H2SO4, выраженный по анализируемому веществу NaOH (эквивалентная масса NaOH = 40,01 г/моль) равен:
Концентрацию растворов часто выражают в единицах моляльности — числом молей вещества, растворенного в 1 кг растворителя. Моляльность обозначают буквой m.
Формулы перехода от одних выражений концентрации растворов к другим
Примем следующие условные обозначения концентрации:
С% — процентная концентрация по массе;
А — число единиц массы растворенного вещества на 100 единиц массы растворителя;
Б — масса растворенного вещества в 1 л раствора;
Сн — число эквивалентов растворенного вещества в 1 л раствора (нормальность);
См — число молей растворенного вещества в 1 л раствора (молярность);
m — число молей растворенного вещества на 1000 г растворителя (моляльность);
Э — эквивалентная масса растворенного вещества, г/моль;
М — мольная масса растворенного вещества, г/моль;
d — относительная плотность.
Растворимость
Растворимость — величина, характеризующая способность вещества образовывать с данным растворителем однородную систему. Количественно растворимость газа, жидкости или твердого тела в жидком растворителе измеряется концентрацией насыщенного раствора при данной температуре.
Обычно растворимость твердых и жидких веществ выражают коэффициентом растворимости, т. е. массой вещества, растворяющегося при данных условиях в 100 единицах массы растворителя с образованием насыщенного раствора. (Насыщенным называется раствор, находящийся в равновесии с избытком растворяемого вещества.)
Каждой температуре соответствует определенная растворимость данного вещества в данном растворителе. Сведения о растворимости приводятся в справочниках.
Растворимость газов в жидкостях повышается с увеличением давления и, в большинстве случаев, с понижением температуры.
Растворимость жидких веществ в жидкостях может быть неограниченной, когда жидкие компоненты смешиваются друг с другом в любых отношениях (этиловый спирт — вода) и ограниченной в случае несмешивающихся жидкостей. В последнем случае расслаивание жидких компонентов системы зависит от температуры; обычно взаимная растворимость компонентов возрастает с температурой. Выше некоторой температурной точки, называемой критической точкой растворимости, взаимная растворимость компонентов системы становится неограниченной (расслаивания нет).
Растворимость твердых веществ в жидкостях может изменяться в широких пределах. Обычно она возрастает с повышением температуры. Однако некоторые вещества не подчиняются этому правилу: растворимость их или понижается с повышением температуры, или повышается только до некоторого предела, выше которого растворимость уменьшается.
Техника приготовления растворов
По точности выражения концентрации растворы делят на приблизительные, точные и эмпирические.
Растворы кислот и оснований приблизительной концентрации служат в качестве вспомогательных реагентов при выполнении аналитических, препаративных и других работ. Концентрацию подобных растворов рассчитывают либо по степени разбавления исходных веществ (растворов), либо по массе вещества (взвешивается на технических весах), растворенного в известной массе растворителя. Часто приблизительную концентрацию растворов определяют по величине плотности.
Растворы с точной, заранее установленной концентрацией, называемые рабочими, стандартными или титрованными растворами, служат для определения точной концентрации других растворов.
Концентрации многих растворов вспомогательных веществ (индикаторы, специфические реактивы и др.) устанавливаются эмпирически и приводятся в соответствующих прописях.
Независимо от того, какие по точности концентрации приготовляют растворы, применять следует только чистые исходные вещества и воду высокой степени очистки, а в ряде случаев (для растворов NaOH, Na2S2O3) — очищенную от CO2.
Следует иметь в виду, что скорость растворения твердого вещества зависит от размера его частиц (тонкоизмельченное растворяется быстрее).
Некоторые вещества не смачиваются водой и плавают на ее поверхности, образуя тонкую пленку. Для приготовления водных растворов подобных веществ рекомендуют порошок вначале облить небольшим количеством этилового спирта (если он инертен по отношению к компонентам раствора), а уже затем приливать воду.
Сосуды для растворения и хранения растворов оснований должны быть снабжены хлоркальциевыми трубками, заполненными аскаритом или натронной известью, чтобы защитить раствор от СO2. В некоторых случаях растворы следует хранить в атмосфере инертного газа (N2, СO2). Растворы веществ, разлагающихся под действием света, например AgNO3, следует хранить в сосудах из коричневого стекла или покрытых черным лаком (в крайнем случае обернутых в черную бумагу).
Приготовление водных растворов кислот приблизительной концентрации
Водные растворы кислот (H2SO4, HCl, HNO3) обычно приготовляют соответствующим разбавлением исходных химически чистых концентрированных кислот. Разбавление проводят из расчета на объем, так как жидкость всегда легче отмерить, чем взвесить. Чтобы получить разбавленную кислоту (например, 1:5), к 5 объемам воды прибавляют 1 объем кислоты.
Процентное содержание концентрированных кислот контролируют по плотности, определяемой большей частью ареометром. Значения концентрации кислот в зависимости от плотности см. в справочниках.
Обращаться с концентрированными кислотами следует осторожно, так как они сильно действуют на кожу, разрушают одежду и обувь, портят полы и столы. При работе с концентрированными кислотами необходимо пользоваться резиновыми перчатками и защитными очками.
При приготовлении разбавленных растворов кислот (в особенности H2SO4) следует приливать кислоту в воду тонкой струей при непрерывном перемешивании стеклянной палочкой. Если при этом смесь сильно разогрелась, то ее охлаждают, после чего приливают следующую порцию кислоты.
Кислоту, попавшую на обувь или одежду, необходимо незамедлительно смыть большим объемом воды, нейтрализовать аммиаком или NaHCO3 и снова обмыть водой. Кислоту, разлитую на столе или на полу, засыпают песком, нейтрализуют Na2CO3, СаО, Са(ОН)2, СаСО3 и лишь после этого производят уборку.
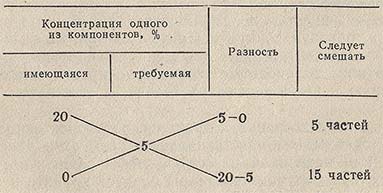
При приготовлении разбавленных растворов из более концентрированных или путем смешения растворов разных концентраций, для расчета соотношения объемов удобно пользоваться так называемым правилом креста или смешения. Это правило может быть иллюстрировано схемой получения 5% (по массе) раствора разбавлением 20% раствора:
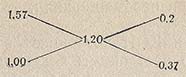
Правило креста распространяется и на случай, когда концентрация смешиваемых водных растворов выражена через плотность. Пусть дан водный раствор плотностью 1,57 г/см3. Нужно из него приготовить раствор с плотностью 1,20 г/см3. По правилу креста составляем схему:
отсюда следует, что нужно смешать 20 см3 раствора с р = 1,57 г/см3 с 37 частями по массе воды.
Расчет концентрации по правилу креста не отличается точностью, и пользоваться этим методом можно лишь для приготовления растворов приблизительной концентрации.
Приготовление безводного раствора хлорной кислоты
Раствор хлорной кислоты в безводной уксусной кислоте широко применяют в качестве титранта для кислотно-основного титрования в неводной среде.
Промышленность выпускает хлорную кислоту различной концентрации (от 42 до 70%), чаще всего в виде 57% водного раствора с плотностью около 1,50.
Избыточную воду из хлорной кислоты удаляют уксусным ангидридом:
Предварительно определив содержание воды в хлорной кислоте, последнюю растворяют в ледяной уксусной кислоте и рассчитывают, какой объем V1 (в мл) уксусного ангидрида необходим для удаления из хлорной кислоты избыточной воды:
где 100 — А — содержание воды в исходном растворе НСlO4, %; V — объем НСlO4, взятый для приготовления раствора, мл; р — плотность применяемого раствора HClO4, г/см3; p1 — плотность уксусного ангидрида, г/см3; 102 — молекулярная масса уксусного ангидрида; 18 — молекулярная масса воды.
Определенный объем HClO4 V постепенно, при непрерывном перемешивании, вливают в 800 мл ледяной уксусной кислоты, прибавляют V1 мл уксусного ангидрида, тщательно перемешивают, доводят объем раствора ледяной уксусной кислотой до 1 л и снова перемешивают. Через сутки раствор готов.
Приготовление растворов щелочей
При растворении NaOH или КОН необходимо пользоваться резиновыми перчатками и защитными очками. Щелочи вызывают химический ожог кожи, разрушают одежду и обувь. Брать твердую щелочь руками запрещается.
Водные растворы NaOH и КОН. При растворении твердых NaOH и КОН в воде происходит сильное разогревание; поэтому насыщенные растворы щелочей приготовляют в термостойкой стеклянной или, лучше, в фарфоровой посуде, постепенно добавляя твердую щелочь при перемешивании, чтобы избежать местного перегрева.
На воздухе NaOH и КОН поглощают воду и СO2. Образующиеся карбонаты мало растворимы в концентрированном растворе щелочей и постепенно выпадают в осадок.
Концентрированные растворы щелочей при хранении в стеклянной посуде разрушают стекло, выщелачивая из него кремневую кислоту. Поэтому лучше хранить их в сосудах из полиэтилена.
Из концентрированных растворов получают разбавленные растворы щелочей, концентрацию которых контролируют по плотности. Ориентировочное значение объемов разбавляемого раствора щелочи и воды можно рассчитать и по правилу креста.
Приготовление 50% раствора NaOH, не содержащего карбонатов (по ГОСТ 4517-75), производят следующим образом: в фарфоровом стакане растворяют при постепенном добавлении и перемешивании 250 г NaOH в 250 мл дистиллированной воды. После охлаждения раствор переливают в полиэтиленовый сосуд, закрывают пробкой и выдерживают 2-3 недели, до полного осаждения NaCO3. Затем прозрачный раствор сифонируют стеклянной трубкой и соответственно разбавляют водой, не содержащей СO2.
Спиртовый раствор КОН. Растворимость NaOH и КОН в метиловом спирте выше, чем в этиловом. Однако поскольку метиловый спирт очень токсичен и огнеопасен, обычно используют этанольные растворы NaOH и КОН. Растворимость NaOH в этиловом спирте при 28 °С составляет 14,7%, а КОН — 27,9%.
Для приготовления раствора КОН применяют этиловый ректификованный спирт, предварительно очищенный от альдегидов.
Наиболее эффективен следующий способ очистки: раствор из 2 г AgNO3 в 5 мл дистиллированной воды вливают в 1200 мл этилового спирта, находящегося в склянке с притертой пробкой, и тщательно перемешивают. Отдельно растворяют 5 г КОН в 25 мл горячего этилового спирта, раствор охлаждают и вливают в спиртовой раствор AgNO3. Выпадает осадок Ag2O, которому дают осесть, фильтруют и отгоняют спирт. Этиловый спирт, очищенный этим способом, остается бесцветным несколько лет.
Спиртовой раствор КОН при хранении часто приобретает слабо-желтую окраску, вызываемую осмолением примесей. Для приготовления растворов КОН, не окрашивающихся при длительном хранении, рекомендуют спирт предварительно обработать бутилатом алюминия (5 г на 1 л спирта). Смеси дают постоять 3-4 недели при комнатной температуре, после чего спирт декантируют и растворяют в нем КОН.
Приготовление водного раствора аммиака
Поступающий в продажу водный раствор аммиака плотностью 0,901-0,907 г/см3 при 20 °С, содержит 25-27% NH3. Препарат и его разбавленные растворы вполне пригодны для выполнения большинства препаративных и вспомогательных лабораторных работ.
Для аналитических работ ГОСТ 4517-75 рекомендует приготовлять растворы из баллонного жидкого синтетического аммиака или из водного аммиака, поступающего в продажу.
Газообразный аммиак вызывает раздражение глаз и слизистой оболочки носа, тошноту и головные боли. Все работы с аммиаком должны проводиться в вытяжном шкафу.
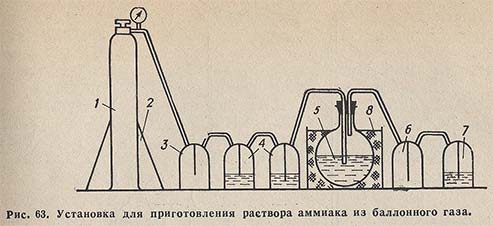
Из баллонного аммиака. Собирают установку (рис. 63). Баллон с аммиаком 1 устанавливают и закрепляют на подставке 2. Баллон соединяют с пустой промежуточной склянкой 3, к которой присоединены две поглотительные склянки 4 с раствором NaOH для поглощения СO2. Аммиак, очищенный от СO2, поступает в приемник 5, где находится дважды перегнанная дистиллированная вода, не содержащая СO2. Насыщение аммиаком проводят до достижения плотности раствора в приемнике 0,907 г/см3, что соответствует 25% раствору аммиака.
Для получения более концентрированного раствора приемник охлаждают водой со льдом в бане 8.
Склянка 6 — брызгоуловитель; склянка 7, содержащая раствор NaOH, предохраняет от попадания СO2 из воздуха в приемник.
Из водного аммиака. 500 мл водного аммиака помещают в круглодонную колбу вместимостью 1 л и осторожно прибавляют свежеприготовленную кашицу из 10 г СаО и воды.
Колбу соединяют с вертикально поставленным обратным холодильником, верхний конец которого закрывают трубкой с натронной известью, и оставляют раствор в покое на 18-20 ч. Затем собирают установку (рис. 64). Колбу 2 с водным аммиаком ставят на водяную баню 1 так, чтобы холодильник был направлен вверх под углом 45°, и соединяют верхний его конец через промежуточную колбу 4 с приемником — колбой 5, содержащей 300-400 мл воды, и закрытой трубкой с натронной известью 6. При нагревании водного аммиака на водяной бане газообразный аммиак поступает в приемник и полностью поглощается водой. Насыщение аммиаком проводят до достижения плотности раствора в приемнике 0,907 г/см3, что соответствует 25% раствору аммиака.
Приготовление рабочих растворов точной концентрации
Приготовление раствора из навески стандартного вещества. Взятую с точностью до 0,0002 г навеску высушенного стандартного вещества, которая приблизительно соответствует рассчитанной для получения определенного объема раствора заданной концентрации, аккуратно переносят в мерную колбу и растворяют в небольшом объеме дистиллированной воды, не содержащей СO2. Полученный раствор при периодическом взбалтывании разбавляют водой, доводя объем раствора в мерной колбе несколько ниже метки. Затем колбу с раствором выдерживают 15-20 мин при 20°С и осторожно добавляют воду до метки. Колбу закрывают пробкой и содержимое взбалтывают в течение 15-30 мин.
Зная массу исходного вещества и объем раствора, вычисляют его концентрацию.
Для упрощения последующих расчетов удобно пользоваться поправкой на нормальность (или коэффициентом нормальности) К. Эта поправка представляет собой отношение нормальности приготовленного раствора к заданной нормальности раствора, выраженной целыми, десятыми или сотыми долями нормальности. Например, нормальность приготовленного раствора оказалась равной 0,1036 н., а заданная 0,1 н. В этом случае
При умножении объема пошедшего на титрование раствора на эту поправку К получают эквивалентный объем заданной концентрации (в данном случае 0,1 н.).
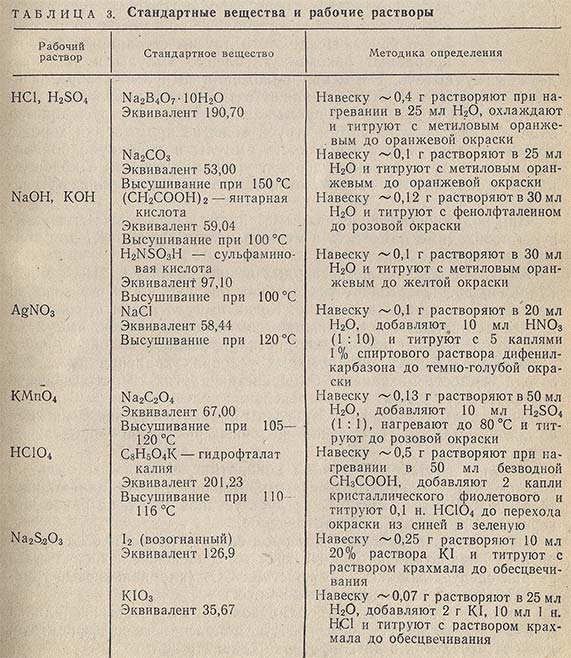
В табл. 3 приведены некоторые твердые стандартные вещества, с помощью которых точно устанавливается концентрация наиболее часто применяемых рабочих растворов.
Приготовление растворов из фиксаналов. Фиксаналы, или стандарт-титры, представляют собой точно отвешенное количество реактива или его раствора, запаянного в стеклянную ампулу. Как правило, в каждой ампуле содержится 0,1 эквивалента вещества. При количественном перенесении содержимого подобной ампулы в мерную колбу на 1 л и доведении объема раствора водой до метки при 20 °С получаются точно 0,1 н. растворы.
Выпускаются фиксаналы HCl, H2SO4, NaOH, КОН, Na2CO3, NaCl, Na2C2O4, H2C2O4-2H2O, K2Cr2O7, K2C2O4, Na2S2O3-5H2O, KMnO4, AgNO3, NH4SCN, KSCN, NaSCN, BaCl2-2H2O, (NH4)2C2O4-H2O, Na2B4O7-10H2O, KCl, K2CO3, NH4Cl, I2 и др.
Фиксаналы рекомендуется применять во всех случаях, когда требуется быстро приготовить точный рабочий раствор, не прибегая к взвешиванию.
Вначале теплой водой смывают надпись на ампуле и хорошо обтирают ее чистым полотенцем. В мерную колбу вместимостью 1 л вставляют воронку с вложенным в нее стеклянным бойком (обычно прилагается к каждой коробке фиксанала), острый конец которого должен быть обращен вверх (рис. 65). Ампуле с фиксаналом дают свободно падать так, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого другим стеклянным бойком пробивают боковое углубление ампулы и дают содержимому вытечь. Не меняя положения ампулы, в образовавшееся верхнее отверстие вставляют оттянутый в капилляр и изогнутый вверх конец трубки промывалки и сильной струей промывают ампулу изнутри. Затем струей воды из промывалки хорошо промывают наружную поверхность ампулы и воронку с бойком. Удалив ампулу из воронки, доводят уровень жидкости в колбе до метки. Колбу плотно закрывают и тщательно перемешивают раствор.
При пользовании фиксаналом 0,1 н. йода перед вскрытием ампулы необходимо поместить в мерную колбу 30-40 г KI для полного растворения йода.
Ампулы с фиксаналами твердых веществ (H2C2O4-2H2O, NaCl, KMnO4 и др.) вскрывают так же, как описано выше, но воронка должна быть совершенно сухая. Когда ампула разбита, содержимое ее осторожным встряхиванием высыпают в колбу, ампулу и воронку тщательно промывают дистиллированной водой.
Фиксанал AgNO3 при обычных условиях хранения через 2-3 года темнеет. Фиксаналы большинства других твердых веществ и кислот могут храниться неопределенно долгое время.
Фиксаналы NaOH, КОН пригодны только в течение 6 месяцев со дня их выпуска. Помутнение щелочных растворов — признак их порчи.
Рабочие растворы с точной концентрацией должны быть по возможности свежеприготовленными. Исключение составляют растворы KMnO4, титр которых следует устанавливать не ранее чем через 3-4 дня после их приготовления.
При хранении рабочих растворов следует периодически проверять их концентрацию. Рабочие растворы щелочей и тиосульфата натрия следует защищать от действия СО2 (хлоркальциевые трубки с натронной известью или аскаритом).
Сосуды с рабочими растворами должны иметь четкие надписи с указанием вещества, нормальности, поправочного коэффициента, даты изготовления и даты проверки концентрации.
Источник