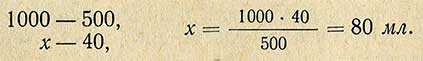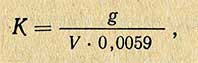Приготовление титрованного раствора NaOH
Грамм-эквивалент NaOH равен 40 г, следовательно, для приготовления 1 л 1 н. раствора требуется 40 г этого реактива. В 1 л 0,5 н. раствора соответственно должно содержаться 20 г, 0,1 н. — 4 г и т.д. Для приготовления раствора используют химически чистый реактив NaOH, растворяя его в дистиллированной воде в объеме, равном массе (весу) реактива, получая при этом насыщенный раствор NaOH.
Приготовленный раствор оставляют в склянке с резиновой пробкой на 2-3 недели для осаждения примеси карбоната натрия. После этого проверяют концентрацию полученного раствора путем титрования пробы определенного объема в присутствии индикатора метилового оранжевого. На основании полученных данных устанавливают необходимое количество насыщенного раствора NaOH для приготовления титрованного раствора.
Пример расчета. Требуется приготовить 10 л 0,1 н. раствора NaOH, для этого необходимо 10 X 4 = 40 г NaOH. Согласно проверке концентрации насыщенного раствора установлено, что в 1 л содержится 500 г NaOH. Следовательно, необходимые 40 г NaOH содержатся в следующем объеме (мл) насыщенного раствора:
Для приготовления 0,1 н. раствора необходимо взять 80 мл насыщенного раствора и довести дистиллированной водой (освобожденной от CO2 кипячением) до 10 л. Насыщенный раствор очень осторожно сливают с осадка сифоном.
Титрованный раствор щелочи хранят в склянке с пробкой, снабженной хлоркальциевой трубкой с натронной известью, для защиты от углекислого газа воздуха. Титр раствора щелочи устанавливают по янтарной кислоте или по титрованному раствору соляной кислоты.
Для установления титра 0,1 н. раствора NaOH по янтарной кислоте берут с точностью до 0,0001 г 3-4 навески химически чистой высушенной до постоянной массы (веса) кислоты по 0,20-0,25 г.
Навеску янтарной кислоты переносят в коническую колбу емкостью 250 мл и растворяют в 25-50 мл дистиллированной воды. Прибавляют к этому раствору 3-4 капли индикатора фенолфталеина и титруют раствором едкого натра до неисчезающего в течение 50-60 сек розового окрашивания. Коэффициент поправки К для титрованного раствора NaOH рассчитывают по следующей формуле:
где g — навеска янтарной кислоты, г; V — объем едкого натра, израсходованного на титрование, мл; 0,0059 — количество янтарной кислоты, соответствующее 1 мл точно 0,1 н. раствора NaCl.
Источник
Реактивы и техника приготовления растворов
Растворы щелочей. Едкие щелочи и их растворы активно поглощают влагу и углекислоту из воздуха, поэтому приготовление из них растворов точного титра затруднено. Лучше всего такие растворы изготовлять из фиксаналов. Для этого берут пробирку с фиксаналом требуемой нормальности и мерную колбу на 1 л. В колбу вставляют стеклянную воронку с вложенным в нее стеклянным бойком, острый конец которого обращен вверх.
Когда боек будет правильно уложен в воронке, ампуле с фиксаналом дают свободно падать, чтобы тонкое дно ампулы разбилось при ударе об острый конец бойка. После этого пробивают боковое углубление ампулы и дают содержимому вытечь. Затем, не меняя положения ампулы, ее тщательно промывают хорошо прокипяченной дистиллированной водой, остуженной до температуры 35- 40°С и взятой в таком количестве, чтобы по охлаждении раствора до 20°С надо было бы добавить до метки лишь несколько капель. Титрованный раствор щелочи следует хранить в таких условиях, которые исключают возможность его соприкосновения с воздухом.
Если же фиксанала нет, титрованные растворы приготовляют из препаратов едкого натра (или едкого кали). Молекулярная масса NaOH равна 40,01. Это число одновременно является и его грамм-эквивалентом.
Чтобы приготовить 1 л 1 и. раствора NaOH, нужно взять 40 г химически чистого едкого натра, а для приготовления 1 л0,1н. раствора — в десять раз меньше, т. е. 4 г.
Для удобства расчета требуемого количества исходных веществ на приготовление 1 л титрованных растворов щелочей разной нормальности рекомендуем пользоваться данными, приведенными в таблице 31.
Таблица 31
Исходные химические вещества, г
Молекулярная масса
Грамм-эквивалент
Нормальность раствора
Вещества для
установки
титров
1
0,5
0,2
0,1
0,05
0,02
0,01
NaOH
40,01
40,01
40,01
20,0
8,0
4,0
2,0
0,8
0,4
Янтарная плп щавелевая кислота
КОН
56,10
56,10
56,10
28,05
11,20
5,60
2,80
1,12
0,56
То же
Чтобы приготовить 1 л 0,1 н. раствора едкого натра, отвешивают немного больше 4 г (4,3-4,5 г) препарата и растворяют в небольшом объеме дистиллированной воды (около 7 мл).
После отстаивания раствор осторожно сливают (без осадка) в литровую мерную колбу и доводят дистиллированной свежепрокипяченной водой до метки.
Приготовленный раствор хорошо перемешивают и помещают в бутыль, защищенную от попадания углекислоты. После этого устанавливают титр, т. е. точную концентрацию раствора.
Титр можно устанавливать по щавелевой или янтарной кислоте. Щавелевая кислота (СгН204-2Н20) двухосновная, и, следовательно, ее грамм эквивалент будет равен половине молекулярной. Если молекулярная масса щавелевой кислоты равна 126,05 г, то ее грамм-эквивалент будет 126,05 : 2=63,025 г.
Имеющуюся щавелевую кислоту следует один-два раза перекристаллизовать и только после этого применять для установки титра.
Перекристаллизацию проводят следующим образом: берут произвольное количество вещества, предназначенное для перекристаллизации, растворяют нагреванием, стараясь получить возможно большую концентрацию раствора или насыщенный раствор. При необходимости этот раствор фильтруют через воронку для горячего фильтрования. Фильтрат собирают в колбу Эрленмейера, фарфоровую чашку или стакан.
В зависимости от характера кристаллизации вещества насыщенный в горячем состоянии раствор охлаждают. Для быстрого охлаждения раствора при перекристаллизации кристаллизатор помещают в холодную воду, снег или лед. При медленном охлаждении раствор оставляют стоять при температуре окружающего воздуха.
Если выпали очень мелкие кристаллы, их снова растворяют, нагревая; сосуд, в котором осуществлялось растворение, сразу же обертывают в несколько слоев полотенцем, накрывают часовым стеклом и оставляют стоять в полном покое в течение 12-15 ч.
Затем кристаллы отделяют от маточного раствора, фильтруя под вакуумом (воронка Бюхнера), тщательно отжимают, промывают и подсушивают.
Приготавливая 0,1 н. раствор NaOH, необходимо иметь раствор щавелевой кислоты такой же нормальности, для этого на 1 л раствора ее нужно взять 63,025 : 10=6,3025 г. Но для установки титра такого количества раствора щавелевой кислоты много; достаточно приготовить 100 мл. Для этого на аналитических весах отвешивают около 0,63 г перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака, например 0,6223 г. Взятую навеску щавелевой кислоты растворяют в мерной колбе (на 100 мл). Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в данном случае равна не 0,1 н., а несколько меньше.
Из приготовленного раствора берут пипеткой 20 мл, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пусть на титрование пошло 22,05 мл щелочи. Как же определить ее титр и нормальность?
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0,6303 г. Следовательно, нормальность ее будет равна не точно 0,1
Чтобы вычислить нормальность щелочи, воспользуемся соотношением VN=ViNt, т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность для неизвестного раствора. Получаем: 20-0,09873 =22,05-а:, откуда
Чтобы вычислить титр или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр щелочи будет
Но этот титр не соответствует 0,1 н. раствору NaOH. Для этого прибегают к коэффициенту к, т. е. отношению практического титра к теоретическому. В данном случае он будет равен
При использовании для установки титра янтарной кислоты раствор ее приготовляют в том же порядке, что и щавелевой, исходя из следующего расчета: молекулярная масса янтарной кислоты (С4Н604) равна 118,05 г, но так как она двухосновная, то ее грамм-эквивалент 59,02 г.
Чтобы приготовить 1 л децинормального раствора янтарной кислоты, ее нужно взять в количестве 59,02 : 10 = =5,902, а для 100 мл раствора -0,59 г.
Установка титра 0,1 н. раствора NaOH весовым методом. Для установки титра 0,1 н. раствора NaOH берем навеску янтарной кислоты с точностью до 0,0001 г (например, 0,1827 г). Навеску растворяем в дистиллированной воде (около 100 мл), затем добавляем 3-5 капель фенолфталеина и титруем щелочью (NaOH). Предположим, что на титрование пошло 28 мл NaOH. Вычисление титра NaOH и поправку к нему проводим следующим образом: так как грамм-эквивалент NaOH, равный 40,01 г, соответствует грамм-эквиваленту янтарной кислоты, равному 59,02 г, то, составляя пропорцию, узнаем, какому количеству NaOH соответствует содержащееся в навеске количество янтарной кислоты: 40,01-59,02
Вычисляем титр NaOH, т. е. содержание NaOH в 1 мл раствора. Оно равно: 0,1238 : 28=0,00442. Поправка к титру NaOH равна отношению титра практического к теоретическому
Проверка нормальности раствора щелочи по титрованному раствору кислоты. В три конические колбочки отмеряют бюреткой по 20-25 мл титрованного раствора кислоты (НС1 или H2S04) и титруют раствором NaOH до изменения окраски метилоранжа.
Допустим, что на титрование трех проб по 20 мл 0,1015 н. раствора НС1 затрачено в среднем 19,50 мл раствора NaOH. Нормальность щелочи будет
Растворы кислот. В большинстве случаев в лаборатории приходится иметь дело с серной, соляной и азотной кислотами. Они находятся в виде концентрированных растворов, процентное содержание которых узнаем по плотности.
При аналитических работах используем химически чистые кислоты. Чтобы приготовить раствор той или иной кислоты, количество концентрированных кислот обычно берем по объему, вычисленному по плотности.
Например, нужно приготовить 0,1 н. раствор H2S04. Это значит, что в 1 л раствора должно содержаться
Сколько же по объему нужно взять H2S04 с плотностью 1,84, чтобы, разбавив ее до 1 л, получить 0,1 н. раствор?
Кислота с плотностью 1,84 содержит 95,6% H2S04. Следовательно, на 1 л раствора ее нужно взять в граммах:
Выражая массу в объемных единицах, получим
Отмерив из бюретки точно 2,8 мл кислоты, разбавляем ее до 1 л в мерной колбе, затем, титруя щелочью, проверяем нормальность.
Например, при титровании установлено, что 1 мл 0,1 н. раствора H2S04 содержит не 0,0049 г H2S04, а 0,0051 г. Для вычисления количества воды, которое нужно добавить к 1 л кислоты, составляем пропорцию:
Следовательно, в этот раствор нужно добавить 41 мл воды. Но учитывая, что от исходного раствора было взято на титрование 20 мл, что составляет 0,02, то воды нужно брать меньше, т. е. 41-(41-0,02) =41-0,8 =40,2 мл. Это количество воды и добавляем из бюретки в колбу с раствором.
Приведенная выше работа при выполнении довольно кропотлива, поэтому можно готовить приблизительно точные растворы, вводя поправочный коэффициент, который применяют в работе при каждом титровании. При этом израсходованное число миллилитров раствора умножаем на поправочный коэффициент.
Поправочный коэффициент вычисляем по формуле
где V — объем испытуемого раствора, взятый для титрования;
kt — поправочный коэффициент раствора щелочи известной нормальности, по которому устанавливают титр вновь приготовленного раствора кислоты;
Ух— объем раствора щелочи известной нормальности, пошедший на титрование испытуемой кислоты.
Источник
Приготовление раствора щёлочи.
Определение молярной концентрации эквивалента, титра стандартного раствора щелочи.
ЦЕЛЬ РАБОТЫ: приготовить стандартный раствор щелочи и определить его титр и молярную концентрацию эквивалента.
1 Приготовление стандартного раствора щёлочи.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: В качестве стандартного раствора обычно употребляют раствор гидроксида калия КОН или NaOH, С(1/1) = 0,1 моль/дм 3 . Для приготовления используют твёрдую щёлочь или её концентрированный раствор.
Приготовить раствор щёлочи NaОН, С(Naон) 0,1 моль/дм 3 , из твёрдого гидроксида натрия в объёме 500 см 3 .
1н 1000 см 3 раствора NaОН — 40 г.
0,1н 500 см 3 — х г.
х = 
Щёлочь при хранении поглощает из воздуха СО2, поэтому всегда содержит примеси карбоната. Учитывая это свойство щёлочи и гигроскопичность твёрдой щёлочи, для приготовления раствора берут массу навески на 50% больше рассчитанной.
ПРИБОРЫ И РЕАКТИВЫ:
1. Раствор Н2С2O4 * 2Н2O 0,1н приготовленный из фиксанала.
2. Сухая щёлочь NaОН.
3. Дистиллированная вода.
4. Индикатор фенолфталеин.
5. Склянка на 500 см 3 .
6. Бюретка на 25 см 3 .
7. Пипетка на 10 см 3 .
8. Колбы для титрования.
На технических весах взвешивают стакан объёмом 100 — 200 см 3 и пластмассовым шпателем помещают в него кусочки NaОН. Затем в стакан наливают 30-50 см 3 дистиллированной воды и быстро сливают, и так ополаскивают кусочки 2-3 раза. При этом часть Na2СО3, покрывающей кусочки щёлочи, растворится. Если щелочь имеет чешуйчатый вид , то ее не обливают и навеску берут на 10 — 20 % больше рассчитанной. Промытые кусочки щёлочи растворяют в том же стакане охлаждённой прокипяченной водой и через воронку сливают в склянку объёмом 500 см 3 . В склянке раствор разбавляют прокипяченной дистиллированной водой до заданного объёма, закрывают и осторожно перемешивают. Приготовлен раствор щёлочи приблизительной концентрации.
2 Определение молярной концентрации эквивалента и титра стандартного раствора.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ: Установление точной концентрации приготовленного раствора щёлочи можно проводить по щавелевой кислоте Н2С2О4 * 2Н2О, янтарной кислоте Н6С4О4 или по раствору соляной кислоты НСl. Наиболее часто используется щавелевая кислота.
В точке эквивалентности образуется соль слабой кислоты и сильного основания.
рН = 7 + (4,2-1,3)/ 2 = 8,45
Индикатор фенолфталеин имеет интервал перехода 8,0 — 10,0 и обеспечивает наименьшую ошибку титрования.
В подготовленную бюретку наливают раствор щёлочи, заполняют кончик бюретки и доводят раствор щёлочи до нулевой метки. В коническую колбу, в которой проводят титрование, пипеткой переносят точный объем исходного раствора щавелевой кислоты (10 см 3 ) и добавляют 1-2 капли фенолфталеина. Титруют щавелевую кислоту щёлочью до появления от одной избыточной капли щёлочи бледно — розовой окраски, не исчезающий при перемешивание в течении 0,5 минуты.
Титрования повторяют до тех пор, пока три последних титрования не совпадут или не будут различаться не более, чем на 0,1 см 3 . Окончательным считают среднее значение из результатов трёх титрований.
Vcp( NAOH) = 
РАСЧЕТ РЕЗУЛЬТАТОВ АНАЛИЗА:
СNaOH = 
TNaOH = 
К NaOH = 
Источник