- Секреты сегнетовой соли
- КРУГОВОРОТ РЕАКТИВОВ
- Ag + + Cl — → AgCl ↓
- Ag + 2HN0 3 → AgNO 3 +NO 2 +H 2 O
- Cu + 4HN0 3 → Cu(N0 3 ) 2 +2NO 2 +2H 2 0
- AgBr + 2Na 2 S 2 O 3 → Na 3 [Ag(S 2 0 3 ) 2 ] + NaBr.
- Большая Энциклопедия Нефти и Газа
- Раствор — сегнетовая соль
- Сегнетова соль
- Содержание
- Физические свойства и применение в технике
- Химические свойства и применение в химии
- Использование в других целях
Секреты сегнетовой соли
Клуб ведут ученые, преподаватели, аспиранты и студенты Московского ордена Ленина и ордена Трудового Красного Знамени химико-технологического института имени Д. И. Менделеева при участии Всесоюзного химического общества имени Д. И. Менделеева. Председатель клуба — доктор химических наук профессор С. И. Дракин.
В 1672 году изобретательный французский аптекарь Сегнет разработал способ получения соли, которая очень хорошо помогала при заболеваниях желудка. Секрет пролзводства Сегнет долгое время никому не открывал. Теперь, конечно, ни состав соли, названной в честь аптекаря сегнетовой, ни способ приготовления никакой тайны не представляют. Это двойная соль винной кислоты, ее химическая формула KNaC 4 H 4 O 6 • 4Н 2 О.
Приготовление соли даже в домашних условиях несложно: к раствору винной кислоты Н 2 С 4 Н 4 О 6 примешивают раствор поташа К 2 СО 3 , происходит замещение одной молекулы водорода, и получается кислый виннокислый калий КНС 4 Н 4 О 6 . Если к нему добавить раствор соды Na 2 CO 3 • 10H 2 O, то в осадок выпадет сегнетовая соль.
Так и осталась бы соль лишь хорошим слабительным средством, если бы не открытие сделанное в 1880 году братьями Пьером и Жаком Кюри. Они заметили, что при растяжении, сжатии или изгибе некоторых естественных кристаллов на их гранях возникают электрические заряды. Это явление ученые назвали «пьезоэлектричеством», от греческого слова «пьезо» — давить. И когда ученые стали искать кристаллы с хорошим пьезоэффектом, оказалось, что вне конкуренции идет здесь сегнетовая соль. Она дала название новому направлению в технике — сегнетоэлектричеству.
Сегнетовая соль, которую выпускают химические заводы, имеет вид белого мелкокристаллического порошка. В таком виде она негодна для приборов, использующих пьезоэффект. Чтобы изготовить пьезоэлементы из сегнетовой соли, необходимы большие безупречные кристаллы.
Промышленное выращивание таких кристаллов производится в термостатах — сосудах, где температура поддерживается неизменной в течение длительного времени или изменяется по желанию. В основу процесса кристаллизации положено свойство большинства солей увеличивать свою растворимость с повышением температуры. Чем выше температура, тем больше можно растворить соли. При выращивании кристаллов таким способом приготовляют насыщенный раствор. Затем в него опускают затравку в виде небольшого кристаллика и температуру в кристаллизаторе немного понижают. Излишки соли, содержащейся в пересыщенном растворе, постепенно усваиваются затравкой. Искусственное пересыщение раствора можно создать и за счет отбора растворителя — воды. С этой целью внутреннюю часть крышки, закрывающей кристаллизатор, изготавливают в виде конуса, а в центре закрепляют чашечку для сбора стекающего с крышки конденсата. Конденсат из чашечки удаляют небольшими порциями с помощью вмонтированного в крышку сифона, изготовленного из тонкой стеклянной трубочки, имеющей на конце сливной кран.
Выращивать кристаллы в домашних условиях и в школе можно в очень простом термостате, предложенным А. В. Белюстиным («ЮТ» № 6 за 1976 г.).
Сегнетовая соль кристаллизуется в виде ромба, наиболее часто наблюдается форма, представляющая комбинацию из десяти граней призмы и двух замыкающих ее граней пинакоида.
Иногда при росте кристалла какая-нибудь грань сильно увеличивается в ущерб другой, а некоторые грани вообще не появляются. Для определения граней на таком кристалле пользуются основным законом кристаллографии — законом постоянства углов. Какой бы вид ни имел кристалл, углы между гранями а остаются неизменными. Так что угол между гранями P 1 и Р 2 всегда равен 163°, между Р и а — 40° и т. д.
Знание граней в кристалле необходимо потому, что пьезоэффект проявляется не на всех гранях и не с одинаковой силой. Для сегнетовой соли наибольший пьезоэффект наблюдается на грани а.
Для изготовления пьезоэлементов используются не целые кристаллы, а вырезанные из них пластинки. С кристаллографической и физической точек зрения во всяком срезе кристалла, параллельном какой-нибудь грани, раскрывается та же самая грань со всеми присущими ей свойствами. Для получения пьезоэлементов выращенный кристалл сегнетовой соли должен быть распилен на пласты, параллельные грани а.
В тех случаях, когда на кристалле грань a отсутствует, необходимое положение разреза определяется по другим существующим граням.
Кристаллы сегнетовой соли распиливаются влажной ниткой. Из пластов распиленного кристалла вырезаются нужные по форме и размерам пластинки.
Б. Витовский, Г. Добржанский
КРУГОВОРОТ РЕАКТИВОВ
Нитрат серебра AgNO 3 необходим в очень многих химических опытах. С помощью этого реактива можно доказать присутствие в растворе ионов Сl — , Вr — , I — . Реакцию образования серебряного зеркала используют в органической химии для обнаружения альдегидов. Она может быть применена и для изготовления зеркал различных оптических приборов. Высокодиоперсное металлическое серебро, получаемое восстановлением солей серебра, — мощный катализатор многих органических реакций.
Однако это вещество дорого и дефицитно. Поэтому его надо бережно расходовать, а остатки после проделанных опытов обязательно регенерировать. В школьной лаборатории некоторое количество AgNO 3 можно получить из отработанного фотографического фиксажа.
Нужно взять за правило любой раствор, содержащий пусть даже очень мало серебра, выливать в особую склянку с надписью «слив Ag». (Когда его наберется много, можно приступать к регенерации.
Сначала в склянку добавляют соляную кислоту. Находящееся в растворе серебро образует осадок хлорида:
Ag + + Cl — → AgCl ↓
Обычно в банке уже есть какой-то осадок, и образовавшийся хлорид серебра лишь добавится к нему. Дальнейшая задача — выделение соединений серебра. Для этого осадок отфильтровывают и смывают небольшим количеством воды в химический стакан. Затем добавляют туда немного соляной кислоты и кусочки цинка. Цинк можно взять от использованных батарей карманного фонаря. Далее раствор необходимо кипятить под тягой. При нагревании происходит восстановление хлорида серебра и других его соединений до металлического серебра. Если в осадке содержится медь, она также выделится в виде металла. В результате получится порошок металлического серебра, смешанный с осадком и, возможно, с медью.
Непрореагировавшие кусочки цинка вынимают и проводят декантацию. Так называется процесс, когда к осадку добавляют воду, отстаивают, осторожно сливают воду без осадка, а затем все повторяют сначала.
Тщательно промытый осадок обрабатывают ааотной кислотой. Происходят реакции:
Ag + 2HN0 3 → AgNO 3 +NO 2 +H 2 O
Cu + 4HN0 3 → Cu(N0 3 ) 2 +2NO 2 +2H 2 0
Растворив металлы в HNO 3 , добавляют воды, фильтруют и получают прозрачную жидкость, содержащую все бывшее в сливе серебро в виде нитрата. На нее действуют соляной кислотой и осаждают теперь уже чистый хлорид серебра. Его тщательно промывают декантацией и бросают в стакан с осадком AgCl кусочки цинка, после чего оставляют стоять на несколько часов.
Постепенно происходит восстановление, и серебро выделяется в виде черной, легко отделяющейся от цинка губчатой массы. Непрореагировавший цинк вынимают, серебро обрабатывают раствором НСl (чтобы удалить цинк, оставшийся незамеченным), затем водой.
При растворении выделенного порошка серебра в азотной кислоте получится регенерированный чистый нитрат серебра. Если все указанные процессы провести аккуратно, то регенерацией можно вернуть практически все израсходованное в опытах серебро.
Отработанный фотографический фиксаж содержит серебро в виде комплексного соединения, образующегося в процессе фиксирования по реакции:
AgBr + 2Na 2 S 2 O 3 → Na 3 [Ag(S 2 0 3 ) 2 ] + NaBr.
Так же как и в описанном процессе регенерации, сперва нужно извлечь серебро в виде металлического порошка. В фиксаж бросают кусочки цинка и оставляют стоять несколько дней. Цинк вытесняет содержащееся в фиксаже серебро. Металл, «обросший» выделившимися на нем мелкими кристалликами серебра, тщательно промывают декантацией и затем обрабатывают соляной кислотой. Цинк растворяется в кислоте, а порошкообразное серебро остается. Его тщательно промывают водой и затем действием HNO 3 получают нитрат серебра.
Источник
Большая Энциклопедия Нефти и Газа
Раствор — сегнетовая соль
Раствор сегнетовой соли не должен давать желтого окрашивания с реактивом Несслера. [1]
Раствор сегнетовой соли : 50 г KNaC4H4O6 — 4 Н2О растворяют в дистиллированной воде при нагревании, доводят объем до 100 мл, фильтруют. Затем добавляют 50 мл 10 / о-ного раствора NaOH и кипятят 0 5 ч для удаления следов NH3; объем раствора вновь доводят до 100 мл. [2]
Раствор сегнетовой соли ( KNaC s — 4HzO виннокислый калий — натрий): 50 г соли растворяют в 100 мл безаммиачной дистиллированной воды. Поскольку сегнетова соль часто загрязнена аммиаком, необходимо проверить приготовленный раствор на содержание иона аммония. [3]
Раствор сегнетовой соли ( KNaC jH4Oe 4НаО) получают следующим образом: 50 г кристаллической сегнетовой соли растворяют при нагревании в дистиллированной воде, доводя объем до 100 мл; затем его фильтруют, добавляя 5 мл 10 % — ного раствора NaOH, кипятят в течение 30 мин для удаления следов ЫНз, а затем вновь доводят раствор до объема 100 мл. [4]
Раствор сегнетовой соли не должен давать желтого окрашивания с реактивом Несслера. [5]
Раствор сегнетовой соли : 50 г Na КС4Н4Ов растворяют в 100 мл дистиллированной воды. [6]
Раствор сегнетовой соли 0 1 М готовят растворением навески реактива 28 222 г в дистиллированной воде в мерной колбе емкостью 1 л, доводят объем водой до метки. [7]
Добавление раствора сегнетовой соли необходимо в тех случаях, когда в растворе одновременно с аммиаком присутствуют ионы железа или других металлов, гидроокиси которых труднорастворимы. С сегнетовой солью ионы этих металлов образуют комплексные соединения и, таким образом, выпадение их гидроокисей устраняется. [8]
Следует пользоваться раствором сегнетовой соли . [9]
Нейтральный по фенолфталеину раствор сегнетовой соли ; содержащий ЗЗОг. Этот раствор должен быть защищен от попадания в него углекислоты из воздуха. [10]
Нейтральный по фенолфталеину раствор сегнетовой соли , содержащий ЗЗОг. Этот раствор должен быть защищен от попадания в него углекислоты из воздуха. [11]
В цилиндр наливают раствор сегнетовой соли и раствор едкого натра до сильно щелочной реакции. К реакционной смеси добавляют из капельной воронки при взбалтывании раствор сернокислой меди, — появляется синее окрашивание ( ср. [12]
Добавляют 5 мл раствора сегнетовой соли и 5 мл раствора едкого кали. Растворы перемешивают, доводят водой до метки колбы и измеряют светопоглощение при длинах волн 510 и 540 ммк. [13]
Экстракцию проводят СС14 из раствора сегнетовой соли . Метод использован для определения серебра в галените, сфалерите, свинцовых концентратах и других материалах. [14]
Несслера, 2 мл раствора сегнетовой соли и доводят объем раствора в колбе до метки водой. [15]
Источник
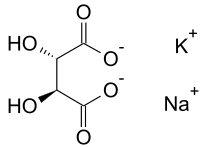
Сегнетова соль
| Сегнетова соль | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Калия-натрия тартрата тетрагидрат |
| Традиционные названия | Сегнетова соль |
| Эмпирическая формула | KNaC4H4O6·4H2O |
| Физические свойства | |
| Молярная масса | 210,16 г/моль |
| Плотность | ≈1,790 (при 20 °C) г/см³ |
| Термические свойства | |
| Температура плавления | 70—80 [1] °C |
| Температура разложения | 130—140 [1] °C |
| Химические свойства | |
| Растворимость в воде | 63 [2] г/100 мл |
| Классификация | |
| Рег. номер CAS | 304-59-6 |
Сегне́това соль — тетрагидрат двойной натриево-калиевой соли винной кислоты NaKC4H4O6·4H2O (тартрат калия-натрия). Названа по имени французского аптекаря Пьера Сеньета (Pierre Seignette), получившего её около 1655 г. (в других источниках указывается имя аптекаря Э. Сеньет [3] , а также годы получения соли — 1672 [4] и 1675).
Содержание
Физические свойства и применение в технике
Окраска кристаллов сегнетовой соли — от бесцветной до голубоватой. Разлагаться вещество начинает уже при 55,6 °C [5] (вероятно, имеется в виду частичная или полная потеря кристаллизационной воды). Построение кристалла соответствует ромбической системе (обычно вещество кристаллизуется в ромбовидные призмы с 12 гранями, 2 из которых — пинакоиды; углы между двумя боковыми гранями равны 163° un 40° [6] ).
У сегнетовой соли впервые (1920; по другим данным, в 1894 [7] г.) были обнаружены своеобразные электрические свойства — самопроизвольная поляризация в определённом интервале температур, причём эта поляризация поддаётся изменению под воздействием достаточно сильного внешнего электрического поля. Позже вещества с такими свойствами стали называть по имени сегнетовой соли сегнетоэлектриками.
Кроме того, тетрагидрат тартрата калия-натрия является одним из первых веществ, у которых были обнаружены пьезоэлектрические свойства (Пьер и Жак Кюри, 1880). Позднее эти свойства нашли применение в технике: сначала в межвоенный период в США (патент фирмы BRUSH № 2483647 [8] ), а затем и в других странах (в СССР в 1941—1942 [9] гг.) из сегнетовой соли стали изготавливать в звукоснимателях граммофонов, микрофонах, телефонных трубках и других подобных устройствах (например, в слуховых аппаратах). Особенно широко это вещество нашло применение во время повышенного спроса на электротехнику в послевоенные годы. По сравнению с другими преобразователями, выходное напряжение сегнетовой соли весьма велико (даже в три тысячи раз больше [9] [10] ). Однако изготовленные из неё преобразователи не могут храниться во влажном месте, поскольку соль из-за своей гигроскопичности постепенно расплывается.
Химические свойства и применение в химии
Так как тартрат натрия-калия — соль винной кислоты, ему соответствуют несколько оптических изомеров. В природе, как известно, встречается только L-(+)-винная кислота.
Тетрагидрат растворим в воде хорошо (54 г/100 г H2O) [1] при 15 °C, при 30 °C даже 1390 г/л [3] ), к тому же соль гигроскопична. Однако соль как таковая, очевидно, малорастворима, поскольку в реакции получения выпадает в осадок.
Тартрат натрия-калия является компонентом Фелинговой жидкости, в составе которой он используется для обнаружения сахаров. Также сегнетову соль используют в серебрении зеркал по методу Генрихсона [11] . Также эта соль используется в органическом синтезе как деэмульгатор в водных растворах, обычно в реакциях с применением гидрида алюминия. Наконец, в растворе для определения белков биуретовым методом также содержится тартрат калия-натрия.
В лаборатории эту соль получают осаждением в мелкокристаллическом виде из горячего раствора кислого тартрата калия добавлением стехиометрического количества Na2CO3.
Кристаллы большего размера выращены в космосе в условиях слабого тяготения и конвекции, например, на американской орбитальной станции «Скайлэб». Выращивают кристаллы нужного размера и в промышленности [12] .
Использование в других целях
Тартрат калия-натрия используется в пищевой промышленности в качестве добавки E337 (антиоксиданта). Он обладает солёным, холодящим вкусом. Используется эта соль и в пекарских порошках [13] . Вещество нашло применение и в медицине — в качестве слабительного (якобы аптекарь Сеньет употреблял эту соль для помощи при желудочных расстройствах [6] ). В этих целях сегнетову соль теперь часто применяют в составе порошка Сейдлица [14] .
Источник


