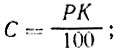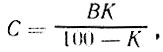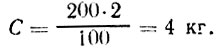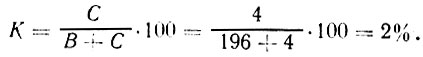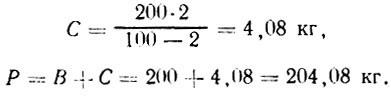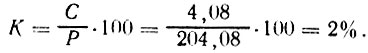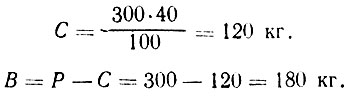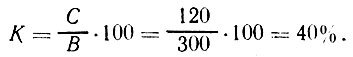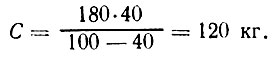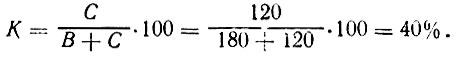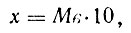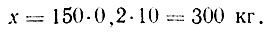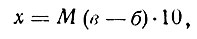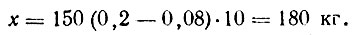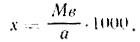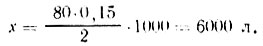- Как приготовить раствор соли необходимой концентрации
- Работа 9. Расчеты по приготовлению растворов поваренной соли, сахара и сернистой кислоты
- Приготовление растворов солей с определенной массовой долей растворенного вещества
- Правила техники безопасности
- ХОД УРОКА
- Этапы выполнения работы
- Взвешивание (6–7 мин)
- Домашнее задание
- Карточка учета умений
- Образцы отчета о проделанной практической работе
Как приготовить раствор соли необходимой концентрации
Работа 9. Расчеты по приготовлению растворов поваренной соли, сахара и сернистой кислоты
Цель работы. Научиться проводить расчеты по приготовлению растворов требуемой концентрации и определять их концентрацию по удельному весу.
Задания. 1. Рассчитать: а) сколько потребуется воды и соли для приготовления определенного количества рассола с заданной концентрацией; б) сколько необходимо взять соли на определенное количество воды, чтобы получить заданную концентрацию рассола. 2. Рассчитать: а) сколько потребуется воды и сахара для приготовления определенного количества сахарного сиропа с заданной концентрацией сахара; б) сколько необходимо взять сахара на определенное количество воды, чтобы получить заданную концентрацию сиропа. 3. Провести расчеты по сульфитации ягод и пюре при использовании диоксида серы и рабочих растворов сернистой кислоты. 4. Определить концентрацию рабочего раствора сернистой кислоты, поваренной соли, уксусной кислоты или сахарного сиропа по его плотности.
Выполнение задания 1. Концентрацию рассола выражают в процентах. Расчет проводят определением количества соли (кг) на заданный объем воды или количества соли на заданный объем рассола по формулам: (1) и (2)
где В — количество воды, кг: Р — количество рассола, кг; К — концентрация рассола, %; 100 — переводной коэффициент в проценты.
Пример 1. Необходимо приготовить 200 л рассола крепостью 2%. Рассчитать, сколько потребуется для этого воды и соли. Подставив данные в первую формулу, находим:
Воды потребуется В=Р-С=200-4=196 кг.
Пример 2. Необходимо рассчитать, сколько потребуется добавить соли к 200 кг воды, чтобы получить рассол крепостью 2%. Подставив данные во вторую формулу, находим:
Выполнение задания 2. Методика расчета требуемого количества воды и сахара аналогична методике приготовления раствора поваренной соли. В этом случае буквы будут обозначать следующее: С — количество сахара, Р — количество сиропа, К — концентрация сиропа.
Пример 1. Необходимо приготовить 300 кг сахарного сиропа с содержанием сахара 40% для приготовления компотов. Подставляем данные н формулу (1) и находим:
Пример 2. Рассчитать, сколько потребуется добавить сахара к 180 кг воды, чтобы получить сироп с содержанием сахара 40%.
Выполнение задания 3. Плоды и ягоды заливают рабочим раствором сернистой кислоты, содержащей 1. 5% диоксида серы. В сульфитированных плодах и ягодах должно быть 0,1. 0 2% диоксида серы. Если при хранении концентрация диоксида серы снижается до 0,1%, полуфабрикаты направляют на переработку или добавляют диоксид серы до требуемых норм. Все расчеты проводят на диоксид серы.
Пример 1. Определить расход диоксида серы для сухой сульфитации 150 т ягодного пюре до концентрации 0,2%.
Расход диоксида серы (кг) рассчитывают по формуле:
где М — масса пюре (сока, ягод), т; в — требуемое содержание диоксида серы в сульфитированном пюре, %; 10 — коэффициент для пересчета,
Пример 2. Имеется 150 т сульфитированного пюре, содержащего 0,08% диоксида серы. Необходимо рассчитать расход диоксида серы для подсульфитирования пюре до 0,2% диоксида серы.
Расход диоксида серы (кг) определяют по формуле:
где М — масса плодов, т; в — требуемое содержание диоксида серы в сульфитированном пюре, %; б — фактическое содержание диоксида серы, %: 10 — коэффициент для пересчета,
Пример 3. Определить расход 2%-нот рабочего раствора сернистой кислоты для сульфитации 80 т плодов из расчета содержания в сульфитированном сырте 0,15% диоксида серы.
Расход рабочего раствора сернистой кислоты (л) определяют по формуле:
где М — масса плодов, т; а — содержание диоксида серы в рабочем растворе, %; в — требуемое содержание диоксида серы в сульфитированном сырье. %; 1000 — коэффициент для пересчета. Подставив значения, получим:
Сделав расчеты, приготавливают растворы соли, сахара, сернистой кислоты и по удельному весу при помощи ареометра или другим методом определяют фактическую концентрацию растворов.
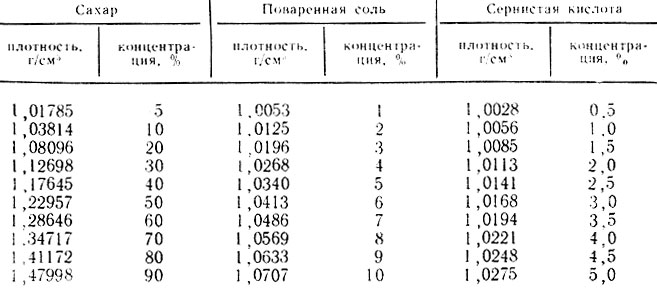
Выполнение задания 4. В мерный цилиндр на 200. 250 см наливают 150. 180 см 3 анализируемого раствора и осторожно погружают в него ареометр. Если ареометр резко опустить, то он может погрузиться на большую глубину или даже разбиться о дно цилиндра. Ареометр не должен касаться стенок цилиндра. Когда погружение ареометра заканчивается, производят отсчет по нижнему краю мениска и по данным таблицы 28 находят содержание испытываемого раствора. Определения проводят при комнатной температуре, так как ареометры градуированы при 20°С.
Таблица 28. Концентрация раствора в зависимости от его плотности
После завершения работы ареометр ополаскивают чистой водой и вытирают насухо полотенцем или фильтровальной бумагой и укладывают в футляр.
Концентрацию сахарного сиропа можно определить, используя вместо ареометра сахариметр или при помощи рефрактометра.
Материалы и оборудование. Индивидуальные задачи по расчетам; растворы сахара, поваренной соли, сернистой кислоты различных концентраций; цилиндры на 200. 250 см 3 , ареометры, воронки, полотенца или фильтровальная бумага, вода.
Техника безопасности при выполнении работы. При определении концентрации раствора сернистой кислоты необходимо соблюдать правила работы с едкими и ядовитыми веществами. Сернистая кислота легко разлагается и выделяет диоксид серы, который ядовит. При вдыхании он сильно раздражает слизистую оболочку носа, вызывает отравление органов дыхания. Поэтому работы необходимо выполнять в вытяжных шкафах, где и держать растворы. Если крепкий раствор кислоты разлили, то к пролитой жидкости необходимо добавить немного аммиачной воды для нейтрализации, а потом все собрать тряпкой.
1. По каким формулам рассчитывают концентрацию сахарного сиропа? 2. Как рассчитывают требуемое количество диоксида серы при сухой сульфитации? 3. Какие данные необходимо знать, чтобы определить расход сернистой кислоты при сульфитации сырья? 4. Как определяют концентрацию растворов при помощи ареометра?
Источник
Приготовление растворов солей
с определенной массовой долей
растворенного вещества
Практическая работа выполняется по инструкции и содержит несколько вариантов. Каждый ученик выбирает один из пяти предложенных вариантов задач. Задания, обозначенные звездочкой (*), предназначены для учащихся, успешно выполнивших предыдущие задания.
Цели. Уметь готовить растворы с определенной массовой долей растворенного вещества, используя следующие операции: взвешивание, отмеривание определенного объема жидкости, растворение; производить необходимые расчеты; знать расчетную формулу для определения массовой доли растворенного вещества, правила пользования химической посудой и реактивами.
Оборудование. Технические весы с разновесами, химический стакан, мерный цилиндр, ложечка для сыпучих веществ, стеклянная палочка, склянка под приготовленный раствор.
Реактивы. NaCl, Н3ВO3, СuSO4, NaHCO3 – все кристаллические, 30%-й раствор NaOH, дистиллированная (кипяченая) вода.
Подготовить для приготовляемых растворов склянки с этикетками, на которых формула изображена в цвете: для кислот – красным, для солей – черным, для щелочей – синим.
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.

Запрещается пробовать вещества на вкус (а),
брать вещества руками (б),
оставлять неубранными рассыпанные
или разлитые реактивы (в),
оставлять открытыми склянки с жидкостями
и банки с сухими веществами (г);
работу проводить только над столом (д)
Предварительно учащиеся получают домашнее задание, связанное с изучением содержания предстоящей работы по инструкции, используя материал учебников 8-го класса авторов О.С.Габриеляна (§ 34) или Г.Е.Рудзитиса, Ф.Г.Фельдмана (§ 30).
ХОД УРОКА
В письменном отчете записываются название темы, цели, оборудование, реактивы (4–5 мин).
Предлагается несколько вариантов расчетных задач для приготовления растворов и пример решения задачи.
Вариант № 1
Определите массы воды и борной кислоты, необходимые для приготовления 50 г раствора с массовой долей кислоты 0,02. Где применяют данный раствор?
Вариант № 2
Какие массы гидрокарбоната натрия и воды надо взять, чтобы приготовить раствор массой 50 г с массовой долей соли 10%? Где используют данный раствор?
Вариант № 3
В 45 г воды растворено 5 г NaCl. Вычислите массовую долю растворенного вещества в растворе. Для чего необходим этот раствор в быту и лаборатории?
Вариант № 4 *
Рассчитайте массы воды и безводного сульфата меди, необходимые для приготовления 100 мл раствора, содержащего 8% соли. плотность раствора – 1,084 г/мл. Где применяют полученный раствор?
Вариант № 5 *
Какую массу воды нужно добавить к 100 мл 30%-го раствора гидроксида натрия ( 
Пример решения задачи
Вычислите массы соли и воды, которые потребуются для приготовления 50 г раствора хлорида натрия, содержащего 0,1 массовой доли соли.
Этапы выполнения работы
1. После произведенных расчетов по одному из вариантов оформите их в тетради (6–7 мин).
2. Отвесьте рассчитанное количество вещества и поместите его в стакан объемом 100 мл или колбу на 200 мл.
Помните! К соли приливают воду! Кислоту добавляют в воду при постоянном перемешивании!
Взвешивание
(6–7 мин)

Технохимические весы:
1 – стойка; 2 – стремена; 3 – коромысло;
4 – чашка; 5 – стрелка; 6 – ручка арретира
· Отрегулируйте арретиром весы.
· Взвешиваемое вещество кладите на левую чашку весов, разновесы на правую. (Для левшей – на правую чашку кладут вещество, на левую – разновесы.)
· Разновесы брать только пинцетом и при снятии с весов класть сразу в те гнезда футляра, из которых они были взяты.
· После взвешивания чашка весов должна оставаться чистой.
· По окончании работы проверьте разновесы. Весы арретировать (привести в нерабочее состояние).
Жидкости на весах не взвешивают !
3. Отмерьте мерным цилиндром рассчитанный объем жидкости и вылейте в стакан с солью или водой (1–2 мин).
4. Перемешайте стеклянной палочкой смесь до полного растворения вещества. Раствор готов!
5. В отчете опишите последовательность ваших действий. Сделайте рисунок сосуда, в котором вы приготовили раствор (10 мин). 
Пример. 0,9%-й раствор NaCl называется физиологическим. Применяется для инъекций.
6. Сделайте письменный вывод о проделанной работе (5–6 мин).
7. Приведите рабочее место в порядок (1–2 мин).
Сдайте тетради на проверку.
Домашнее задание
Задача. Определите массу воды, которую нужно добавить к 50 г раствора с массовой долей соли 5%, чтобы получить раствор с массовой долей соли 2%.
Учитель следит за выполнением работы учащимися и отмечает свои наблюдения в карточке учета умений.
Карточка учета умений
| Операции практической работы | Фамилии учащихся | |||||
|---|---|---|---|---|---|---|
| А | Б | В | Г | Я | ||
| Приготовление склянки для раствора | ||||||
| Знание правил техники безопасности | ||||||
| Взвешивание вещества | ||||||
| Работа с мерным цилиндром | ||||||
| Приготовление раствора | ||||||
| Kультура выполнения опыта | ||||||
| Оформление отчета | ||||||
Образцы отчета о проделанной
практической работе
Вариант № 1
Взвешиваю 1 г борной кислоты, помещаю его в стакан и добавляю к веществу воды до метки 50 мл. Вещество растворяется в воде. Для его лучшего растворения перемешиваю раствор стеклянной палочкой. Переливаю раствор в приготовленную склянку с этикеткой.
Раствор борной кислоты используют в медицине как дезинфицирующее средство.
В лаборатории он хранится в аптечке для промывания глаз в случае попадания в них щелочи.
Вариант № 2
Взвешиваю 5 г гидрокарбоната натрия и помещаю в химический стакан вместимостью 50 мл (или 100 мл). Добавляю воды до метки 50 мл. Вещество растворяется. для его полного растворения перемешиваю раствор стеклянной палочкой. Получила 10%-й раствор NaHCO3. Переливаю раствор в склянку с этикеткой.
Полученный раствор используют для обработки кожного покрова в случае попадания на него кислоты.
Вариант № 3
Взвешиваю на весах 5 г хлорида натрия и помещаю соль в химический стакан. Мерным цилиндром отмериваю 45 мл воды и добавляю к соли. Для лучшего растворения соли перемешиваю раствор стеклянной палочкой. Переливаю раствор в приготовленную склянку.
Раствор используют в быту для засолки огурцов и квашения капусты. В лаборатории раствор NaCl используют как реактив для проведения химическиx реакций.
Вариант № 4 *
Взвешиваю на весах 8,7 г соли CuSO4. Отмериваю мерным цилиндром 100 мл воды и переливаю в стакан с солью. Перемешиваю раствор стеклянной палочкой. Приготовленный раствор переношу в склянку с этикеткой.
Раствор используют для борьбы с вредителями сельскохозяйственных культур.
Вариант № 5 *
Добавим к выданному 30%-му раствору щелочи 266 мл воды. Получили 10%-й раствор NаОН.
Внимание! Если для приготовления растворов берут щелочь в кристаллическом виде, тогда щелочь добавляют в воду.
Раствор используют в химической лаборатории для проведения химических реакций.
Вывод. Рассчитав массу вещества и объем воды, приготовили раствор с заданной концентрацией растворенного вещества, используя операции: взвешивание, отмеривание объема жидкости, растворение. Растворы широко применяются в быту и народном хозяйстве.
Источник