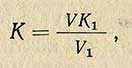- Приготовление 0,1 н. раствора йода в йодистом калии
- Способы создания и применения раствора йодной настойки по формуле
- Йод и его значение для организма человека
- Формы йодистых соединений и методы их применения
- Применение настойки йода для лечения различных заболеваний
- Приготовление настойки йода
- Особенности приготовления некоторых видов водных растворов
Приготовление 0,1 н. раствора йода в йодистом калии
Грамм-эквивалент йода — 126,9, следовательно, для приготовления 1 л 0,1 н. раствора требуется 12,69 г йода. Для приготовления титрованного раствора йода применяют реактив после предварительной очистки (возгонки), так как имеющийся в продаже йод содержит примеси.
При приготовлении 0,1 н. раствора йода берут необходимую навеску возогнанного йода и растворяют ее в концентрированном растворе йодистого калия, который готовят растворением 30-35 г его (в 2-3 раза больше навески йода) в 50 мл воды. Раствор взбалтывают до полного растворения йода в йодистом калии, затем доливают необходимое количество воды и хорошо перемешивают. Раствор йода хранят в бутылях из темного стекла, с хорошо пришлифованными пробками.
Титр 0,1 н раствора йода устанавливают по 1,0 н. раствору гипосульфита (тиосульфата). Для этого в коническую колбу с пришлифованной пробкой наливают 25-30 мл раствора йода, добавляют 20-30 мл воды и титруют 0,1 н. раствором Na2S2O3. Титрование продолжают до перехода бурой окраски в соломенно-желтую, после чего добавляют 1,5-2 мл 1%-ного раствора крахмала и титруют до полного обесцвечивания раствора. Коэффициент поправки К раствора йода рассчитывают по следующей формуле:
где V — объем 0,1 н. раствора Na2S2O3, израсходованного на титрование, мл; V1 — объем 0,1 н. раствора йода, взятого для титрования, мл; К1 — коэффициент поправки 0,1 н. раствора Na2S2O3.
Источник
Способы создания и применения раствора йодной настойки по формуле
Как правило, применение йода в сознании обывателя ограничивается сеткой на болезненном участке тела или дезинфекцией поверхностных бытовых травм кожи. Однако в жизни человека и сохранении его здоровья этот элемент таблицы Менделеева имеет гораздо большее значение.
Йод и его значение для организма человека
Открытое в 1811 году вещество, представляющее собой темные блестящие кристаллы, тщательно изучалось химиками с мировым именем, прежде чем заняло достойное место в научной среде. В процессе исследований стало понятно, что элемент плохо взаимодействует с водой, но прекрасно растворяется в спирте и собственных солях. На планете его очень мало, в основном содержится в почве, водоемах, клетках растений и животных. Отмечается закономерность в его количестве – чем дальше от морских побережий, тем меньше его концентрация.
Важно! В организме человека йод играет ключевую роль, поскольку благодаря ему формируется гормональный фон, от которого, в свою очередь, во многом зависит функционирование ЦНС, энергетический обмен, общее физическое состояние. Львиная доля содержания его в организме приходится на щитовидную железу – около 90%.
Недостаток минерала в организме может повлечь заболевание щитовидки, которое сопровождают тяжелые эмоциональные расстройства, замедленное физическое развитие ребенка, а тяжелые формы могут спровоцировать проблемы со зрением, слухом, злокачественные новообразования, паралич.
Формы йодистых соединений и методы их применения
Несмотря на широкое применение препарата в медицине, в чистом виде его практически не используют, но достаточно часто он включается в состав разнообразных лекарственных форм для усиления их биологической активности. Если задаться целью и классифицировать препараты йода, можно наблюдать четыре основные группы:
- йодсодержащие (раствор 3-5% Люголя);
- йодиды неорганические, содержание микроэлемента в которых колеблется от 25 до 25 мкг (йодид калия и натрия);
- органические субстанции, отщепляющие йод (йодинол, йодоформ);
- йодсодержащие рентгеноконтрастные вещества, в которых йод молекулярно связан.
Интересно! В Китае уже в 1567 году заболевания щитовидной железы лечили растениями, содержащими этот элемент. Полезные свойства водорослей, содержащих большое количество йода, знал и применял в лечении Гиппократ.
Современные исследования подтвердили этот факт, и его уровень в организме стал одним из индикаторов здоровья пациентов. Рекомендации врачей – обязательное включение в рацион даров моря и прочих продуктов, содержащих этот минерал, а также пищевая соль, в которую он добавлялся производителем по требованию учреждений здравоохранения.
Пятипроцентная настойка минерала на спирту была впервые использована выдающимся хирургом Пироговым, который обрабатывал этим средством раны. Впоследствии отмечалось, что вещество благотворно влияет на гнойные инфицированные раны, а сетка, нанесенная на кожу в районе воспалений, раздражая капилляры дермы, обеспечивает отток крови, восстанавливая кровообращение на поврежденном воспалением участке. С помощью таких «художеств» проводится лечение бронхов и легких, остеохондроза, болей в суставах, пояснично-крестцовом отделе и т.п.
Применение настойки йода для лечения различных заболеваний
Йодная настойка широко применяется как для наружного, так и для внутреннего употребления, избавляя от многих проблем со здоровьем.
- Гипертония. Лечение заболевания, которым страдает огромное количество людей, этим способом было разработано в Индии. Его суть заключается в том, что с помощью тампона, согласно графику, на частях тела рисуются кольца. Лечение проводится в течение месяца двумя курсами по 10 дней с таким же перерывом, причем считается, что наибольшая эффективность от такого лечение происходит в марте и сентябре.
- Насморк. Смазать препаратом пятки, затем надеть носки и отправляться на ночной отдых. Еще один способ – на 0,5 стакана воды добавить пять капель настойки выпить средство за один прием.
- Кашель. В стакан горячей воды добавить три капли настойки и выпить раствор.
Следует осторожно применять препарат, поскольку это сильнейший окислитель, оказывающий раздражающее влияние, создающий при связи с белком крови устойчивые соединения необратимого характера, повреждающие клетки.
Осторожно! Передозировка йодом вызывает воспалительные процессы слизистой и дыхательных путей, провоцирующее бронхит, насморк, слезотечение, кожную сыпь. Отмена препаратов и обильное питье, соленые продукты помогут быстро избавиться от избытка минерала.
В качестве противопоказаний отмечаются такие факторы, как:
- туберкулез;
- угревые сыпи;
- хроническая пиодермия;
- нефрит;
- геморрагический диатез.
Существует и повышенная индивидуальная чувствительность к йодсодержащим продуктам и препаратам.
Осторожно! Нельзя забывать и о токсическом воздействии препарата – 2-3 г (30 мл настойки) могут убить человека. Картина острого отравления выглядит следующим образом: из-за ожога слизистой оболочки рта, ЖКТ возникают сильные болевые ощущения, после чего повышается температура тела, снижается давление, возникают судороги и паралич, отек легких. Необходимо срочное промывание желудка, прием крахмала, отвара овсянки или ячменя, также в таких случаях эффективно применение слабительного на солевой основе.
Приготовление настойки йода
Пятипроцентную настойку йода можно приобрести в любой аптеке. химическая формула раствора йодной настойки — I 2 . В промышленных масштабах для получения одной тонны настойки берется:
- йод – 51,27 кг;
- йодид калия — 20,5 кг;
- раствор воды и спирта 1:1 – 490 л.
Йодид калия выполняет функцию стабилизатора раствора и содействует быстрому растворению кристаллов йода.
Однако, если у вас нет доступа к готовой фармакологической форме, но в наличии ингредиенты, вам поможет формула раствора йодной настойки, которая выглядит следующим образом:
- йод — 50 г;
- йодид калия – 20 г;
- этиловый спирт – 0,5 л;
- дистиллированная вода – 0,5 л.
Смешав воду и спирт, необходимо добавить в раствор остальные компоненты, дождаться их полного растворения.
Источник
Особенности приготовления некоторых видов водных растворов
Растворы легко- и быстрорастворимых веществ.
Приготовление растворов из легко- и быстрорастворимых веществ, как правило, не вызывает затруднений.
Пример
Rp.: Soluiionis Analgini 3 % — 200 ml
D. S. По 1 ст. л. 3 раза в день.
Растворимость анальгина составляет 1 : 1,5, а объем раствора равен 200 мл. Для приготовления раствора в подставку, предварительно промытую водой дистиллированной, отмеривают 200 мл воды (так как содержание твердого вещества составляет до 4 %), отвешивают 6,0 г анальгина. Растворяют, процеживают во флакон, оформляют для отпуска.
Растворы медленно растворяющиеся веществ.
Медленная растворимость вещества обычно связана с прочностью кристаллической решетки, малой скоростью диффузии тяжелых ионов или недостаточной смачиваемостью лекарственного вещества растворителем. Чтобы ускорить процесс растворения, вещество нагревают или измельчают в ступке. Термостойкие медленно растворяющиеся в холодной воде вещества, такие как кислота борная, натрия тетраборат, квасцы алюмокалиевые, амидопирин, кальция глюконат, растворяют в горячем растворителе или при подогревании. Растворимость кислоты борной в холодной воде составляет 1 : 25, в кипящей — 1 : 3.
Пример
Rp.: Solutionis Acidi borici 3,0—150 ml
Растворы крупнокристаллических веществ.
Для ускорения растворения крупнокристаллических веществ (например, натрия сульфата, магния сульфата, меди сульфата, квасцов алюмокалиевых, свинца ацетата и др.) их предварительно измельчают в ступке без растворителя или с добавлением небольшой части выписанного в рецепте растворителя.
Пример
Rp.: Solutionis Cupri sulfaiis 2 % — 200 ml
D. S. Для спринцеваний.
Меди сульфат достаточно хорошо растворяется в воде (растворимость составляет 1 : 3), однако в результате плохой смачиваемости кристаллов этот процесс проходит медленно. Для приготовления раствора по данной прописи в ступке растирают меди сульфат, добавляя постепенно 200 мл воды дистиллированной. Перемешивают до полного растворения вещества, процеживают во флакон, оформляют.
Растворы окислителей.
Растворы веществ, которые проявляют свойства окислителей (серебра нитрата, калия перманганата), легко разрушаются в присутствии органических веществ (например, при фильтровании). Помимо этого, при фильтровании происходит значительная адсорбция ионов серебра — до 3 мг на 1,0 г бумаги. Причиной разрушения могут также оказаться недоброкачественная дистиллированная вода, в том числе загрязненная микрофлорой, плохо вымытая посуда. В связи с этим окислители сначала растворяют в профильтрованной воде, а при необходимости фильтруют через стеклянный фильтр № 1 или 2. Замечено, что с уменьшением концентрации растворов разрушение окислителей снижается, особенно если фильтры и вату предварительно промыть горячей водой. Так, концентрация 1%-ного раствора серебра нитрата при соблюдении таких условий практически не меняется. Одним из важнейших условий получения устойчивых растворов окислителей является применение свежеприготовленной воды дистиллированной, очищенной от органических веществ и хлоридов.
Постоявшая вода часто обладает хорошо выраженной восстановительной способностью вследствие содержания микрофлоры и продуктов ее жизнедеятельности.
Пример
Rp.: Solutionis Argenti nitratis 0,12 — 180 ml
Для приготовления раствора серебра нитрата это вещество в прописанном количестве растворяют в профильтрованной воде. При необходимости полученный раствор профильтровывают через стеклянный фильтр № 1 или через ватный тампон, тщательно промытый горячей водой дистиллированной. Отпускают во флаконах темного цвета в опечатанном виде с этикеткой “Обращаться с осторожностью”. Растворы серебра нитрата с концентрацией выше 2 % отпускаются только в руки врача или по его доверенности. Аналогично готовят разбавленные растворы калия перманганата. Для отпуска раствора нужна склянка из темного стекла.
Пример
Rp.: Solutionis Kalii permanganatis 1 : 4000 — 500 ml
D. S. Для полоскания горла.
Для приготовления концентрированных растворов калия перманганата необходимо иметь в виду то, что он плохо растворяется в холодной воде (1 : 18), поэтому вещество предварительно растирают с горячей водой (при этом растворимость его резко повышается — 1 : 3,5). Кроме того, концентрированные растворы калия перманганата нуждаются в освобождении от двуокиси марганца, которая почти всегда присутствует в составе препарата и катализирует его разложение под влиянием света. Для удаления двуокиси марганца используют длительное отстаивание раствора и сливание его с осадка. В аптечной практике эту операцию чаще всего проделывают при помощи стеклянного фильтра.
Пример
Rp.: Solutionis Kalii permanganatis 5 % — 50 ml
В мерную колбу вместимостью 50 мл наливают 10—15 мл горячей процеженной воды, а в ступку кладут 2,5 г калия перманганата, который затем осторожно растирают с 5—10 мл приготовленной горячей воды и сливают в колбу. Объем раствора в колбе доводят до 50 мл, после чего раствор готов к отпуску. Если прописанная концентрация калия перманганата в растворе менее 1 %, то препарат растворяют без растирания в ступке с водой. Отпуск растворов калия перманганата осуществляется в темных флаконах во избежание активации процесса восстановления препарата под действием света.
Растворы труднорастворимых веществ.
Из растворов труднорастворимых веществ возможно получение легкорастворимых соединений.
Так, растворимость кристаллического йода в воде составляет 1 : 5000, однако такой раствор не находит применения в медицинских целях.
Насыщенный раствор йода, получаемый настаиванием препарата с водой, имеет буроватую окраску и иногда служит реактивом. Для получения более концентрированных растворов используют способность йода образовывать легкорастворимые комплексные соединения с калия или натрия йодидами.
В медицинской практике наиболее распространены растворы Люголя для внутреннего (в концентрации 5 %) и наружного (в концентрации 1 %) применения.
Получение водных растворов йода такой концентрации основано на образовании легкорастворимых комплексных соединений йода с йодидами щелочных металлов:
Пример
D. S. Для смазывания десен.
Этот раствор готовят по следующей прописи:
Kalii iodidi 0,4
Aquae destillatae 20 ml
В процессе изготовления раствора Люголя существенным условием является растворение йода в возможно концентрированном растворе йодида, т.е. растворение смеси йода и йодида металла в предельно малом количестве воды. При несоблюдении этого принципа скорость растворения йода уменьшается. В большинстве случаев растворение производят в фарфоровой ступке. Взвешивание йода должно осуществляться по возможности быстро во избежание воздействия его паров на коромысло весов. Для удаления остатков препарата чашку ручных весов следует тщательно вытереть кусочком ваты или бумажной салфетки, смоченным крепким спиртом. Необходимо помнить, что взвешивать йод на металлических чашках весов нельзя; для этих целей рекомендуется использовать кусочек пергаментной бумаги. Наиболее целесообразным является помещение йода и калия йодида в подставку и добавление к ним сначала около 1,5 мл воды. После растворения йода (что происходит практически сразу) раствор доливают до нужного объема водой. Во избежание порчи дистиллированной воды в результате загрязнения ее парами йода доливание раствора водой должно производиться из отдельной тары. После изготовления растворы йода процеживают через небольшой комок промытой ваты или стеклянные фильтры. Как уже отмечалось, фильтрование через бумагу не рекомендуется, так как последняя адсорбирует много йода. Отпуск йодных растворов производят в посуде оранжевого стекла, так как в присутствии воды и под действием света йод разлагается. Флаконы укупоривают резиновыми или парафинированными пробками (так как корковые пробки быстро разрушаются). Ртути дийодид также почти нерастворим в воде. Однако иногда его назначают внутрь в виде растворов, содержащих до 0,07 % действующего вещества.
Для получения таких растворов пользуются тем, что ртути дийодид образует легкорастворимые комплексные соли с йодидами щелочных металлов.
Пример
Kalii iodidi 6,0
Aq. destillata 180 ml
В данном примере для ускорения процесса изготовления раствора ртути дийодида необходимо обработать его возможно концентрированным раствором йодида калия. Для приготовления раствора в чистую подставку отвешивают калия йодид и ртути йодид, добавляют немного воды (2—3 мл). После полного растворения всех крупинок ртути дийодида доливают воду до необходимого количества. Готовый раствор процеживают через вату в тару из темного стекла, проверяют чистоту раствора, опечатывают. Ртути дихлорид (сулема) применяется как антисептическое средство в виде 0,1—0,2%-ного раствора. Это вещество медленно растворяется в холодной воде (1 : 18,5), а при нагревании растворимость его повышается до 1 : 3. В некоторых случаях при изготовлении раствора сулемы используют ее свойство образовывать легкорастворимые комплексы с натрия хлоридом, который понижает гидролиз ртути дихлорида, повышает устойчивость раствора и уменьшает раздражение тканей вследствие снижения кислотности. Отвешивают ртути дихлорид как препарат списка А на особых весах, используемых только для определения массы ртути дихлорида. Кроме того, для приготовления раствора ртути дихлорида применяется отдельная посуда, которую немедленно после его изготовления моют и убирают на место. При использовании раствора сулемы в качестве дезинфицирующего средства его готовят путем растворения равного по массе количества ртути дихлорида и натрия хлорида. Полученный раствор окрашивают эозином.
Пример
Rp.: Solutionis Hydrargyri dichloridi 1,0 : 1000 — 300 ml
В небольшом количестве воды (10—15 мл) растворяют 0,3 г ртути дихлорида и 0,3 г натрия хлорида. Затем добавляют остальную воду, процеживают в склянку для отпуска, куда добавляют 3—5 капель раствора эозина. Флакон с раствором сулемы опечатывают и снабжают этикетками “Яд”, “Обращаться с осторожностью” и изображением черепа со скрещенными костями. Помимо этого, на этикетке должны быть указаны название, концентрация и назначение раствора.
Еще одно труднорастворимое вещество — осарсол. Он очень мало растворим в воде, но хорошо растворяется в растворах едких щелочей и в растворе натрия гидрокарбоната.
Пример
Kalii iodidi 0,3
Natrii hydrocarbonatis 4,0
Aquae destillatae 15 ml
M. D. S. Для влагалищного обтирания.
При изготовлении раствора по данной прописи возможна реакция нейтрализации, поэтому сначала растворяют натрия гидрокарбонат в воде и только потом к раствору дробными порциями добавляют осарсол при постоянном помешивании. Калия йодид и йод кристаллический растворяют в нескольких каплях воды, добавляют глицерин и затем приготовленный раствор осарсола. Перемешивают, оформляют. Отпуск растворов осарсола производят в соответствии с требованиями нормативной документации для веществ списка А. Растворы фурацилина также в связи с плохой растворимостью готовят при нагревании в концентрации 1 : 5000. Если врач в рецепте специально не указал растворитель, то для этих целей применяют 0,9%-ный раствор натрия хлорида, который уменьшает раздражающее действие фурацилина.
Пример
Rp.: Solutionis Furacilini 1,0 : 5000 — 200 ml
При изготовлении раствора по данной прописи 0,04 г фурацилина и 1,8 г натрия хлорида растворяют в дистиллированной воде при нагревании.
Процесс осуществляют в колбе или эмалированной посуде. Оформляют к отпуску.
Темисал представляет собой смесь натрия теобромината и натрия салицилата. Свежеприготовленный темисал легкорастворим в воде, освобожденной от углекислоты. В результате образуются щелочные растворы, связывающие двуокись углерода. Некачественный темисал, поврежденный действием двуокиси углерода, растворим в горячей воде, однако при охлаждении раствора выделяет нерастворимый осадок теобромина.
Пример
Aq. destillata aa 60 ml
M. D. S. Раствор темисала.
При изготовлении растворов темисала необходимо использовать только воду, не содержащую углекислоту (свежую или прокипяченную). В этом случае качественный препарат растворяется без затруднений. Если же темисал полностью в воде не растворился, его заливают полуторным количеством свежепрокипяченной горячей воды, полученный раствор охлаждают. Выпавший осадок, который представляет собой теобромин, растворяют путем осторожного и медленного прибавления (по каплям) 15%-ного раствора едкого натра. Готовый раствор разбавляют до требуемой концентрации свежей водой, процеживают, отпускают в плотно закупоренной стеклянной таре с этикеткой “Перед употреблением взбалтывать”.
Насыщенные растворы.
Иногда в качестве лекарственных препаратов применяют насыщенные растворы различных веществ (например, насыщенный раствор натрия гидрокарбоната, применяемый в виде ушных капель). Самым простым способом приготовления насыщенных растворов является длительное настаивание растворителя с избытком растворяемого вещества при периодическом помешивании смеси. Так приготавливают, например, известковую воду (насыщенный раствор кальция гидроокиси), гипсовую воду и др. Однако данный метод занимает много времени и поэтому неудобен для приготовления насыщенных растворов по рецептам. Другой вариант приготовления насыщенных растворов заключается в растворении в горячем растворителе исходного вещества, взятого в количестве, превышающем предел его растворимости. Готовый раствор охлаждают, при этом происходит кристаллизация избытка растворенного вещества, который в дальнейшем отфильтровывают. Недостатком такого метода является то, что раствор получается в некоторой степени пересыщенным, а при хранении часть растворенного вещества все же медленно выделяется в виде кристаллов. Для термолабильных веществ этот способ непригоден. Наиболее распространенным способом быстрого приготовления насыщенных растворов, пригодным в том числе и для термолабильных веществ, является 10—15-минутное растирание в ступке исходного вещества, взятого в небольшом (примерно на 0,3—0,5 г) избытке с растворителем при комнатной температуре. Нерастворившийся остаток отфильтровывают.
Растворы, содержащие газообразные лекарственные вещества.
Растворы лекарственных препаратов, содержащие газообразные вещества (углекислый газ), называются микстурами-сатурациями (или просто сатурациями (saturationes)). Эта лекарственная форма была предложена еще в начале XVII в. Как правило, сатурации изготавливают из натрия и калия карбонатов и гидрокарбонатов, а также органических кислот (например, винной, лимонной или уксусной). При взаимодействии этих веществ в присутствии воды образуются соответствующие соли и выделяется углекислый газ.
Пример
Rp.: Natrii carbonatis crystallisati 5,0
Kalii carbonatis 1,0
Acidi tartarici q. s. ad reactionem paululum acidatis
Aq. destill. 200,0
Технология приготовления растворов с газообразными веществами, в том числе и по приведенной прописи, заключается в следующем: в толстостенную склянку или бутылку отмеривают холодную дистиллированную воду, растворяют в ней указанную в рецепте соль. Затем в полученный раствор маленькими порциями добавляют необходимое количество кислоты и легкими вращательными движениями перемешивают. Готовые сатурации тщательно укупоривают, оформляют к отпуску. Сатурации, содержащие избыток углекислого газа, приготавливаются несколько иначе.
Пример
Acidi tartarici 2,5
Natrii hydrocarbonatis q. s. ad saturationem
Sirupi Cerasi 15,0
Aq. destill. ad 200,0
Для приготовления данной сатурации на дно толстостенной склянки емкостью 250 мл помещают натрия гидрокарбонат, на который наливают концентрированный раствор магния сульфата (в 10—12 мл воды). Поверх образовавшегося солевого затвора осторожно наслаивают раствор винной кислоты в остальной части воды, а на него — вишневый сироп. Отпускную стеклянную тару немедленно закупоривают и только после этого содержимое смешивают легким вращательным движением. Полученную сатурацию отпускают с этикеткой “Хранить в прохладном месте”. В последнее время сатурации в аптеках готовят крайне редко. Вместо них используют природные сатурации — минеральные воды, которые по своим солевым компонентам отличаются значительно большим разнообразием.
Источник