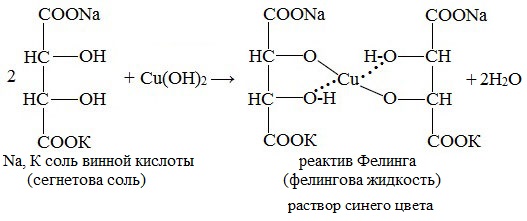
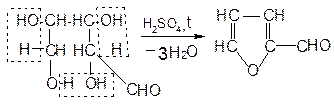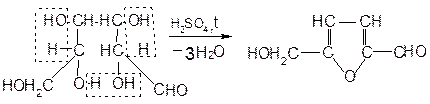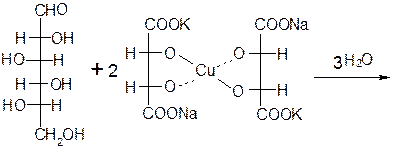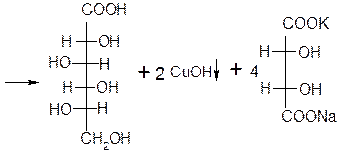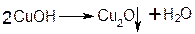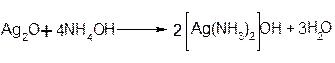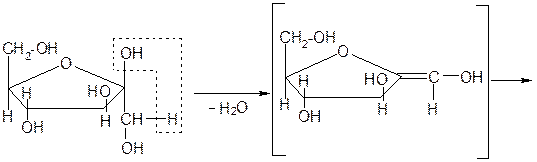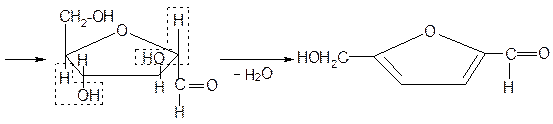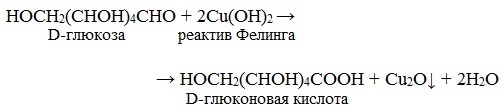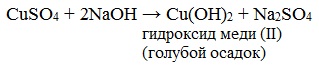- Приготовление реактива Фелинга (фелинговой жидкости).
- Как приготовить реактив фелинга
- Реакция на моносахариды
- Реакция на альдегиды
- Образование реактива Фелинга
- ФЕЛИНГА РЕАКТИВ
- Определение редуцирующих сахаров. Реактивы: Фелинг № 1 (Чистую кристаллическую соль CuS04· 5H20 40 г растворяют в 1 дм3 дистиллированной воды); Фелинг № 2 (щелочной раствор калия-натрия
Приготовление реактива Фелинга (фелинговой жидкости).



УГЛЕВОДЫ.
Углеводы – важнейшие природные органические соединения, в состав которых входят карбонильная и не менее двух гидроксильных групп. По составу и строению углеводы делят на несколько групп. Простые углеводы, или моносахариды, — это вещества не способные гидролизироваться (например, глюкоза и фруктоза и др.). Углеводы состоящие из двух и более остатков моносахаридов, называются – олигосахаридами. В эту группу углеводов входят дисахариды (сахароза, лактоза и др.). Полисахариды, или полозы, состоят из большого числа остатков моносахаридов, определенным образом связанных между собой (крахмал, гликоген, клетчатка и др.).
Лабораторная работа №10.
МОНОСАХАРИДЫ.
ОПЫТ №1: Качественная реакция на углеводы с α-нафтолом (реакция Молиша).
При взаимодействии с концентрированной серной кислотой все углеводы разлагаются с образованием различных веществ, в частности фурфурола и его производных, которые конденсируются с α-нафтолом с образованием окрашенных соединений.
Реактивы и оборудование: концентрированные растворы углеводов: глюкозы (моносахарид), сахарозы (дисахарид) и крахмала (полисахарид), 15% спиртовой раствор α-нафтолола, концентрированная серная кислота; пипетки, пробирки.
Ход работы: В три пробирки наливают по 1 мл концентрированных раствора углеводов. В первую – глюкозу, во вторую – сахарозы и в третью – крахмал. Во все пробирки добавляют по 2-3 капли 15% спиртового раствора α-нафтола, а затем осторожно по стенке при помощи пипетки приливают по 1 мл концентрированной серной кислоты. Серная кислота опускается на дно пробирки, и на границе двух слоев постепенно образуется кольцо красно-фиолетового цвета.
Схема образования фурфурола и оксиметилфурфурола:
ОПЫТ №2: Окисление моносахаридов реактивом Фелинга.
Реактивом Фелинга легко окисляются как альдозы, так и кетозы, но следует отметить, что в реакцию с данным реактивом вступают не сами кетозы, а продукты их щелочной деструкции в присутствии окислителя.
Приготовление реактива Фелинга (фелинговой жидкости).
Готовят два раствора: а) 34,6 г кристаллического сульфата меди в 500 мл воды; б) 173 г сегнетовой соли (натриво-калиевая соль винной кислоты), 70 г гидроксида натрия в 500 мл воды. Перед употреблением смешивают равные объемы этих растворов.
Реактивы и оборудование: 1% раствор глюкозы, 1% раствор фруктозы, реактив Фелинга; спиртовки, пипетки, пробирки.
Ход работы: В две пробирки по 1 мл 1% раствора глюкозы 1% раствора фруктозы. В обе пробирки добавляют по 1 мл реактива Фелинга. Содержимое пробирок тщательно перемешивают и нагревают верхнюю часть раствора до начинающегося кипения. В обоих случаях в верхней части раствора появляется желтый осадок гидроксида меди (I), переходящий в красно-оранжевый осадок оксида меди (I). Цвет нижней части пробирок остается неизменным.
D-глюкоза реактив Фелинга
Реактивом Фелинга пользоваться удобнее, чем гидроксидом меди (II), так как при нагревании этого реактива с раствором моносахарида не происходит образование черного осадка оксида меди (II), маскирующего красно-оранжевый цвет осадка оксида меди (I). К тому же реакция с фелинговой жидкостью протекает быстрее, поэтому ее широко используют для качественного и количественного определения моносахаридов.
ОПЫТ №3: Окисление моносахаридов аммиачным раствором гидроксида серебра (реакция ″серебряного зеркала″).
Реактивы и оборудование: аммиачный раствор серебра, 1% раствор глюкозы, 1% раствор фруктозы; водяная баня, пипетки, пробирки.
Приготовление аммиачного раствора серебра.
К 1% раствору нитрата серебра при встряхивании по каплям прибавляют 5% раствор аммиака до тех пор, пока образовавшийся в начале осадок полностью не раствориться:
Ход работы: В двух чистых пробирках готовят по 2 мл аммиачного раствора серебра. В первую добавляют 1,5 мл 1% раствора глюкозы, во вторую 1,5 мл 1% фруктозы. Пробирки ставят на водяную баню при 70-80˚ С на 10-15 минут. Металлическое серебро выделяется и оседает на стенках обеих пробирок. Следует помнить, что при нагревании пробирки нельзя трогать и встряхивать, иначе серебро выпадет в виде черного осадка.

ОПЫТ №4: Реакция Селиванова на кетогексозы.
Реактивы и оборудование: 2% раствор глюкозы, 2% раствор фруктозы, насыщенный раствор меда, реактив Селиванова; водяная баня, пипетки, пробирки.
Приготовление реактива Селиванова:
50 мл концентрированной соляной кислоты смешивают с 50 мл воды, к полученному раствору добавляют 0,5 г резорцина.
Ход работы: В три пробирки наливают по 2 мл реактива Селиванова. В первую добавляют 3-4 капли 2% раствора фруктозы, во вторую столько же раствора меда, в третью – глюкозы. Пробирки ставят на водяную баню при 80˚ С на 5-10 минут. В пробирке с фруктозой появляется оранжевое, переходящее в розово-красное окрашивание. Раствор, содержащий глюкозу, не окрашивается. Так как натуральный мед состоит преимущественно из фруктозы, в пробирке с его раствором так же развивается розово-красное окрашивание. Этот опыт может служить проверкой натуральности меда.
Эта реакция позволяет различить альдозы и кетозы. При нагревании с соляной кислотой фруктоза (кетоза) превращается в оксиметилфурфурол, который вступает в реакцию конденсации с резорцином, в результате чего получается соединение окращенное в розово-красный цвет. Альдозы так же дают эту реакцию, но протекает она гораздо медленнее и при длительном кипячении.
Источник
Как приготовить реактив фелинга
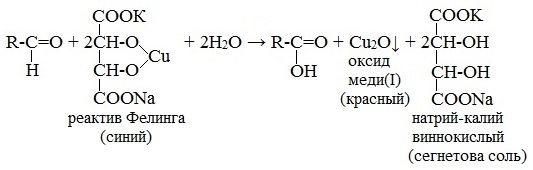
Реактив Фелинга (медно-тартратный реактив, фелингова жидкость) — состоит из равных объемов раствора сложной соли тартрата натрия-калия (сегнетова соль, натрий-калий виннокислый) в 10%-ном р-ре NaOH и раствора сульфата меди.
Приготавливается непосредственно перед анализом путем смешения двух растворов.
Применяется для качественного и количественного определения альдегидов жирного ряда и в особенности моносахаридов. Действие реактива Фелинга основано на восстановлении иона двухвалентной меди до одновалентной за счёт окисления альдегидных групп исследуемых соединений.
При этом на холоде выпадает оранжево-жёлтый осадок гидроксида меди (I) СuОН, а при нагревании – красный осадок оксида меди (I) Сu2O.
Впервые был предложен в 1850 году немецким химиком Г. Фелингом.
Реакция на моносахариды
Глюкоза окисляется свежеосажденным гидроксидом меди (II) в щелочной среде до глюконовой кислоты, восстанавливая ионы Cu +2 до Cu +1 . Углеводы подобного типа называют восстанавливающими.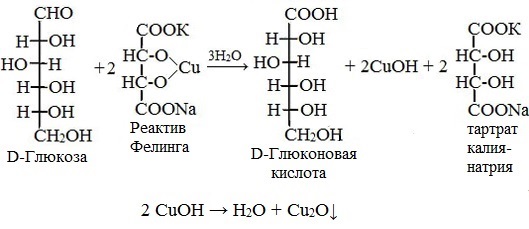
Эта реакция применяется для количественного определения сахаров в пищевых продуктах.
Реакция на альдегиды
Альдегиды жирного ряда восстанавливают двухвалентную медь в одновалентную.
Ароматические альдегиды эту реакцию не дают.
Образование реактива Фелинга
Реактив Фелинга используется как качественная реакция для определения альдегидной группы.
Источник
ФЕЛИНГА РЕАКТИВ
ФЕЛИНГА РЕАКТИВ (фелингова жидкость), р-р CuSO 4 и тартрата калия-натрия в 10%-ном р-ре NaOH; реактив на восстановители, гл. обр. альдегиды и моносахариды. Готовят непосредственно перед употреблением. Р-цию проводят, добавляя к 10 мл Фелинга реактива ок. 0,5 мл или 0,25-0,5 г исследуемого в-ва. При анализе нелетучих соед. смесь нагревают сразу, а при анализе летучих соед. ее предварительно выдерживают при комнатной т-ре. В присут. восстановителей после нагревания осаждается оксид или гидроксид меди(I); цвет осадка от желтого до красного, иногда зеленого в зависимости от степени дисперсности и размера его частиц.
Аналогично реагируют кетозы (последние в щелочной среде легко изомеризуются в альдозы), многоатомные фенолы, фенилгидразин и др. орг. производные гидразина, а также гидразиды карбоновых к-т. Кетоны (за исключением кето-спиртов), одноатомные фенолы и большинство ароматич. альдегидов не восстанавливают Фелинга реактив. Однако, напр., 2,4-ди-гидроксибензальдегид реагирует с ним. Для обнаружения углеводов иногда используют т. наз. нейтральный Фелинга реактив, к-рый вместо NaOH содержит Na 2 CO 3 .
Ароматич. гидразины взаимод. с Фелинга реактивом с выделением газообразного N 2 ; на этом основаны разл. объемные методы их определения. Фелинга реактив применяют и для количеств, определения восстанавливающих Сахаров. Для определения алифатич. альдегидов чаще используют реактив Бенедикта (содержит CuSO 4 , цитрат Na и Na 2 CO 3 ), к-рый более чувствительный.
Фелинга реактив предложен Г. Фелингом в 1849.
Лит.: Файгл ь Ф., Капельный анализ органических веществ, пер. с англ., M., 1962, с. 168-69; Полюдек-Фабини Р., Бейрих Т., Органический анализ, пер. с нем., Л., 1981, с. 11, 512. H. К. Куцева.
Источник
Определение редуцирующих сахаров. Реактивы: Фелинг № 1 (Чистую кристаллическую соль CuS04· 5H20 40 г растворяют в 1 дм3 дистиллированной воды); Фелинг № 2 (щелочной раствор калия-натрия
Реактивы: Фелинг № 1 (Чистую кристаллическую соль CuS04· 5H20 40 г растворяют в 1 дм 3 дистиллированной воды); Фелинг № 2 (щелочной раствор калия-натрия винно-кислого-сегнетовой соли (растворяют в воде отдельно 200 г калия-натрия винно-кислого и 150 г гидрата окиси натрия или 210 г гидрата окиси калия, растворы сливают в мерную колбу и доводят объем водой до 1 дм 3 ; раствор железоаммонийных квасцов (растворяют в воде 86 г квасцов, осторожно добавляют 200 г (180 см 3 ) концентрированной серной кислоты и разводят водой до 1 дм 3 ); серная кислота плотностью 1,83. 1,84 г/см 3 ; 0,02 н раствор марганцово-кислого калия; 20 % раствор сернокислого цинка; 2,5 н раствор гидроокиси натрия, 20 % раствор соляной кислоты.
Титр раствора устанавливают по щавелево-кислому натрию. Взвешивают 0,14 ± 0,0003 г щавелево-кислого натрия, освобожденного от гигроскопической влаги высушиванием при температуре 120 °С, количественно переносят 100 см 3 воды в коническую колбу и растворяют при перемешивании. К раствору добавляют 2 см 3 серной кислоты, нагревают смесь до (80 ± 2) °С и титруют раствором марганцовокислого калия до появления розового окрашивания.
Титр раствора марганцово-кислого калия в мг меди (Ткмn04/сu) рассчитывают по формуле:
Ткмn04/сu= 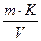
где m — масса навески щавелево-кислого натрия, г; К — коэффициент пересчета щавелево-кислого натрия на медь, равный 0,9488; V — объем раствора марганцовокислого калия, использованный на титрование навески щавелево-кислого натрия, см 3 .
Титр раствора марганцово-кислого калия можно установить по щавелево-кислому аммонию (К = 0,8591) или свежеперекристаллизованной щавелевой кислоте (К = 1,0086).
Оборудование, материалы: стеклянный или пластмассовый насос водоструйный лабораторный; фильтр стеклянный с пластиной № 4 из пористого стекла; термометр ртутный стеклянный лабораторный до 100 °С; бюретка вместимостью 25 см 3 ; колбы для фильтрования под вакуумом вместимостью до 500 см 3 ; конические колбы вместимостью 100, 200 и 250 см 3 ; пипетки на 20 и 25 см 3 ; цилиндр вместимостью 50 см 3 ; фарфоровые чашки вместимостью 100 см 3 .
4.1.1.1 Подготовка пробы
Навеску (от 7 до 30 г в зависимости от ожидаемого количества углеводов, или 20 см 3 раствора), взвешенную с абсолютной погрешностью не более 0,01 г, растирают в фарфоровой ступке с небольшим количеством воды и переносят в мерную колбу на 250 см 3 . Туда же добавляют 3- 4 см 3 20 %-ный раствора сернокислого цинка и 1,5 -2 см 3 2,5 н раствора гидроокиси натрия. Раствор сернокислого цинка и гидроокиси натрия должны добавляться в эквивалентных количествах. Эквивалентные соотношения устанавливают предварительным титрованием в присутствии фенолфталеина.
Содержимое колбы энергично встряхивают, затем доводят дистиллированной водой до метки, перемешивают и оставляют на 15 мин. Жидкость фильтрую через складчатый фильтр в сухую колбу.
4.1.1.2. Количественное определение редуцирующих сахаров
В коническую колбу вместимостью 250 см 3 вносят пипеткой 20 см 3 приготовленного для исследования сахарного раствора (в 20 см 3 раствора должно содержаться не более 100 и не менее 10 мг редуцирующих сахаров), приливают из мерного цилиндра по 20 см 3 раствора №1 и №2. Смесь осторожно перемешивают, нагревают и кипятят ровно 3 мин с момента образования пузырьков. Кипение должно быть слабым. При бурном кипении в результате испарения жидкости увеличивается концентрация раствора, что влияет на результаты определения. Колбу ставят в фарфоровую чашечку в наклонном положении и дают осадку меди осесть в течение 1. 2 мин. Жидкость над осадком должна быть синей.
Обесцвечивание жидкости указывает на избыточное количество сахара в растворе. Для уменьшения концентрации сахара раствор следует разбавить. Отсутствие осадка закиси меди свидетельствует о недостаточном количестве сахара в растворе. В этом случае для приготовления вытяжки следует увеличить массу навески.
Жидкость фильтруют через стеклянный фильтр, вставленный в колбу для фильтрования под вакуумом, избегая переноса осадка на фильтр. Колбу через предохранительную склянку соединяют с водоструйным насосом и проводят фильтрование с отсасыванием. Для предохранения закиси меди от окисления нужно следитьза тем, чтобы осадок на дне колбы был покрыт жидкостью, поэтому колбу держат в наклонном положении.
Осадок в колбе и на фильтре несколько раз промывают горячей прокипяченной дистиллированной водой (5—10 см 3 ) до исчезновения голубого оттенка в промывных водах (кипятят воду для удаления кислорода).
Закончив промывание, стеклянный фильтр помещают на чистую колбу для фильтрования под вакуумом. Осадок закиси меди растворяют, добавив в коническую колбу 20 см 3 железоаммонийных квасцов. Раствор сливают на стеклянный фильтр и оставляют на несколько минут для растворения осадка. Колбу при растворении осадка не присоединяют к водоструйному насосу; последующую фильтрацию производят с отсасыванием. Коническую колбу и фильтр несколько раз промывают водой, собирая промывные воды в колбу для фильтрования под вакуумом.
Сняв стеклянный фильтр, колбу отсоединяют от водоструйного насоса и титруют содержащийся в ней фильтрат 0,01 н раствором марганцово-кислого калия до появления слабо-розового окрашивания, не исчезающего в течение 1 мин.
Израсходованное на титрование количество миллилитров марганцово-кислого калия умножают на его титр по меди (Ткмnо4,/сu) (4.1)
По найденному количеству мг меди находят соответствующее ему количество сахарозы или инвертного сахара (табл 4.1)
Массовую долю сахаров(X1) в процентах рассчитывают по формуле
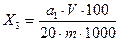
где a1 редуцирурующих сахаров (табл. 4.1), мг; V — объем мерной колбы, в которую перенесена навеска, см 3 ; 20—объем испытуемого раствора для определения сахаров, см 3 ; m — масса навески исследуемого продукта, г.
Определение общего сахара
Для гидролиза сахарозы 50см 3 полученного фильтрата (п.4.2.1.1) пипеткой переносят в мерную колбу на 100 см 3 , добавляют 5 см 3 20%-ный раствора соляной кислоты. Колбу погружают в водяную баню, нагретую до 70 о С и выдерживают 10 мин при этой температуре. Содержимое колбы быстро охлаждают под струей воды до комнатной температуры, нейтрализуют 10 %-ный раствором гидроокиси натрия по метиловому красному до появления желто-розовой окраски. Содержимое колбы доводят дистиллированной водой до метки. И определяют редуцирующие сахара (п.4.1.1.2) и таблице 4.1.
| Медь. | Инвертный сахар. мг | Саха роза | Медь. | Инвертный сахар | Саха- роза | Медь. | Инвертный сахар |
| 20,6 22,6 24,6 26,5 28,5 30,5 32,5 34,5 36,4 38,4 40,4 42,3 44,2 46,1 48,0 49,8 51,7 53,6 55,5 57,4 59,3 61,1 63,0 64,8 66,7 68,5 70,3 72,3 74,0 75,9 77,7 | 9,50 10,45 11,40 12,35 13,30 14,25 15,20 16,15 17,10 18,05 19,00 19,95 20,90 21,85 22,80 23,75 24,70 25,60 26,60 27,55 28,50 29,45 30,40 31,35 32,30 33,25 34,20 35,15 36,10 37,05 38,00 | 79,5 81,2 83,0 84,8 86,5 88,3 90,1 91,9 93,6 95,4 97,1 98,9 100,6 102,3 104,0 105,7 107,4 109,2 110,9 112,6 114,3 115,2 117,6 119,3 120,9 122,6 124,2 125,9 127,5 129,2 | 38,95 39,90 40,85 41,80 42,75 43,70 44,60 45,60 46,55 47,50 48,45 49,40 50,35 51,30 52,25 53,20 54,15 55,10 56,05 57,00 57,59 58,90 59,85 60,80 61,75 62,70 63,65 64,60 65,55 66,50 | 130,8 132,4 134,0 135,6 137,2 138,9 140,5 142,1 143,7 145,3 146,9 148,5 150,0 151,6 153,6 154,8 156,4 157,9 159,5 161,1 162,6 164,2 165,7 167,3 168,8 170,3 171,9 173,4 175,0 170,5 | 67,45 68,40 60,35 70,30 71,25 72,30 73,15 74,10 75,06 76,00 76,95 77,90 78,85 79,80 80,75 81,70 82,65 83,60 84,65 85,50 86,45 87,40 88,35 89,30 90,25 91,20 92,15 93,10 94,05 95,00 |
Массу общего сахара (Х2,) в процентах после гидролиза дисахаридов 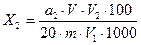
где а2 — количество общего сахара после гидролиза дисахаридов (сахарозы), выраженное в инвертномсахаре (табл.4.1); V — объем мерной колбы, в которую перенесена навеска, см 3 ; V1— объем водной вытяжки для гидролиза сахарозы (дисахаридов), см 3 ; V2—объем раствора после гидролиза дисахаридов (сахарозы), см 3 ; 20—объем испытуемого раствора для определения сахаров, см 3 ; m — масса навески исследуемого полуфабриката или изделия, г;
Массовую долю общего сахара (Хс) на сухое вещество, в процентах определяют по формуле:
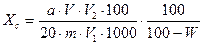
где W—массовая доля воды в продукте; %; 1000—пересчет мг в г.
За окончательный результат принимают среднее арифметическое значение результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,2 %.
Вычисление проводят до третьего десятичного знака.
Определение сахарозы
Массовую долю сахарозы S в процентах рассчитывают по разности между количеством общего сахаров после гидролиза дисахаридов (сахарозы) Х2 и редуцирующих сахаров до гидролиза дисахаридовХ1, 1 по формуле:
где Х1 – количество редуцирующих сахаров до гидролиза сахарозы или лактозы,%; Х2 – количество общего сахара после гидролиза дисахаридов, %; 0,95 – коэффициент пересчета инвертного сахара на сахарозу
Определение лактозы
Определение проводят по (п.1.1.1.1) и (1.1.1.2.).
Массовую долю лактозы (X3) в процентах при определении молока в крупяных изделиях, кофе, какао в сладких блюдах рассчитывают по формуле
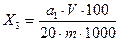
где a1 — количество лактозы (табл. 4.2) мг. Остальные обозначения, как в формуле (4.2)
Таблица 4.2.Количество меди, соответствующее лактозе, в мг
Источник