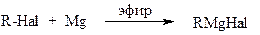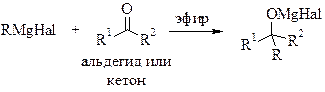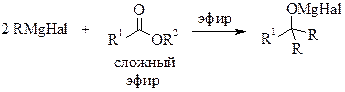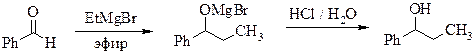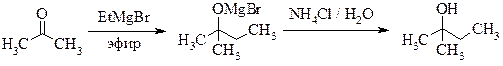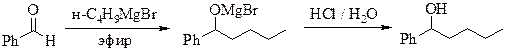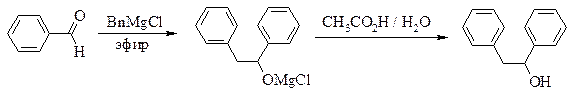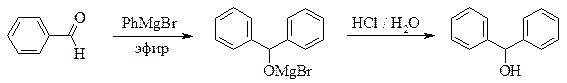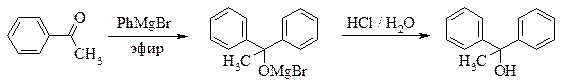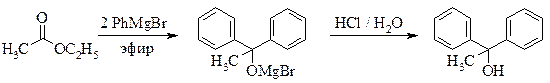- ПРИГОТОВЛЕНИЯ РЕАКТИВА ГРИНЬЯРА (общая методика)
- Реактив Гриньяра — Grignard reagent
- СОДЕРЖАНИЕ
- Синтез
- Из Mg металла
- Магний
- Механизм
- Реакция переноса Mg (обмен галоген – Mg)
- Из соединений алкилцинка (восстановительная трансметалляция )
- Тестирование реактивов Гриньяра
- Реакции реактивов Гриньяра.
- С карбонильными соединениями
- Реакции как основа
- Алкилирование металлов и металлоидов
- Равновесие Шленка
- Прекурсоры магнезиатов
- Связь с органическими галогенидами
- Окисление
- Устранение
- Промышленное использование
- Смотрите также
- Галерея
ПРИГОТОВЛЕНИЯ РЕАКТИВА ГРИНЬЯРА (общая методика)
В реакционную колбу объемом 250 мл помещают 2,4 г (0,1 моль) измельченных магниевых стружек, кристаллик йода и нагревают. После охлаждения колбы через капельную воронку приливают в нее около 15 мл смеси, полученной растворением 0,1 моль алкил- или арилгалогенида примерно в 40 мл абсолютного диэтилового эфира (в некоторых синтезах готовят более разбавленные растворы реактива Гриньяра); чтобы вызвать реакцию, колбу осторожно нагревают до кипения эфира. После начала реакции (при этом наблюдается помутнение реакционной смеси и самопроизвольное кипение эфира) нагрев убирают и при перемешивании прикапывают остаток смеси галогенида и эфира с такой скоростью, чтобы все время поддерживалось спокойное кипение эфира. При сильном кипении добавление галоидного алкила приостанавливают, а колбу охлаждают холодной водой. После добавления всего галогенида смесь нагревают до кипения еще 20-30 минут. Об окончании образования магнийорганического соединения свидетельствует почти полное растворение металлического магния. Небольшая его часть, а также металлические примеси, содержащиеся в магниевой стружке, оседают на дне колбы.
СИНТЕЗА СПИРТОВ ВЗАИМОДЕЙСТВИЕМ РЕАКТИВА ГРИНЬЯРА С КАРБОНИЛЬНЫМ СОЕДИНЕНИЕМ
(общая методика)
Полученный раствор магнийорганического соединения охлаждают и добавляют к нему по каплям при перемешивании и внешнем охлаждении водой со льдом 0,08 моль альдегида или кетона (или 0,04 моль сложного эфира) в примерно равном объеме абсолютного диэтилового эфира. Реакция экзотермична, и эфир может закипать. К концу прибавления образуется густой сероватый осадок. Для того чтобы довести реакцию до конца, после окончания прибавления карбонильного соединения реакционную смесь нагревают до кипения эфира в течение примерно 30 минут.
Методики разложения полученного таким образом алкоголята магния и выделение продукта реакции приводятся ниже для каждого конкретного продукта.
1-фенилпропанол-1
(этилфенилкарбинол)
Рекомендуемое количество этилмагнийбромида – 0,1 моль.
Реакционную смесь, полученную по общей методике прибавлением бензальдегида к раствору этилмагнийбромида[**************], разлагают, добавляя по каплям при охлаждении в бане с ледяной водой и перемешивании (вначале очень осторожно – эфир может закипать) 30 мл разбавленной (1:1) соляной кислоты. При этом осадок должен полностью раствориться. Эфирный слой отделяют, водный экстрагируют эфиром (2 × 5 мл). Объединенные эфирные фракции промывают последовательно растворами гидросульфита натрия (можно приготовить из имеющегося в лаборатории пиросульфита), гидрокарбоната натрия и водой, затем сушат безводным сульфатом натрия. Эфир отгоняют, остаток перегоняют в вакууме. Выход 8,4 г. Т. кип. 103 °С при 14 мм рт. ст.; nD 20 1,521.
2-МЕТИЛБУТАНОЛ-2
(трет-амиловый спирт)
Рекомендуемое количество этилмагнийбромида – 0,25 моль (объем реакционной колбы – 500 мл).
Реакционную смесь, полученную по общей методике прибавлением ацетона к раствору этилмагнийбромида[††††††††††††††], разлагают, добавляя по каплям при охлаждении и перемешивании раствор 26 г аммонийхлорида в 100 мл воды. При этом осадок должен полностью раствориться.
Водный слой отделяют и экстрагируют эфиром (2 × 20 мл). Эфирный раствор объединяют с эфирными вытяжками и сушат прокаленным поташом. Эфир отгоняют (до тех пор, пока температура отгоняющихся паров не достигнет 70 °С); остаток переносят в меньшую перегонную колбу с дефлегматором и фракционируют, собирая фракции:
1 фракция – 70-95 °С (отбрасывают),
2 фракция – 95-110 °С.
Для получения чистого продукта 2 фракцию повторно перегоняют. Выход 11 г. Т. кип. 102 °С.; nD 20 1,4052.
1-фенилпентанол-1
(бутилфенилкарбинол)
Рекомендуемое количество бутилмагнийбромида – 0,1 моль.
Реакционную смесь, полученную по общей методике прибавлением бензальдегида к раствору бутилмагнийбромида[‡‡‡‡‡‡‡‡‡‡‡‡‡‡], разлагают, добавляя по каплям при охлаждении в бане с ледяной водой и перемешивании (вначале очень осторожно – эфир может закипать) 30 мл разбавленной (1:1) соляной кислоты. При этом осадок должен полностью раствориться. Эфирный слой отделяют, водный экстрагируют эфиром (2 × 5 мл). Объединенные эфирные фракции промывают последовательно растворами гидросульфита натрия (можно приготовить из имеющегося в лаборатории пиросульфита), гидрокарбоната натрия и водой, затем сушат безводным сульфатом натрия. Эфир отгоняют, остаток перегоняют в вакууме. Выход 10 г. Т. кип. 137 ºС при 2 мм рт. ст.; d4 20 0,96; nD 20 1,5080.
1,2-дифенилэтанол
(бензилфенилкарбинол)
Осторожно! Бензилхлорид слезоточив и сильно раздражает кожу.
Рекомендуемое количество бензилмагнийхлорида – 0,1 моль (в 50-60 мл диэтилового эфира).
Реакционную смесь, полученную по общей методике прибавлением бензальдегида к раствору бензилмагнийхлорида, разлагают, добавляя по каплям при охлаждении в бане с ледяной водой и перемешивании (вначале очень осторожно – эфир может закипать) 33 мл воды, смешанной с 4 мл ледяной уксусной кислоты. При этом осадок должен полностью раствориться. Эфирный слой отделяют от водного и промывают последовательно 10 % раствором хлорида натрия, 10 % раствором соды, насыщенным раствором хлорида натрия, затем сушат прокаленным поташом или безводным сульфатом натрия.
Для дальнейшего ТСХ-анализа (который проводят после завершения синтеза) следует перед отгонкой растворителя отобрать около 1 мл реакционной смеси и оставить в закрытой баночке.
Эфир отгоняют из колбы Фаворского, а остаток перегоняют в вакууме с воздушным холодильником, собирая фракцию с т. кип. 169-170 °С (15 мм), которая тут же закристаллизовывается. Выход около 12 г. Т. пл. 66-67 °С.
ТСХ-Анализ очищенного и неочищенного (реакционная смесь) продукта реакции:
1)Контроль чистоты полученного продукта (опыт 1 из раздела 2 Приложения 1):
Элюент – смесь петролейного эфира и этилацетата (в объемном соотношении 5:1).
Проявитель – раствор фосфорномолибденовой кислоты
Rf (продукта) ≈ 0,4.
2)Обнаружение и идентификация побочных продуктов в реакционной смеси бензилфенилкарбинола(опыт 2 из раздела 2 Приложения 1):
Вещество-«свидетель» – 1,2-дифенилэтан
Элюент – петролейный эфир.
Проявитель – раствор фосфорномолибденовой кислоты
Rf (свидетеля) ≈ 0,5
б) Обнаружение бензилового спирта:
Вещество-«свидетель» – бензиловый спирт
Элюент – смесь петролейного эфира и этилацетата в объемном соотношении 5:1.
Проявитель – раствор фосфорномолибденовой кислоты
Rf (свидетеля) ≈ 0,3.
дифенилМЕТАНОЛ
(бензгидрол)
Рекомендуемое количество фенилмагнийбромида – 0,05 моль.
Реакционную смесь, полученную по общей методике прибавлением бензальдегида к раствору фенилмагнийбромида, охлаждают и разлагают образовавшийся алкоголят, добавляя по каплям (вначале очень осторожно) 24 мл 10 % соляной кислоты. По окончании разложения в колбе должны находиться два гомогенных слоя. Эфирный слой отделяют, а водный экстрагируют 8 мл эфира (не абсолютного!). Соединенные эфирные фракции длительно и энергично встряхивают в делительной воронке с 3 мл 40 % раствора гидросульфита натрия (можно приготовить из имеющегося в лаборатории пиросульфита) для удаления небольших количеств непрореагировавшего бензальдегида. Раствор гидросульфита сливают, а эфирный слой для удаления растворенного сернистого газа промывают небольшим количеством раствора карбоната натрия, затем сушат над хлоридом кальция.
Для дальнейшего ТСХ-анализа (который проводят после завершения синтеза) следует перед отгонкой растворителя отобрать около 1 мл реакционной смеси и оставить в закрытой баночке.
После отгонки эфира получают бензгидрол в виде маслообразного остатка, застывающего при охлаждении. Его перекристаллизовывают из лигроина или высококипящего петролейного эфира. Выход около 4 г. Полученный продукт плавится при 65-67 °С. Т. пл. чистого бензгидрола 68-69 °С.
Контроль чистоты полученного продукта методом ТСХ (опыт 1 из раздела 2 Приложения 1):
Элюент – смесь петролейного эфира и этилацетата в объемном соотношении 5:1.
Проявитель – раствор фосфорномолибденовой кислоты.
Rf (продукта) ≈ 0,6
1,1-дифенилэтанол-1
(метилдифенилкарбинол)
Метод 1 (из ацетофенона)
Рекомендуемое количество фенилмагнийбромида – 0,05 моль.
Реакционную смесь, полученную по общей методике прибавлением ацетофенона к раствору фенилмагнийбромида, охлаждают и разлагают полученный алкоголят, прикапывая при перемешивании рассчитанное количество 5 % соляной кислоты (внимание – в кислой среде третичные спирты легко дегидратируются). По окончании разложения в колбе должны находиться два гомогенных слоя. Эфирный слой отделяют, а водный экстрагируют (не абсолютным!) эфиром (2 × 5 мл). Объединенные эфирные фракции промывают раствором соды.
Для дальнейшего ТСХ-анализа (который проводят после завершения синтеза) следует перед отгонкой растворителя отобрать около 1 мл реакционной смеси и оставить в закрытой баночке.
Эфир отгоняют. Остаток обрабатывают водяным паром для удаления непрореагировавшего ацетофенона, бромбензола и дифенила (продукта побочной реакции). Очищенный таким образом метилдифенилкарбинол, застывший после охлаждения раствора, отфильтровывают с помощью водоструйного насоса, высушивают на воздухе и перекристаллизовывают из лигроина или из этилового спирта. Выход около 4,7 г.
Метод 2 (из этилацетата)
Рекомендуемое количество фенилмагнийбромида – 0,05 моль.
Реакционную смесь, полученную по общей методике прибавлением этилацетата[§§§§§§§§§§§§§§] к раствору фенилмагнийбромида, охлаждают и разлагают полученный алкоголят, прикапывая при перемешивании рассчитанное количество 5 % соляной кислоты. По окончании разложения в колбе должны находиться два гомогенных слоя. Эфирный слой отделяют, а водный экстрагируют (не абсолютным!) эфиром (2 × 5 мл). Объединенные эфирные фракции промывают раствором соды и сушат сульфатом натрия.
Для дальнейшего (после завершения синтеза) ТСХ-анализа следует перед отгонкой растворителя отобрать около 1 мл реакционной смеси и оставить в закрытой баночке.
Эфир отгоняют. Оставшийся в колбе метилдифенилкарбинол перекристаллизовывают из лигроина (или из этилового спирта). Выход – 2,4 г.
ТСХ-Анализ очищенного и неочищенного (реакционная смесь) продукта реакции:
1) Контроль чистоты полученного продукта (опыт 1 из раздела 2 Приложения 1):
Элюент – смесь толуола и диэтилового эфира в объемном соотношении 10:1.
Проявитель – раствор фосфорномолибденовой кислоты
Rf (продукта) ≈ 0,8
2) Обнаружение и идентификация побочного продукта (фенола) в реакционной смеси метилдифенилкарбинола(опыт 2 из раздела 2 Приложения 1):
Для лучшего разделения используйте более длинную, чем обычно, пластину ТСХ (3 × 10 см).
Вещество-«свидетель» – фенол
Элюент – смесь толуола и диэтилового эфира в объемном отношении 10:1.
Проявитель – раствор фосфорномолибденовой кислоты
Rf (свидетеля) ≈ 0,7
Источник
Реактив Гриньяра — Grignard reagent
Реактив Гриньяра или Гриньяра соединение представляет собой химическое соединение с общей формулой R-Mg-X , где Х представляет собой галоген и R представляет собой органическую группу , обычно представляет собой алкил или арил . Двумя типичными примерами являются метилмагнийхлорид Cl-Mg-CH.
3 и бромид фенилмагния (C
6 ЧАС
5 ) −Mg − Br . Они являются подклассом магнийорганических соединений .
Соединения Гриньяра — популярные реагенты в органическом синтезе для создания новых углерод-углеродных связей. Например, при взаимодействии с другим галогенированным соединением R’-X ‘ в присутствии подходящего катализатора они обычно дают R-R’ и галогенид магния MgXX ‘ в качестве побочного продукта; и последний нерастворим в обычно используемых растворителях. В этом аспекте они аналогичны литийорганическим реагентам .
Реактивы Гриньяра в чистом виде представляют собой чрезвычайно реакционноспособные твердые вещества. Обычно с ними обращаются в виде растворов в таких растворителях, как диэтиловый эфир или тетрагидрофуран ; которые относительно стабильны, если исключить воду. В такой среде реактив Гриньяра неизменно присутствует в виде комплекса с атомом магния, связанным с двумя атомами кислорода простого эфира координационными связями .
Открытие реакции Гриньяра в 1900 году было удостоено Нобелевской премии в 1912 году. Подробнее об истории см. Виктор Гриньяр .
СОДЕРЖАНИЕ
Синтез
Из Mg металла
Традиционно реактивы Гриньяра получают обработкой органического галогенида (обычно броморганического соединения) металлическим магнием. Простые эфиры необходимы для стабилизации магнийорганического соединения . Вода и воздух, которые быстро разрушают реагент в результате протонолиза или окисления, исключаются безвоздушными методами . Хотя реагенты все еще должны быть сухими, ультразвук может позволить реагентам Гриньяра образоваться во влажных растворителях, активируя магний, так что он потребляет воду.
Как обычно для реакций с участием твердых веществ и раствора, образование реактивов Гриньяра часто требует индукционного периода . На этом этапе удаляется пассивирующий оксид магния. После этого периода индукции реакции могут быть сильно экзотермическими . Эту экзотермичность необходимо учитывать при масштабировании реакции от лаборатории к производственной установке. Подойдет большинство галогенорганических соединений, но связи углерод-фтор обычно не вступают в реакцию , за исключением специально активированного магния (через металлы Рике ).
Магний
Обычно реакция образования реактивов Гриньяра включает использование магниевой ленты. Весь магний покрыт пассивирующим слоем оксида магния , который ингибирует реакции с органическим галогенидом. Было разработано множество методов ослабления этого пассивирующего слоя, тем самым подвергая высокореакционный магний воздействию органического галогенида. Механические методы включают измельчение кусков Mg на месте, быстрое перемешивание и обработку ультразвуком . Йод , метилиодид и 1,2-дибромэтан являются обычными активирующими агентами. Использование 1,2-дибромэтана выгодно, поскольку его действие можно контролировать по пузырькам этилена . Кроме того, безобидны побочные продукты:
Количество магния, потребляемого этими активирующими агентами, обычно незначительно. Небольшое количество хлорида ртути будет сливаться поверхность металла, увеличивая его реакционную способность . Добавление предварительно приготовленного реактива Гриньяра часто используется в качестве инициатора.
Специально активированный магний, такой как магний Рике , решает эту проблему. Оксидный слой также можно разрушить с помощью ультразвука, используя стержень для перемешивания, чтобы соскрести окисленный слой, или добавив несколько капель йода или 1,2-дииодэтана . Другой вариант — использовать сублимированный магний или антрацен магния .
Механизм
С точки зрения механизма реакция протекает через перенос одного электрона :
R − X + Mg → R − X • — + Mg • + R − X • — → R • + X — R • + Mg • + → RMg + RMg + + X — → RMgX
Реакция переноса Mg (обмен галоген – Mg)
Альтернативное приготовление реактивов Гриньяра включает перенос магния из предварительно приготовленного реактива Гриньяра в органический галогенид. Также используются другие магнийорганические реагенты. Этот метод предлагает то преимущество, что перенос Mg переносит многие функциональные группы. Иллюстративная реакция включает изопропилмагнийхлорид и арилбромид или йодиды:
i -PrMgCl + ArCl → i -PrCl + ArMgCl
Из соединений алкилцинка (восстановительная трансметалляция )
Другой метод синтеза реактивов Гриньяра включает реакцию Mg с цинкорганическим соединением . Этот метод использовался для получения реагентов Гриньяра на основе адамантана , которые из-за побочных реакций сочетания СС трудно получить обычным способом из алкилгалогенида и Mg. Восстановительная трансметалляция обеспечивает:
AdZnBr + Mg → AdMgBr + Zn
Тестирование реактивов Гриньяра
Поскольку реактивы Гриньяра очень чувствительны к влаге и кислороду, было разработано множество методов для проверки качества партии. Типичные тесты включают титрование взвешиваемыми безводными протонными реагентами, например ментолом в присутствии цветного индикатора. Взаимодействие реактива Гриньяра с фенантролином или 2,2′-бипиридином вызывает изменение цвета.
Реакции реактивов Гриньяра.
С карбонильными соединениями
Реагенты Гриньяра реагируют с различными карбонильными производными.
Наиболее распространенное применение реагентов Гриньяра является алкилированием альдегидов и кетонов, то есть в реакции Гриньяра :
Обратите внимание, что ацетальная функция (защищенный карбонил) не вступает в реакцию.
Такие реакции обычно включают водную кислотную обработку, хотя эта стадия редко показана на схемах реакции. В случаях, когда реактив Гриньяра добавляется к альдегиду или прохиральному кетону, модель Фелкина-Аня или правило Крама обычно могут предсказать, какой стереоизомер будет образован. С легко депротонируемыми 1,3- дикетонами и родственными кислотными субстратами реактив Гриньяра RMgX действует просто как основание, давая енолят- анион и высвобождая алкан RH.
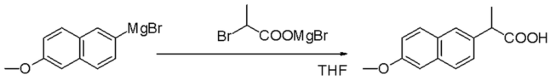
Реагенты Гриньяра представляют собой нуклеофилы в нуклеофильных алифатических замещениях, например, алкилгалогенидами, на ключевой стадии промышленного производства напроксена :
Реакции как основа
Реагенты Гриньяра служат основой для протонных субстратов (на этой схеме не показаны условия обработки, которые обычно включают воду). Реагенты Гриньяра являются основными и реагируют со спиртами, фенолами и т. Д. С образованием алкоксидов (ROMgBr). Производное феноксида подвержено формилированию параформальдегидом с образованием салицилальдегида .
Алкилирование металлов и металлоидов
Как и литийорганические соединения , реактивы Гриньяра полезны для образования связей углерод-гетероатом.
[<\ce 
Реагенты Гриньяра реагируют со многими электрофилами на основе металлов. Например, они подвергаются трансметаллированию с хлоридом кадмия (CDCl 2 ) с получением dialkylcadmium :
2 RMgX + CdCl 2 → R 2 Cd + 2 Mg (X) Cl
Равновесие Шленка
Большинство реакций Гриньяра проводят в эфирных растворителях, особенно в диэтиловом эфире и ТГФ . С хелатирующим диэфирным диоксаном некоторые реактивы Гриньяра подвергаются реакции перераспределения с образованием соединений диорганомагния (R = органическая группа, X = галогенид):
2 RMgX + диоксан ⇌ R 2 Mg + MgX 2 (диоксан)
Эта реакция известна как равновесие Шленка .
Прекурсоры магнезиатов
Реагенты Гриньяра реагируют с литийорганическими соединениями с образованием комплексов (Bu = бутил):
BuMgBr + 3 BuLi → LiMgBu 3 + BuBr
Связь с органическими галогенидами
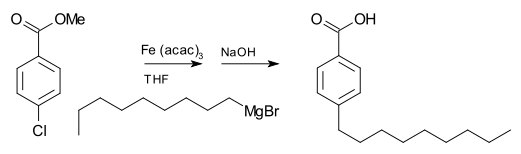
Реагенты Гриньяра обычно не реагируют с органическими галогенидами, в отличие от их высокой реакционной способности с галогенидами других основных групп. Однако в присутствии металлических катализаторов реактивы Гриньяра участвуют в реакциях сочетания CC . Например, nonylmagnesium вступает в реакцию с бромистого метила р -chlorobenzoate , чтобы дать р -nonylbenzoic кислоту, в присутствии трис (ацетилацетонат) железа (III) (Fe (асас) 3 ), после обработки с помощью NaOH , чтобы гидролизовать в эфир , представлены следующим образом . Без Fe (acac) 3 реактив Гриньяра будет атаковать сложноэфирную группу над арилгалогенидом .
Для сочетания арилгалогенидов с арильными реактивами Гриньяра хлорид никеля в тетрагидрофуране (ТГФ) также является хорошим катализатором. Кроме того, эффективным катализатором взаимодействия алкилгалогенидов является тетрахлоркупрат дилития (Li 2 CuCl 4 ), полученный смешиванием хлорида лития (LiCl) и хлорида меди (II) (CuCl 2 ) в ТГФ. Соединение Кумада-Корриу дает доступ к [замещенным] стиролам .
Окисление
Обработка реактива Гриньяра кислородом дает органопероксид магния. Гидролиз этого материала дает гидропероксиды или спирт. В этих реакциях участвуют радикальные промежуточные соединения.
>>\ <\color 
Простое окисление реактивов Гриньяра до спиртов не имеет большого практического значения, поскольку выходы обычно низкие. Напротив, двухэтапная последовательность через боран ( см. Выше ), который затем окисляется до спирта перекисью водорода, имеет синтетическое применение.
Синтетическая полезность окислений Гриньяра может быть увеличена реакцией реактивов Гриньяра с кислородом в присутствии алкена до этиленового удлиненного спирта . Для этой модификации требуется арил или винил Гриньяр. Добавление только Гриньяра и алкена не приводит к реакции, демонстрирующей, что присутствие кислорода необходимо. Единственным недостатком является требование наличия по крайней мере двух эквивалентов Гриньяра, хотя этого можно частично избежать, используя двойную систему Гриньяра с дешевым восстанавливающим средством Гриньяра, таким как бромид н-бутилмагния.
Устранение
В синтезе олефинов Боорда добавление магния к определенным β-галогенэфирам приводит к реакции отщепления до алкена. Эта реакция может ограничить полезность реакций Гриньяра.
Промышленное использование
Пример реакции Гриньяра является ключевым этапом (нестереоселективного) промышленного производства тамоксифена (в настоящее время используется для лечения рака молочной железы, положительного по рецепторам эстрогена у женщин):
Смотрите также
Галерея
Магниевые стружки помещают в колбу.
Добавляют тетрагидрофуран и небольшой кусочек йода.
При нагревании добавляют раствор бромистого алкила.
После завершения добавления смесь некоторое время нагревают.
Формирование реактива Гриньяра завершено. В колбе еще остается небольшое количество магния.
Полученный таким образом реактив Гриньяра охлаждают до 0 ° C перед добавлением карбонильного соединения. Раствор становится мутным по мере осаждения реактива Гриньяра.
К реактиву Гриньяра добавляют раствор карбонильного соединения.
Раствор подогревают до комнатной температуры. На этом реакция завершена.
Источник