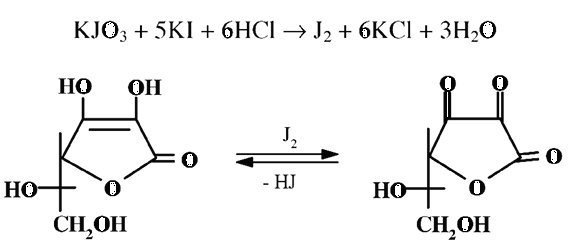Методика определения аскорбиновой кислоты в овощах (сырых и вареных) — методом титрования реактивом ТИЛЬМАНСА
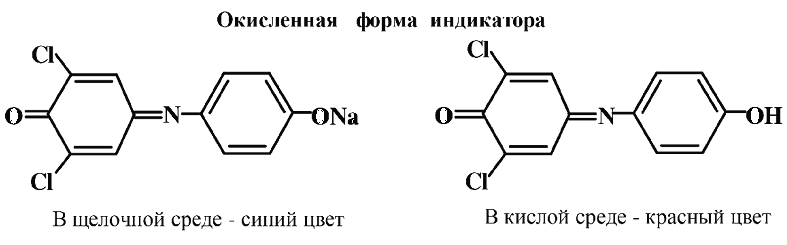
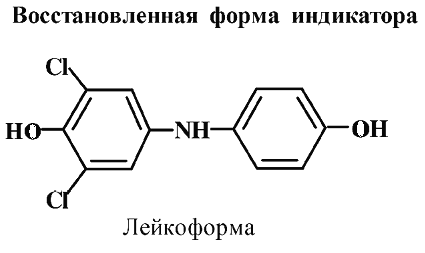
Принцип метода основан на окислительно-восстановительной реакции между аскорбиновой кислотой и реактивом Тильманса (индикатор — 2,6-дихлорфенолиндофенол). Аскорбиновая кислота, отдавая 2 атома водорода, окисляется в дегидроаскорбиновую кислоту, восстанавливая реактив Тильманса. Реактив Тильманса в щелочной и нейтральной среде имеет интенсивно-синюю окраску. В кислой среде реактив красного цвета. При восстановлении аскорбиновой кислотой индикатор переходит в бесцветное состояние — лейкоформу. Определение витамина С производится путем титрования испытуемого раствора реактивом Тильманса в кислой среде до появления слабо-розового окрашивания, указывающего, что вся аскорбиновая кислота вступила в реакцию.
Определение витамина С в сырых и вареных овощах и в овощных вторых блюдах:10 г овощей или овощного второго блюда перенести в фарфоровую ступку и тщательно растереть с чистым кварцевым песком, взятым на кончике ножа, постепенно добавляя 2% раствор хлористоводородной кислоты до 50 мл. Оставить смесь в ступке на 10 мин для более полного извлечения аскорбиновой кислоты. Затем содержимое перелить в цилиндр и довести водой до 100 мл, перемешать, профильтровать через марлю (или вату) в другую емкость. 5 мл полученного фильтрата перенести в колбочку, довести водой до 15 мл и титровать реактивом Тильманса из микробюретки (или пипетки на 2 мл) до слабо розового окрашивания, не исчезающего в течение 1 мин. Если раствор имеет интенсивную окраску, то пробу для титрования разводят водой в 5 раз.
Расчет количества содержащейся аскорбиновой кислоты производят по формуле:
где: X — искомое содержание аскорбиновой кислоты, мг на 100 г продукта;
n — количество реактива Тильманса, пошедшего на титрование, мл;
F — поправка на титр раствора реактива Тильманса (0,95);
N — количество экстрагирующей жидкости (100);
100 — коэффициент для пересчета на 100 г продукта;
0,088 — постоянный коэффициент (1 мл раствора реактива Тильманса соответствует 0,088 мг аскорбиновой кислоты);
а — объем пробы, взятой на титрование (5 мл);
р — навеска продукта (10 г). Расчет содержания витамина С во вторых блюдах производится в миллиграммах на общую массу блюда (например, 180-200 г).
В норме содержание витамина С в сыром картофеле составляет:20 мг% (мг/100 продукта) — в свежесобранном; 15 мг% — через 4-5 месяцев хранения; 10 мг% — после 6 месяцев хранения.
Источник
Пищевая химия: учебник для студентов вузов
Лабораторная работа 35. Титриметрические методы определения витамина С
Сущность титриметрического метода заключается в том, что 2, 6-дихлорфенолиндофенол выступает не только как окислитель, но и как индикатор, по которому определяют окончание титрования. Окраска раствора 2, 6-дихлорфенолиндофенола зависит от рН среды, а при восстановлении он переходит в лейкоформу.
Количественное определение ведут путем добавления к подкисленному раствору, содержащему витамин С, щелочного раствора краски Тильманса. Пока в титруемом растворе содержится витамин С, добавляемый раствор 2, 6-дихлорфенолиндофенола, имеющий глубокий синий цвет, обесцвечивается с образованием лейкоформы (индикатор), за счет присутствия восстановленной формы АК. Как только все количество АК в анализируемом растворе окислится до ДАК, раствор приобретает красную окраску, характерную для окисленной формы 2, 6-дихлорфенолиндофенола в кислой среде. Метод стандартизирован (ГОСТ 30627.2–98 – Методы измерений массовой доли витамина С (аскорбиновой кислоты).
Ход анализа . Точную навеску (около 5–10 г) предварительно измельченного исследуемого материала поместить в фарфоровую ступку. Небольшими порциями добавить 20 мл 1%-го раствора соляной кислоты, тщательно растирая пробу до получения однородной кашицы. Смесь количественно перенести в мерную колбу вместимостью 100 мл (общий объем соляной кислоты не должен превышать 50 мл). Ступку и пестик ополоснуть 1%-м раствором щавелевой кислоты и собрать смывы в ту же мерную колбу. Объем раствора довести до метки раствором щавелевой кислоты.
Содержимое колбы перемешать и через 5 минут отфильтровать через складчатый фильтр в сухую колбу или центрифугировать. Полученный фильтрат или фугат в количестве 1–10 мл (в зависимости от содержания витамина) отобрать пипеткой в коническую колбу и довести объем раствора дистиллированной водой до 15 мл. Анализируемый раствор оттитровать из микробюретки 0,001 н раствором 2, 6-дихлор-фенолиндофенола до появления розового окрашивания, не исчезающего в течение 30–60 с.
Контрольный опыт . Для оценки поправки на присутствие других редуцирующих веществ в используемых реагентах к 10 мл фильтрата или фугата прилить 0,1 мл 10%-го раствора сернокислой меди и выдержать при температуре 110 0 С в течение 10 минут для разложения АК. После охлаждения добавить 5 мл дистиллированной воды и оттитровать анализируемый раствор из микробюретки 0,001 н раствором 2, 6-дихлорфенолиндофенола. Для титруемого объема в 15 мл объем титранта, пошедшего на контрольный опыт, обычно составляет 0,04–0,06 мл. Эту поправку необходимо вычесть из объема титранта, пошедшего на титрование опытного образца. Рассчитать массовую долю аскорбиновой кислоты ( С АК , мг %) в анализируемом материале по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, 0,088 мг/мл;
V 1 – объем 0,001 н раствора 2, 6-дихлорфенолиндофенола, пошедшего на титрование экстракта с учетом поправки на реагенты, мл;
V 2 – общий объем экстракта, 100 мл;
V 3 – объем экстракта, взятого на титрование, 15 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета на 100 г.
Определение витамина С в окрашенных растворах
Многие растительные материалы дают окрашенные экстракты, что затрудняет определение АК путем прямого титрования краской Тильманса. В этом случае титрование ведут в присутствии растворителей, которые сами нерастворимы в воде, но растворяют краску и не растворяют пигменты экстракта, таких как хлороформ или смесь толуола и изобутилового спирта (1:1).
Ход анализа . Точную навеску (около 5–10 г) растительного материала растереть в фарфоровой ступке в 20 мл 1%-ной соляной кислоты. Полученный гомогенат количественно перенести в мерную колбу вместимостью 100 мл и довести объем до метки 1%-ным раствором щавелевой кислоты. Соотношение соляной и щавелевой кислот должно составить 1:5. Содержимое колбы перемешать и через 5 минут отфильтровать через складчатый фильтр в сухую колбу.
В пробирку вместимостью 20 мл отмерить пипеткой 5 мл отфильтрованного окрашенного экстракта, добавить мерным цилиндром 5 мл хлороформа и оттитровать 0,001 н раствором 2, 6-дихлор-фенолиндофенола при осторожном перемешивании, наклоняя пробирку. Титрование прекратить при появлении красного окрашивания в слое хлороформа.
Для оценки поправки на реагенты приготовить контрольный раствор. В качестве контрольного раствора использовать 5 мл смеси из 1%-ных растворов соляной и щавелевой кислот (в соотношении объемов 1:5) и 5 мл хлороформа. Объем титранта, пошедший на контрольный опыт, необходимо вычесть из объема титранта, пошедшего на титрование опытного образца. Рассчитать массовую долю аскорбиновой кислоты ( С АК , мг %) по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, 0, 088 мг/мл;
V 1 – объем 0,001 н раствора 2, 6-дихлорфенолиндофенола, пошедшего на титрование экстракта с учетом поправки на контрольный опыт, мл;
V 2 – общий объем экстракта, 100 мл;
V 3 – объем экстракта, взятого на титрование, 5 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета на 100 г.
Определение содержания витамина С в молочных продуктах
Содержание витамина С в сыром молоке зависит от времени года, индивидуальных особенностей животного и колеблется в интервале 0,3–2 мг%. В свежем молоке 67–68% приходится на восстановленную форму витамина С (АК) и 22–33% на окисленную (ДАК). Окисление витамина С в молоке катализирует аскорбатоксидаза и ускоряется в присутствии металлов (железа, меди), света, воздуха. Прямому определению АК в молоке препятствуют белки, способные связывать 2, 6-дихлорфенолиндофенол. В связи с этим определение АК ведут в безбелковом фильтрате. Белки осаждают с помощью насыщенного раствора хлорида натрия или раствора кислоты (метафосфорной, щавелевой, соляной).
Ход анализа . Навеску анализируемого молочного продукта (10 г) растворить 15–25 мл 6%-го раствора метафосфорной кислоты, количественно перенести в мерную колбу вместимостью 50 мл и довести объем смеси до метки тем же раствором кислоты (вместо метафосфорной кислоты можно использовать 2%-ный раствор соляной кислоты). Полученную смесь перемешать и отфильтровать. В коническую колбу для титрования отобрать пипеткой 1 мл фильтрата, довести объем до 15 мл дистиллированной водой и оттитровать из микробюретки 0,001 н раствором 2,6-дихлорфенолиндофенола до появления слаборозового окрашивания, не исчезающего в течение 30–60 с.
Рассчитать массовую долю аскорбиновой кислоты ( С АК , мг %) в анализируемом молоке по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, 0,088 мг/мл;
V 1 – объем 0,001 н раствора 2, 6-дихлорфенолиндофенола, пошедшего на титрование анализируемого образца с учетом поправки на реагенты, мл;
V 2 – общий объем раствора, 50 мл;
V 3 – объем раствора, взятого на титрование, 1 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета в проценты.
Упрощенный йодатный метод определения витамина С в молоке
В основе йодатного метода лежит реакция окисления АК йодноватокислым калием до ДАК.
Определение витамина С упрощенным йодатным методом не применяют для анализа жидких концентратов из плодов шиповника, консервированных продуктов, свежеотжатых соков, свежих плодов, овощей, сушенных продуктов, витаминизированных чаев.
Ход анализа . Экстракцию витамина С провести с использованием 2%-го раствора соляной кислоты по методике, указанной выше. На анализ отобрать 1–5 мл экстракта (в зависимости от содержания витамина С) в коническую колбу вместимостью 100 мл, куда заранее добавить 0,5 мл 1%-го раствора йодистого калия, 1 мл 1%-го раствора крахмала и воды (3,5–7,5мл) с таким расчетом, чтобы общий объем смеси составил 10 мл. Полученный раствор оттитровать из микробюретки 0,001 н раствором йодноватокислого калия до появления устойчивого слабо синего окрашивания. Рассчитать содержание аскорбиновой кислоты ( С АК , мг %) в анализируемом молоке по формуле
C A K = T × V 1 × V 2 m × V 3 × 100 ,
где Т – титр 0,001 н раствора йодноватокислого калия по аскорбиновой кислоте, 0,088 мг/мл;
V 1 – объем 0,001 н раствора йодноватокислого калия, пошедшего на титрование анализируемого образца с учетом поправки на контрольный раствор, мл;
V 2 – общий объем экстракта, 1–5 мл;
V 3 – объем раствора, взятого на титрование, 10 мл;
m – масса навески исследуемого материала, г;
100 – коэффициент пересчета в проценты
Контрольный опыт . В коническую колбу отмерить 0,5 мл 1%-го раствора йодистого калия, 1 мл 1%-го раствора крахмала, 1 мл 2%-го раствора соляной кислоты и воды с таким расчетом, чтобы общий объем жидкости составил 10 мл, и оттитровать из микробюретки 0,001 н раствором йодноватокислого калия до появления устойчивого слабо синего окрашивания.
Необходимые реактивы, посуда, оборудование :
§ 1-, 2%-ные растворы соляной кислоты, 1%-ный раствор щавелевой кислоты, 6%-ный раствор метафосфорная кислота (Н n P n O 3n ), 10%-ный раствор сульфата меди, 2%-ный раствор серной кислоты, аскорбиновая кислота кристаллическая, 1%-ный раствор крахмала, 0,001 н раствор 2,6-дихлор-фенолиндофенола, аскорбиновая кислота кристаллическая, хлороформ, 1%-ный раствор йодистого калия, 0,001 н раствор йодноватокислого калия ( KJO 3 ), кристаллический йодид калия;
§ колбы для титрования, пипетки, микробюретки, фарфоровые ступки с пестиком, мерные колбы вместимостью 50 мл, 100 мл, делительные воронки, воронки для фильтрования, мерные цилиндры, пробирки;
§ аналитические весы, центрифуга, термостат на 110 0 С.
1%-ный раствор соляной кислоты . В мерную колбу вместимостью 1000 мл отмерить 23 мл соляной кислоты плотностью 1,185 г/мл, развести 300 мл дистиллированной воды и довести объем раствора до метки.
0,001 н раствор йодноватокислого калия ( KJO 3 ) . Навеску йодата калия 0,03568 г растворить в небольшом количестве дистиллированной воды в мерной колбе вместимость 1 л и довести объем раствора до метки.
0,001 н раствор 2,6-дихлорфенолиндофенола ( краска Тильманса ) . Навеску краски около 0,2 г растворить в 300 мл свежепрокипяченной теплой дистиллированной воды, добавить 20–30 капель 0,01 н раствора гидроксида калия или натрия и количественно перенеси в колбу вместимостью 1000 мл. Объем раствора довести до метки и отфильтровать. Титр раствора определить по йодноватокислому калию.
Определение титра раствора 2,6-дихлорфенолиндофенола по йодноватокислому калию. В мерной колбе вместимостью 50 мл растворить 1 мг кристаллической аскорбиновой кислоты в 30 мл раствора 2%-ной серной кислоты и довести объем до метки тем же раствором кислоты. В две конические колбы для титрования отобрать по 5 мл приготовленного раствора аскорбиновой кислоты. Раствор в одной колбе оттитровать 0,001 н раствором 2,6-дихлорфенолиндофенолом до появления розового окрашивания, не исчезающего в течение 30 с. Во вторую колбу добавить несколько кристалликов йодида калия (около 1–2 мг), 5 капель 1%-го раствора крахмала и оттитровать 0,001 н раствором йодноватокислого калия до появления едва заметного синего окрашивания.
Исходя из того, что 1 мл 0,001 н раствора йодноватокислого калия, а следовательно, и 2,6-дихлорфенолиндофенола, эквивалентен 0,088 мг аскорбиновой кислоты, рассчитать титр раствора 2,6–дихлор-фенолиндофенола ( Т, мг/мл) по аскорбиновой кислоте по формуле
T = 0 , 088 × V 1 V 2 ,
где 0,088 – количество аскорбиновой кислоты, соответствующее 1 мл 0,001 н раствора йодноватокислого калия, мг/мл;
V 1 – объем 0,001 н раствора йодата калия, израсходованного на титрование раствора аскорбиновой кислоты, мл;
V 2 – объем раствора 2,6-дихлорфенолиндофенола, израсходованное на титрование, мл.
Источник
Опыт 11. Реакция с реактивом Тильманса
В пробирку внести 1-2 мл раствора HCl (1:1), добавить 2-3 капли раствора витамина С, перемешать. Затем по каплям добавлять раствор краски Тильманса. Происходит окрашивание раствора в розовый цвет с последующим обесцвечиванием окраски, благодаря окислительным свойствам витамина С. В эквивалентной точке раствор приобретает розовый цвет.
Опыт 12. Взаимодействие с метиленовой синью
В пробирку внести 1-2 мл витамина С, прилить 1-2 капли раствора метиленовой сини, перемешать и поместить пробирку в стакан с водой (40°С). Через некоторое время жидкость в пробирке обесцвечивается за счет восстановления метиленовой сини в бесцветную лейкоформу, а аскорбиновая кислота окисляется до дегидроаскорбиновой кислоты. Если бесцветный раствор энергично встряхнуть для контакта с кислородом, то он вновь приобретет синий цвет.
Опыт 13. Реакция с красной кровяной солью
В пробирку внести 1-2 мл витамина С, прилить 2 мл раствора КОН, 0,5 мл раствора красной кровяной соли и энергично встряхивают. Затем добавить в пробирку 0,5 мл 10% раствора соляной кислоты и 1-2 капли раствора хлорида железа (III). Выпадает синий осадок берлинской лазури.
Провести визуальные наблюдения, сделать вывод.
Написать уравнение реакции окисления витамина С. Указать содержание витамина в сыворотке крови с.-х. животных и его биохимическую роль.
Лабораторная работа № 9
Количественное определение витаминов
Реактивы и оборудование:Сыворотка крови, этиловый спирт, петролейный эфир (или авиационный бензин) K2Cr2O7 (720 мг/л,. что соответствует по окраске 1мг% каротина), солянокислый буфер (рН= 5,2), реактив Тильманса, фильтры, пробирки, пипетки
Опыт 1. Количественное определение каротина в сыворотке крови
Приготовление исследуемого раствора.
В пробирку внести 1мл сыворотки крови, добавить 3мл 96% этилового спирта для осаждения белков. Содержимое пробирки перемешать. Затем прилить 6мл петролейного эфира для экстракции каротина. Энергично встряхивать 2 минуты. После этого добавить 2мл Н2Одист.для лучшего расслоения жидкостей.
Верхний эфирный слой перенести в кювету ФЭКа и колориметрировать с синим светофильтром (λ =440нм) в кювете толщиною слоя 1см против дист. воды.
Приготовление рабочего калибровочного раствора.
В пробирку внести 2,4мл основного калибровочного раствора K2Cr2O7и добавить 2,6мл Н2Одист..Содержимое пробирки перемешать и колориметрировать в том же режиме.
Расчет произвести по формуле:
где, Х — содержание каротина в сыворотке, мг%; Еоп -экстинция образца сыворотки крови; Ека-экстинция калибровочного раствора, 1 — коэффициент перевода в мг%.
Полученные результаты сравнить с нормативными показателями и сделать соответствующий вывод.
Опыт 2. Спектрофотометрическое определение витамина С в напитках
Для исследования берут неокрашенные или слабоокрашенные напитки. После дегазации и, если необходимо, фильтрования исследуемых напитков готовят три раствора, согласно таблицы:
| Реагент | Опытная проба | Калибровочная проба | Контрольнаяя проба |
| Солянокислый буфер (рН 5,2), мл | 4,5 | 4,5 | 5,0 |
| Напиток, мл | 0,5 | — | — |
| Раствор витамина С, мл | — | 0,5 | — |
| Реактив Тильманса, мл | 1,0 | 1,0 | 1,0 |
Содержимое каждой пробирки перемешать и колориметрировать опытную и калибровочную против контрольной в кювете толщиною слоя 1см при длине волны 540нм.
Расчет произвести по формуле:
где, Х — содержание витамина С, мг/л; Еоп -экстинция опытной пробы; Ека-экстинция калибровочного раствора, Vпр – объем исследуемого напитка, 1000 — коэффициент перевода в мг/л, 0,05 – количество витамина С в 0,5 мл стандартного (калибровочного) раствора, мг.
Примечание: Опыт № 2 не делали.
Лабораторная работа № 10
Качественные пробы на присутствие ферментов
Реактивы и оборудование:3% раствор пероксида водорода, кристаллический гидрохинон, насыщенный раствор тирозина, 5% раствор мочевины, 1% раствор сахарозы, фенолфталеин, красная лакмусовая бумага, сырой картофель, морковь, капуста, мясо, соевая мука, дрожжи, реактив Фелинга, центрифуга, ступки, песок, марля, воронки, пипетки, водяная баня, лучинки, плитка,
Опыт 1.Обнаружение каталазы в мышечной кашице.
Перекись водорода может образовываться в организмах как конечный продукт дыхания, но поскольку в больших концентрациях перекись водорода является ядом для живых клеток, существуют ферменты, способные ее обезвреживать. К таким ферментам относится каталаза. Она расщепляет пероксид до воды и кислорода. Каталаза вызывает бурное выделение пузырьков кислорода при промывании ран пероксидом водорода. Содержится каталаза и в растительных объектах, например, в картофеле, моркови.
В пробирку помещают 0,5 – 1 г мышечной кашицы, добавляют 2 мл дистиллированной воды и 1 мл 3% раствора пероксида водорода. Встряхивают пробирку и наблюдают выделение пузырьков газа. Используя тлеющую лучинку, можно доказать, что выделяющийся газ – кислород.
Опыт 2. Обнаружение пероксидазы в растительных тканях
Некоторые ферменты выделяющийся в ходе разложения пероксида водорода кислород используют для окисления органических соединений. К таким ферментам относят пероксидазу. С помощью пероксидазы, содержащейся в больших количествах в растительных клетках, происходит окисление дифенолов в хиноны, в результате чего темнеет лежащий на воздухе очищенный картофель и другие растительные продукты.
В две пробирки наливают по 3 мл 3% раствора пероксида водорода. В одну из них помещают 2-3 кусочка свеженарезанного картофеля. В обе пробирки добавляют одинаковое количество кристаллического гидрохинона. Содержимое пробирок встряхивают. Через некоторое время наблюдают образование розово-красной окраски в пробирке с картофелем вследствие окисления гидрохинона в хинон перекисью водорода под действиемпероксидазы. Много пероксидазы содержится в хрене, поэтому вместо картофеля можно использовать это растение.
Последнее изменение этой страницы: 2018-05-29; просмотров: 226.
Источник