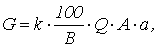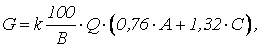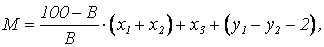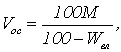- Нейтрализация путем добавления реагентов
- Как нейтрализовать серную кислоту
- Как приготовить щелочной раствор для нейтрализации кислоты
- Чем нейтрализуется щелочь
- Химические и физические свойства щелочей и их растворов
- Щелочные сливы предприятий
- Методы и способы нейтрализации щелочи
- Чем опасны кислоты и щелочи
- Приготовление нейтрализующего раствора
- Что делать при химических ожогах
- Что делать при разливах
- Что делать при пожарах
Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
| Щелочь, кг | Серная кислота | Соляная кислота | Азотная кислота | Уксусная кислота |
| Известь: |
гашеная
0,76/1,32
1,01/0,99
0,59/1,7
0,62/1,62
каустическая
0,82/1,22
1,1/0,91
0,64/1,57
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
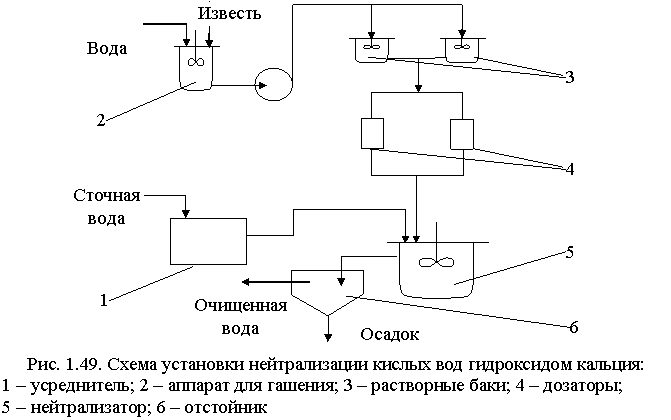
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.
Источник
Как нейтрализовать серную кислоту
- Как нейтрализовать серную кислоту
- Раствор серной кислоты и его свойства
- Что такое серная кислота как окислитель
Также серная кислота способна взаимодействовать с гидроксидом натрия. Концентрированная серная кислота разбавляется одной порцией NaOH:
Для разбавленной серной кислоты требуется та же щелочь в двойном размере:
В обоих случаях при нейтрализации образуются оксосоли. Na2SO4 — вещество белого цвета, поэтому при нейтрализации серной кислоты возможно выпадение белого осадка.
Кроме того, также серная кислота способна взаимодействовать с гидроксидом натрия. Концентрированная серная кислота разбавляется одной порцией NaOH:
Для разбавленной серной кислоты требуется та же щелочь в двойном размере:
В обоих случаях при нейтрализации образуются оксосоли. Na2SO4 — вещество белого цвета, поэтому при нейтрализации серной кислоты возможно выпадение белого осадка.
Помимо этого, серная кислота при определенных условиях нейтрализуется оксидами некоторых металлов. Так, например, разбавленная серная кислота, соединяясь с оксидом бария, образует соль — сульфат бария и воду:
Некоторые металлы, например цинк, хорошо реагируют с разбавленной кислотой, в результате чего образуется соль, а водород выделяется наружу:
Источник
Как приготовить щелочной раствор для нейтрализации кислоты
Соляная кислота — это общее название для соляной кислоты, очень агрессивного химического вещества. Это соединение имеет многочисленные промышленные и бытовые применения, начиная от обработки продуктов питания, металлов и полимеров и заканчивая обеззараживанием воды в бассейне. Даже в разбавленной форме соляная кислота может раздражать глаза и кожу и вызывать проблемы с дыханием. В концентрированных количествах это может вызвать серьезные химические ожоги и даже смерть. Вы должны нейтрализовать любой разлив, смешивая его с мягкой основой, прежде чем очистить разлив.
Химические реакции
Нейтрализация кислоты происходит, когда она объединяется с основанием для производства соли и воды. Соляная кислота состоит из положительно заряженных ионов водорода и отрицательно заряженных ионов хлора. Основная жидкость, такая как едкий натр (гидроксид натрия), состоит из положительно заряженных ионов натрия и отрицательно заряженных гидроксильных ионов. Во время реакции ионы водорода и гидроксила объединяются, образуя воду, в то время как ионы хлора и натрия объединяются, образуя хлорид натрия, известный как поваренная соль. Более слабые основные вещества, такие как пищевая сода (бикарбонат натрия), кальцинированная сода (карбонат натрия) и известь (карбонат кальция) распадаются на положительные ионы натрия или кальция и отрицательные ионы карбоната в кислоте. Водород и карбонат-ионы объединяются, чтобы произвести газ углекислого газа в эффекте шипения вместе с водой. Ионы металла и хлорида объединяются, чтобы произвести соль хлорида натрия или кальция.
Тепло от химической реакции
Кислотная нейтрализация является сильно экзотермической реакцией, что означает, что она производит большое количество тепла, которое может испарять любую произведенную воду. Любой углекислый газ, который образуется в результате небольшой реакции нейтрализации, может раздражать ваши глаза и горло, хотя он не будет в достаточно больших объемах, чтобы быть смертельным. Чтобы свести к минимуму тепло и углекислый газ, медленно и постепенно добавляйте базовый материал в соляную кислоту.
Защитная одежда
Для защиты глаз и кожи следует использовать совместимые с кислотой перчатки — например, из неопрена или нитрила — так как латексные перчатки растворяются в кислоте. Любой источник пламени или воспламенения должен быть выключен.
Небольшие разливы
Пищевая сода, кальцинированная сода и известь являются наиболее безопасными и экономичными методами нейтрализации небольших или бытовых разливов соляной кислоты. Медленно разбрызгивайте нейтрализатор по краям разлива, а затем по направлению к центру, чтобы свести к минимуму пенообразование углекислого газа. После того, как вы нейтрализовали разлив, покройте его сухим песком, почвой или другим инертным материалом — таким как вермикулит — и поместите его в специальный контейнер для химических отходов и утилизируйте.
Большие разливы
Известняк и доломит (карбонат кальция-магния) являются распространенными нейтрализующими агентами для крупных разливов соляной кислоты и других кислот в естественных водоемах и в потоках воды из угольных шахт. Оба материала реагируют с кислотой в течение примерно 15 минут с образованием солей в шламе, с которыми легко обращаться и удалять. Известняк является лучшим реагентом из двух.
Источник
Чем нейтрализуется щелочь
Самая благоприятная жидкость (среда) имеет нулевую кислотность, если кислотность среды повышена, то это кислота, если понижена – щелочь. И то и другое в отдельности опасны для человека и могут вызвать сильные ожоги. Зато сталкиваясь друг с другом они взаимно уничтожаются, нейтрализуются. Происходит что-то подобное аннигиляции. Так что при необходимости щелочь можно нейтрализовать слабым раствором кислоты. В домашних условиях это либо уксус, либо лимонная кислота, либо просто рассол из капусты или маринованных огурцов. Смывается щелочь и струей воды, так что смело подставляйте обожженное место под проточную воду, так и при первой помощи действовать рекомендуют.
Щелочь нейтрализуется кислотой. Реакция нейтрализации. Образуется соль и вода. Поэтому место, куда попала щелочь, нужно полить кислотой, лимонной или уксусной, например. Только не очень концентрированной, а то ожог будет.
Завод водоочистного оборудования ООО «ПЗГО» приветствует всех на странице своего официального сайта, посвященной такой теме как нейтрализация щелочи, щелочных стоков и вод в промышленном масштабе.
Прежде чем перейти к теоретической части вопроса, хотелось бы обратить Ваше внимание на наши собственные недорогие, компактные и высокоэффективные очистные станции модельного ряда «ШВ», изготавливаемые по уникальным патентам и собственным многолетним наработкам.
Строго учитываем все аспекты Заказа: объем, агрессивность и концентрацию очищаемой среды, пространственное размещение станций, а также экономическую подоплеку Вашего производственного предприятия.
Для запроса цены или обсуждения тонкостей Вашего Заказа на систему очистки щелочных или кислых стоков, пожалуйста, контактируйте с Клиентским отделом ООО «ПЗГО» любым удобным способом или воспользуйтесь кнопкой ниже, и мы свяжемся с Вами в течение 1 часа рабочего дня.
Химические и физические свойства щелочей и их растворов
Щелочи, с химической точки зрения, представляют собой гидроксиды щелочных и щелочноземельных металлов (группы в периодической таблице – Ia и IIa). К таким металлам относятся натрий (образует каустическую соду), калий (едкое кали), барий (едкий барий), бериллий, стронций, унбинилий, литий, цезий, франций. Все щелочные растворы проявляют основные свойства, но не наоборот.
Одним из самых важных химических свойств оснований является активное вступление в реакцию с кислотами – реакция нейтрализации, ведущая к ассоциативному образованию солей и воды. Эта особенность широко используется при проектировании оборудования для нейтрализации промышленных выбросов.
Последствия, вызванные индустриальными стоками
Физически, эти соединения – твёрдые белые порошки (кристаллы), имеющие предельный коэффициент гигроскопичности, интенсивно поглощающие из воздуха воду, углекислый газ, а также другие газы и жидкости. Имеют высокий показатель растворимости в воде, что также берется в расчет при проектировании станций очистки стоков.
Кристалы едкого натра
Гигроскопичностью и экстремальной биологической опасностью алкалинов продиктованы крайне осторожные меры обращения с этими соединениями: щелочные ожоги кожи и дыхательных путей в значительной мере превосходят повреждения, полученные при равных обстоятельствах от кислоты.
Щелочные сливы предприятий
В очистке или нейтрализации стоков основного свойства нуждаются множественные производственные и обрабатывающие предприятия, а также лаборатории – независимые или прикрепленные к тому или иному предприятию. Рассмотрим основные направления.
Стоит заметить, что проблемой утилизации сточных сливов обеспокоены не только те компании, которые используют сами щелочи, но, как правило, и те, в чьих технологических циклах участвуют калий, натрий, магний, кальций, стронций, барий, бериллий, литий, цезий.
Методы и способы нейтрализации щелочи
Основным водоочистным методом в промышленности является нейтрализация щелочи кислотой. Наш завод предлагает к расчету, изготовлению и продаже установки, реализующие нижеследующий метод очистки.
Реакция с кислотой
В основной бак установки заливается щелочной раствор. Система автоматически детектирует его концентрацию и через насос-дозатор подает в реактор необходимое количество кислого раствора, (состав которого зависит от очищаемой среды: азотная, серная, соляная и другие кислоты).
Принципиальная схема станции нейтрализации стоков. 1, 2 – резервуары для реагентов, 3 – главный бак-реактор, 4 – усреднитель (отстойник)
После это включается механическая мешалка, работа которой способствует более продолжительному контакту реагентов и более полному протеканию реакции. Параллельно с этим, в режиме онлайн, pH-датчиками идет сверка текущих показаний с заданными параметрами.
По достижении требуемого уровня pH мешалка выключается и включается центробежный насос, который сливает прореагировавший раствор в канализационную магистраль. Объем бака и реагента прямо зависит от потребностей Заказчика. Помимо прочего, установка может быть оснащена дополнительными емкостями для буферного хранения агентов, очищаемых или очищенных жидкостных масс.
Комплекс водоподготовки для промышленных сливов предприятий
Очистка щелочи углекислым газом
Второй по распространенности метод алкалиновой нейтрализации – насыщение раствора углекислотой – в жидком или газообразном состоянии.
Углекислотная установка водоочистки: основными элементами здесь являются бак-нейтрализатор и баллоны с CO2
В принципе, если взглянуть на этот подход более детально, то можно увидеть, что он также задействует технологию кислотного очищения: подающийся в сток углекислый газ, взаимодействуя с водой, «на лету» образует слабую угольную кислоту – именно она и нейтрализует щелочь.
Озонирование
В дополнение к двум вышеперечисленным методам стоит добавить озонирование – самый сложный и трудозатратный вариант нейтрализации щелочи. Чаще всего озонирование применяется для биологической ректификации воды и только там, где это действительно оправдано: уничтожение опасных микробов, бактерий, плесени, грибков, очищение стоков от нефтепродуктов, цианидов, ароматических углеводородов. Вдобавок, озонаторы имеют немалую стоимость, а ядовитость озона – I класс опасности – представляет опасность и для человека.
Ограниченно озонирование воды для достижения требуемого уровня pH применяется в рыбных хозяйствах (фермах), а также в больших аквариумах, океанариумах.
Кстати, трехатомный кислород (озон) в естественной среде существует всего от нескольких до нескольких десятков минут, после чего распадается на O2 с отрицательным изменением энтальпии ΔH (экзотермическая реакция).
Сводная таблица эффективности методов нейтрализации щелочи
| Способ | Плюсы | Особенности |
| Кислотный |
Заказ, покупка, доставка и монтаж установок щелочной нейтрализации
По любым вопросам, касающимся индивидуального проектирования, изготовления и недорогого приобретения современных и эффективных промышленных систем очистки стоков, пожалуйста, контактируйте с нашим заводом удобным Вам способом.
Осуществим быструю и аккуратную доставку оборудования по России, СНГ или странам Зарубежья. При необходимости проведем профессиональный монтаж или шефмонтаж «под ключ».
Полный комплект документации: схемы, чертежи, паспорта, сертификаты. Гарантия на станции и выполненные работы.
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Источник