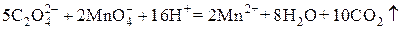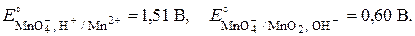2.3.4. Окислительно-восстановительного титрования
2.3.4.5. Приготовление и стандартизация рабочего раствора
В качестве рабочего раствора в методе перманганатометрии применяют 0,05 моль/л или 0,1 моль/л раствор KMnO4. Даже очень разбавленные растворы перманганата калия интенсивно окрашены. Поэтому фиксируют точку эквивалентности по появлению розовой окраски раствора, вызываемой добавлением лишь одной капли избытка стандартного раствора KMnO4. Его титр нельзя рассчитать по весу растворенного перманганата. Это связано с тем, что продажные препараты KMnO4 относительно высокой чистоты содержат следы хлоридов, нитратов, сульфатов (перманганата в них 99,0-99,6 % масс.). Однако перекристаллизацией из водного раствора можно получить продукт, содержащий 99,6-99,8 % масс. KMnO4. Но даже если взять его точную навеску для приготовления титрованного раствора, то концентрация оказывается несколько меньшей, чем это следовало бы по расчету. Оказывается, что даже в дистиллированной воде хорошего качества обычно присутствуют малые количества восстановителей. Поэтому лучше всего для приготовления стандартного раствора перманганата растворить несколько большее количество KMnO4, чем это требовалось бы по расчету, прокипятить раствор, охладить, а затем устанавливать его титр.
Для приготовления 1 л раствора перманганата калия с молярной концентрацией эквивалента 0,1 моль/л взвешивают на технических весах 3,16 г KMnO4 (если титрование проводят в кислой среде, то M1/5(KMnO4) = M(KMnO4)/5), раствор нагревают до кипения, дают ему постоять не менее двух недель для того, чтобы завершились все возможные окислительно-восстановительные реакции и полностью прошло осаждение образующегося при этом MnO2. Выдержанный раствор сливают через сифон (раствор можно фильтровать через асбестовую сетку или стеклянный фильтр, но ни в коем случае не через бумажный) и сохраняют в тщательно промытых темных бутылях, так как свет ускоряет разложение KMnO4:
Применяемая для хранения перманганата склянка должна быть снабжена притертой пробкой с целью защиты от соприкосновения с парами веществ, имеющих свойства восстановителей, от пыли, а также с целью исключения его испарения. Притертую пробку предварительно обрабатывают хромовой смесью для удаления органических веществ, а затем дистиллированной водой.
Готовый раствор не должен образовывать при хранении бурый налет двуокиси марганца на стенках посуды, так как его присутствие катализирует процесс дальнейшего разложения перманганата:
Количество двуокиси марганца в этом процессе возрастает, и поэтому действие ее — автокаталитическое. Действие ионов Mn 2+ такое же, так как эти ионы образуют с перманганатом водную двуокись марганца.
Лучший способ приготовления 0,01 М раствора KMnO4 состоит в разбавлении более концентрированного раствора водой, освобожденной от присутствия восстановителей путем перегонки в присутствии перманганата.
Титр раствора KMnO4 с течением времени несколько изменяется, поэтому его необходимо периодически проверять.
Титр раствора KMnO4 устанавливают по щавелевой кислоте H2C2O4 · 2H2O, оксалату аммония (NH4)2C2O4 · H2O, оксалату натрия Na2C2O4, мышьяковистому ангидриду As2O3, гексацианоферрату (II) калия K4[Fe(CN)6] · 3H2O, по металлическому железу, по соли Мора FeSO4 · (NH4)2SO4 · 6H2O, по йодиду калия KI, йодату калия KIO3 и некоторым другим веществам.
Наиболее часто в качестве установочных веществ используются щавелевая кислота и ее соли, так как они легко могут быть очищены от примесей перекристаллизацией из воды. Более удобно пользоваться оксалатом аммония или натрия, концентрация которых не изменяется во времени. Оксалат натрия не содержит кристаллизационной воды и устойчив, но, к сожалению, относительно труднорастворим.
Источник
Стандартизация раствора перманганата калия
Цель работы: установить точную концентрацию раствора KMnO4.
Сущность работы. Точную концентрацию раствора перманганата калия устанавливают через 8–10 дней после его приготовления по щавелевой кислоте H2C2O4 ∙ 2H2O или оксалату натрия Na2C2O4 и другим веществам. За это время происходит окисление восстановителей, присутствующих в дистиллированной воде (пыль, следы органических соединений), и концентрация KMnO4 стабилизируется.
Оксалат натрия и щавелевая кислота являются наиболее удобными установочными веществами, так как они не токсичны и устойчивы при хранении.
В основе титрования лежит реакция
Факторы эквивалентности перманганата и оксалата определяются, исходя из полуреакций:



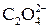

Титрование оксалат-ионов перманганатом калия проводят в сильнокислой среде по следующим причинам:
– образуются бесцветные ионы Mn 2+ , которые не мешают фиксировать конечную точку титрования;
– окислительная способность KMnO4 в кислой среде намного выше, чем в нейтральной и слабощелочной среде:
Среда создается избытком H2SO4. Нельзя использовать HNO3 и HCl, так как в их присутствии протекают побочные реакции.
Реакция взаимодействия перманганата калия с оксалат-ионами относится к типу автокаталитических. Она катализируется продуктом реакции – ионами Mn 2+ . Первые капли KMnO4 даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов Mn 2+ возрастает и скорость реакции увеличивается. Нагревание титруемого раствора способствует увеличению скорости реакции. Кроме того, при нагревании увеличивается величина скачка титрования, следовательно, повышается точность определения.
Титрование проводится без индикатора, так как все продукты реакции бесцветны и одна лишняя капля KMnO4 после точки эквивалентности придаст раствору собственную малиновую окраску.
Оборудование и реактивы: бюретка, пипетка Мора, конические колбы, мерная колба, мерный цилиндр (10–25 мл), электрическая плитка,
Выполнение работы. Навеску установочного вещества, рассчитанную для приготовления 0,05 н. раствора, взвешивают в тигле на технических весах, затем уточняют массу на аналитических весах и переносят вещество без потерь в мерную колбу.
На тех же аналитических весах взвешивают тигель с остатками вещества и по разности определяют массу установочного вещества. Растворяют навеску в дистиллированной воде, разбавляют раствор до метки и тщательно перемешивают. Зная точную массу вещества и вместимость мерной колбы, вычисляют молярную концентрацию эквивалента оксалат-ионов в растворе.
Заполняют бюретку раствором KMnO4 и устанавливают уровень жидкости на нуле. Отсчеты объема при титровании перманганатом калия целесообразно делать по верхнему краю мениска уровня жидкости, так как нижний край мениска не виден из-за интенсивной окраски раствора.
Помещают в коническую колбу для титрования 10 мл 2 н. раствора H2SO4 и нагревают, не допуская закипания. Пипеткой берут из мерной колбы аликвотную часть раствора установочного вещества и вносят в нагретый раствор серной кислоты (нагревать и кипятить кислые растворы оксалатов не следует, так как они разлагаются). Горячий раствор титруют перманганатом калия по каплям, энергично перемешивая. Каждую следующую каплю прибавляют только после того, как исчезнет окраска от предыдущей. Титруют перманганатом до появления не исчезающей в течение 30 с слабо-розовой окраски.
По результатам титрования рассчитывают точную концентрацию раствора перманганата калия, моль-экв/л.
В некоторых случаях по указанию преподавателя раствор KMnO4 может быть приготовлен из фиксанала или установление концентрации KMnO4 может быть проведено по приготовленному из фиксанала раствору оксалата.
Источник
Стандартизация рабочего раствора перманганата калия
Перманганат калия обычно содержит ряд примесей, поэтому раствор, приготовленный по навеске, не имеет точной концентрации.
Раствор перманганата калия должен храниться в склянке из темного стекла, так как под действием света происходит его разложение:
Поэтому через 5-7 дней после приготовления раствор перманганата калия отфильтровывают через стеклянный фильтр и проводят его стандартизацию.
Молярную концентрацию эквивалентов раствора перманганата калия обычно устанавливают по стандартному раствору перекристаллизованной щавелевой кислоты Н2С2О4 . 2Н2О.
Стандартизация раствора перманганата калия по щавелевой кислоте
Реакция между перманганатом калия и щавелевой кислотой в сернокислой среде протекает по следующему уравнению:
2 êMnO4 — + 8 H + + 5 e ® Mn 2+ + 4 H2O
Порядок выполнения работы
1. Ополоснуть и наполнить бюретку раствором перманганата калия. Установить уровень жидкости на нулевом делении по верхнему краю мениска (для окрашенных жидкостей уровень устанавливается по верхнему краю мениска). Заполнить кончик бюретки.
2. В колбу для титрования цилиндром налить 15 мл 1 М раствора серной кислоты H2SO4 и 25 мл дистиллированной воды. Колбу на 2-3 минуты поставить на водяную баню нагретую до 70-80 о С. Чистую пипетку ополоснуть раствором щавелевой кислоты. Отмерить пипеткой точный объем раствора щавелевой кислоты H2C2O4 и перенести его в колбу для титрования c нагретым раствором серной кислоты.
3. Оттитровать горячий раствор щавелевой кислоты перманганатом калия. Катализатором реакции служат ионы Mn 2+ , которые являются одним из продуктов реакции. В начале титрования реакция идет медленно, первые капли перманганата обесцвечиваются с трудом. Поэтому прибавление первого миллилитра перманганата нужно проводить очень медленно. После того как образовались ионы Mn 2+ , скорость реакции увеличивается, и титрование можно вести быстрее, прибавляя перманганат калия маленькими порциями и сильно перемешивая раствор в колбе. Новая порция прибавляется только после обесцвечивания предыдущей. Конец титрования определяется по появлению неисчезающей в течение 1-2 минут бледно-розовой окраски от одной лишней капли перманганата калия. Взятый объем щавелевой кислоты и объем перманганата калия, пошедший на титрование, записать в таблицу.
4. Результаты титрования записать в таблицу. Повторить титрование до получения сходящихся результатов.
5. Рассчитать молярную концентрацию эквивалента и титр раствора перманганата калия.
Форма лабораторного отчета
Лабораторная работа № . Дата
“Название лабораторной работы”
Определяемое вещество (титрант) — СЭ(KMnO4) = ?, T(KMnO4) = ?
Индикатор – избыточная капля раствора KMnO4
Условия титрования — (рН среды, нагревание и т.д.)
Уравнение реакции (в молекулярной и ионно-молекулярной формах):
| № опыта | V(H2C2O4), мл | V(KMnO4), мл |
| 1. | 10,00 | |
| 2. | 10,00 | |
| 3. | 10,00 |
Определение содержания железа в растворе соли Мора, FeSO 4 . ( NH 4 )2 SO 4 ·6 H 2 O
Сульфат железа (II), входящий в состав соли Мора, вступает в реакцию с перманганатом калия в сернокислой среде по уравнению:
1 êMnO4 — + 8H + + 5 e ® Mn 2+ + 4H2O
5 êFe 2+ — e ® Fe 3+
Порядок выполнения работы
1. Получить у лаборанта мерную колбу с контрольным раствором соли Мора. Номер колбы и ее объем записать в тетрадь. Довести объем раствора дистиллированной водой до метки, закрыть колбу пробкой и хорошо перемешать.
2. Заполнить бюретку раствором перманганата калия, молярная концентрация эквивалента которого была установлена в предыдущей работе.
3. В колбу для титрования взять пипеткой пробу раствора соли Мора (объем пипетки записать в таблицу), добавить цилиндром 15 мл 1 М раствора серной кислоты и 25 мл дистиллированной воды.
4. Оттитровать раствор соли Мора перманганатом калия до появления бледно-розовой окраски. Титрование проводится при комнатной температуре. Объем перманганата калия, пошедший на титрование, записать в таблицу.
5. Повторить титрование до получения сходящихся результатов. Результаты эксперимента записать в таблицу.
6. Рассчитать молярную концентрацию эквивалента, титр раствора соли Мора по железу и содержание железа в контрольном растворе (объеме колбы).
7. Вычислить относительную ошибку анализа, узнав у преподавателя истинное содержание железа в контрольном растворе.
Форма лабораторного отчета
Лабораторная работа № . Дата
“Название лабораторной работы”
Аналитическая задача №____
Стандартный раствор — СЭ(KMnO4) = 0,0000 моль/л
Определяемое вещество (титрант) — СЭ(Fe 2+ ) = ?, T(Fe 2+ ) = ?
Индикатор – избыточная капля раствора KMnO4
Условия титрования — (рН среды, нагревание и т.д.)
Уравнение реакции (в молекулярной и ионно-молекулярной формах):
| № опыта | V(Fe 2+ ), мл | V(KMnO4), мл |
| 1. | 10,00 | |
| 2. | 10,00 | |
| 3. | 10,00 |
m(Fe 2+ ) = T(Fe 2+ )∙V колбы
К, % = |m(Fe 2+ )теор.- m(Fe 2+ )эксп.|: m(Fe 2+ )теор. х 100
Вопросы для самоподготовки
1. Принцип методов редоксиметрии.
2. От чего зависит редокс-потенциал? Уравнение Нернста.
3. Что служит индикаторами в методах редоксиметрии?
5. Как приготовить рабочий раствор перманганата калия?
Задачи и упражнения
1. Закончить уравнения окислительно-восстановительных реакции, поставить коэффициенты и вычислить молярные массы эквивалентов окислителя и восстановителя:
2. Можно ли с помощью Sn 4+ окислить Mn 2+ до MnO4 — в кислой среде? Ответ подтвердить расчетом ЭДС соответствующей реакции.
3. KMnO4 можно получить по реакции K2MnO4 с хлором в щелочной среде. Можно ли вместо хлора использовать пероксид водорода? Ответ подтвердить расчетом ЭДС соответствующей реакции.
4. Можно ли с помощью Br2 окислить Na3[Cr(OH)6] до Na2CrO4 в щелочной среде? Ответ подтвердить расчетом ЭДС соответствующей реакции.
5. К 20 мл раствора KClO3 прилили 25 мл 0,1246 н раствора Н2С2О4, избыток которого оттитровали 8,2 мл 0,1184 н раствора KMnO4. Найти массу KClO3 в исходном растворе.
6. К 42 мл раствора K2Cr2O7 прилили в кислой среде 50 мл 0,1480 н раствора KI, избыток которого оттитровали в кислой среде 21,4 мл 0,0962 н раствора KMnO4. Найти массу K2Cr2O7 в исходном растворе.
7. К 15 мл раствора K2Cr2O7 прилили 15 мл 0,1200 н раствора FeSO4 в кислой среде. Избыток FeSO4 оттитровали 5,2 мл 0,0642 н раствора KMnO4. Найти массу K2Cr2O7 в исходном растворе.
8. К раствору K2Cr2O7 добавили избыток раствора иодида калия. Выделившийся иод оттитровали 14,8 мл 0,0840 н раствора тиосульфата натрия. Найти массу K2Cr2O7 в исходном растворе.
9. К раствору CuSO4 добавили избыток раствора иодида калия. Выделившийся иод оттитровали 4,8 мл 0,1524 н раствора тиосульфата натрия. Найти массу CuSO4 в исходном растворе.
10. К раствору FeCl3 добавили избыток раствора иодида калия. Выделившийся иод оттитровали 12,8 мл 0,1108 н раствора тиосульфата натрия. Найти массу FeCl3 в исходном растворе.
ЛАБОРАТОРНАЯ РАБОТА 10
Дата добавления: 2018-11-24 ; просмотров: 639 ; Мы поможем в написании вашей работы!
Источник