Приготовление по точно взятой навеске.
Приготовление точных растворов кислот из фиксаналов.
Для приготовления точных растворов различных кислот удобно пользоваться так называемыми фиксаналами, представляющими собой запаянные стеклянные ампулы с точными навесками реактивов. Каждая ампула имеет надпись, показывающая, какое вещество и в каком количестве находится в ампуле. Из фиксаналов можно готовить также растворы солей и щелочей.
Необходимо помнить, что фиксаналы, содержащие щелочь, пригодны в течение определенного срока. Перед тем как использовать фиксанал щелочи, следует внимательно осмотреть содержимое ампулы. Раствор должен быть абсолютно прозрачным.
Из фиксаналов можно готовить точные растворы таких солей, которые не удовлетворяют требованиям, предъявляемым веществам, из которых можно готовить точные растворы по точно взятой навеске, например KMn04, Na2S04 и др. Однако нужно учитывать, что некоторые
растворы, например растворы щелочи, при стоянии довольно быстро меняют свою концентрацию.
Для приготовления раствора из фиксанала поступают следующим образом.В чисто вымытую мерную колбу вставляют воронку, тщательно вымытую и сполоснутую дистиллированной водой; если в ампуле содержится не раствор, а сухое вещество, то воронка должна быть сухой. Затем в воронку вставляют специальный стеклянный боек (обычно прилагается к коробке с фиксаналами), также сполоснутый дистиллированной водой. Ампулу протирают спиртом, чтобы удалить надпись, и обмывают дистиллированной водой. Затем ее вставляют в воронку так, чтобы она своим тонким, втянутым внутрь дном касалась бойка, приподнимают ее и слегка ударяют о конец бойка. Содержимое ампулы попадает через воронку в колбу.Сбоку в ампуле имеется углубление, в котором пробивают отверстие стеклянной палочкой с заостренным концом. Через это отверстие многократно обмывают дистиллированной водой из промывалки стенки ампулы маленькими порциями. После этого споласкивают стенки ампулы снаружи и ампулу выбрасывают.Ополаскивают воронку и боек, затем поднимают воронку и обмывают наружную часть трубки воронки. Обмывают верхнюю часть шейки мерной колбы.
Производя все эти операции по промыванию, следят, чтобы количество воды в мерной колбе к концу всех операций не превысило 2/3 объема колбы. Осторожно вращательным движением перемешивают содержимое колбы.
Дистиллированной водой доводят содержимое колбы до метки так, как это было описано выше, и перемешивают содержимое колбы 12-15 раз.
Приготовление точного раствора кислоты из концентрированной кислоты
Как было указано выше, точные растворы кислот готовят из фиксаналов. Однако в случае отсутствия фиксанала можно рекомендовать следующий способ приготовления точного раствора кислоты. Измерив, плотность концентрированной кислоты, по таблице определяют ее концентрацию и производят расчет. Сухую бюретку со стеклянным краном споласкивают 2 раза концентрированной кислотой и заполняют. В мерную колбу наливают около 1/2 объема дистиллированной воды и осторожно выпускают из бюретки концентрированную кислоту с точностью до сотых долей миллилитра. 11еремешивают раствор, дают ему остыть и доводят водой содержимое колбы до метки.
Расчёты при приготовлении точных растворов.
Пример 1. Требуется приготовить 2 л 0,5 М раствора Na2C03. Молярная масса Na2C03равна 106. Следовательно, 1 л 0,5 М раствора содержит 106 х 0,5 = 53 г Na2C03. Для приготовления 2 л необходимо взять 53 х 2 = 106 г Na2C03. Это количество соли будет содержаться в 2 л раствора.
Пример 2. Требуется приготовить 500 мл О,1 н раствора Na2S04. 1 л 0,1 н раствора содержит 0,1 эквивалента:
1000 мл — 0,1 эквивалента
Х=500*0,1 =0.05 эквивалентов
Подсчитывают эквивалентную массу соли:
1 эквивалент — 71,02 г 0,05 — // — — х г
х = 71,02 • 0,05 = 3,5510 г
Следовательно, для приготовления требуемого раствора необходимо взять 3,5510 г Na2S04и приготовить раствор в мерной колбе вместимостью 500 мл.
Пример 3. Требуется приготовить 1 л 0,1 н раствора H2S04. Эквивалент H2S04равен М : 2 = 98,07 : 2 = 49,035. Следовательно, в 1 л 0,1 н раствора содержится 49,035 х 0,1 = 4,9035 г H2S04. Рассчитывают, какой объём концентрированной серной кислоты нужно взять для приготовления этого раствора. Серная кислота с плотностью 1,84 содержит 95,64% серной кислоты. Следовательно:
100 г — 95,64 г хг — 4,9035 г
Если перевести массу в объём, то получим 5,13 : 1,84 = 2,74 мл, т.е. надо взять 2,74 мл концентрированной серной кислоты (рd = 1,84) для приготовления 1 л 0,1 н раствора.
Приготовление по точно взятой навеске.
Таким способом готовят растворы многих солей, некоторых твердых кристаллических кислот, например щавелевой и борной. Растворы щелочей, большинства кислот и некоторых солей готовить таким способом нельзя. Вещество, используемое для приготовления точного раствора, должно отвечать следующим требованиям: быть чистым (практически не содержать примесей); точно соответствовать формуле; не обладать гигроскопичностью или способностью быстро терять на воздухе кристаллизационную воду; быть устойчивым в водном растворе. Если вещество не удовлетворяет этим требованиям, то приготовить из него раствор точно заданной концентрации по точно взятой навеске невозможно.Для приготовления раствора поступают следующим образом. Мерную колбу тщательно моют хромовой смесью, много раз споласкивают водой из-под крана и затем 3-4 раза дистиллированной водой. На аналитических весах берут на часовом стекле или в бюксе рассчитанную навеску вещества, подлежащего растворению, и высыпают ее в мерную колбу через сухую воронку. Пересыпать следует очень аккуратно, чтобы не пересыпать мимо колбы ни одной крупинки. Остатки с часового стекла или бюкса очень тщательно смывают из промывалки в воронку дистиллированной водой. Затем обмывают внутренние стенки воронки и наружную часть трубки, слегка приподняв ее.
Надо следить за тем, чтобы общее количество воды, использованное для обмывания часового стекла или бюкса, а также воронки, занимало не более половины колбы.Колбу закрывают пробкой и осторожно вращательным движением (не переворачивая колбу!) перемешивают содержимое до тех пор, пока навеска полностью не растворится. После этого наливают из промывалки воду, уровень которой примерно на 1 см должен быть ниже метки. Установив колбу так, чтобы метка находилась на уровне глаз, осторожно по каплям добавляют воду до тех пор, пока нижняя часть мениска не будет касаться метки на шейке колбы. Тщательно закрывают колбу пробкой и перемешивают раствор 12-15 раз.
Не всегда необходимо отвешивать количество вещества, точно равное рассчитанному. Можно взять навеску, близкую к расчетной, расходящуюся с ней в третьем и четвертом десятичных знаках, и взвесить ее с точностью до четвертого знака. Далее раствор готовят так, как было описано выше. Таким образом получают раствор с известной точной концентрацией, потому что, зная массу и объем раствора, легко вычислить его концентрацию.
Пример.Требуется приготовить 100 мл 0,1 н раствора хлорида натрия. Рассчитано, что навеска для приготовления этого раствора должна быть равна 0,5845 г.
Масса бюкса с навеской — 10,7080 г Масса бюкса — 10,1218 г
Навеска — 0,5862 г
0,5845 — 0,1 н раствор 0,5862 — х
Следовательно, растворив взятую навеску в мерной колбе вместимостью 100 мл, мы получим раствор, точная концентрация которого будет равна 0,1003
Источник
Способы приготовления стандартных растворов.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических весах (погрешность таких весов составляет 0,0002г) точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
2. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным и часто применяется в аналитической химии.
3. Метод приблизительной навески. Предполагает работу с растворами, которые меняют свою массу на воздухе, например, перманганат калия. Работать с такими растворами нельзя, поэтому перед применением их в качестве стандартных, необходимо оттитровать другим раствором с точно известной концентрацией.
4. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствора другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
Посуда, применяемая в объемном анализе.
В объемном анализе применяется специальная мерная посуда: бюретки, пипетки и мерные колбы.
Бюретки. Это градуированные стеклянные трубки, приспособленные для отмеривания растворов небольшими порциями или отдельными каплями. Бюретка укрепляется вертикально в штативе, и отсчет делений ведется сверху вниз. Нижняя часть бюретки сужена и соединяется короткой резиновой трубкой с тонким стеклянным носиком. Бюретки изготавливаются объемом от 1 до 50мл. Раствор заливают в бюретку через воронку.
Пипетки. Это специальные стеклянные трубки, предназначенные для отмеривания и переноса заданного объема раствора из одного сосуда в другой. При выливании раствора из пипетки, наполненной до метки, объем раствора в точности соответствует маркировке. Наполнение пипетки производят всасыванием раствора резиновой грушей, плотно приставленной к верхнему концу пипетки. Пипетки изготавливаются различных объемов: от 0,1 до 10мл.
Дозаторы. Большое распространение получили более удобные и безопасные в обращении пипетки-дозаторы, гарантирующие высокую точность и воспроизводимость объема измеряемых жидкостей в пределах от 2 до 5000 мкл. Дозатор забирает из химического сосуда тот объем раствора, который предварительно механически установлен на нем.
Мерные колбы. Это колбы с длинным узким горлышком, на котором наносится кольцевая метка. На колбе указывается объем, который реализуется при наполнении колбы до метки. Объем мерной колбы составляет 25, 50, 100, 200, 250, 500, 1000 или 2000мл.
Мерные цилиндры. В объемном анализе они используются для приблизительного измерения объемов некоторых вспомогательных растворов или воды и имеют второстепенное значение при необходимости измерения объемов меньшей точности.
Вопросы для самоконтроля
1. Раствор как гомогенная система. Растворитель, растворённое вещество. Концентрированные и разбавленные растворы.
2. Количественный состав раствора как одна из главных характеристик раствора.
3. Роль воды и растворов в жизнедеятельности.
4. Физико-химические свойства воды, обуславливающие ее уникальную роль как единственного биорастворителя.
5. Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, молярная концентрация эквивалента (или нормальная концентрация), массовая концентрация (или титр).
6. Химический эквивалент, закон эквивалентов.
7. Эквивалентная масса вещества, её связь с молярной массой, фактор эквивалентности. Правила расчёта фактора эквивалентности для различных классов неорганических соединений.
Примеры решения задач
1. Приготовьте 500г раствора NaCl с ω=10%.
| Дано: m раствора (NaCl)=500г ω (NaCl)=10% | Решение ω =m вещества·100%/ m раствора 1. Определяем массу NaCl по формуле: m вещества= ω· m раствора 100% m (NaCl)=10%·500г =50г 100г 2. Определяем массу воды по формуле: m раствора= m вещества+ m растворителя m (H2O)= m раствора— m вещества m (H2O)=500г-50г=450г. Согласно формуле ρ= m/V, где ρ- плотность раствора, m-масса, V-объем V(H2O)= m (H2O)=450г =450мл ρ (H2O) 1г/мл |
| Найти: m (NaCl)=? m (H2O)=? |
Ответ: Для того, что бы приготовить 500г раствора NaCl с ω=10%, нужно взвесить на аналитических весах 50г NaCl, поместить в любую посуду и добавить туда 450мл воды, отмерив ее цилиндром.
Приготовьте 250мл 0,5М раствора CuSO4 из безводного CuSO4 мл
| Дано: Cм(CuSO4)=0,5М V (CuSO4)=0,25л | Решение См=n(CuSO4)/V Находим количество молей раствора CuSO4 по формуле n(CuSO4)=См·V, тогда n(CuSO4)=0,5моль/л·0,25л=0,125моль. М(CuSO4)=160г/моль Согласно формуле n=m/M, находим массу CuSO4 m (CuSO4)= n· M=0,125моль ·160г/моль=20г |
| Найти: m (CuSO4)=? |
Ответ: Для того, что бы приготовить 250мл CuSO4 из безводного, нужно взвесить на аналитических весах 20г CuSO4, перенести в мерную колбу объемом 250мл и довести до метки водой.
Приготовьте 50мл 0,025N раствора NaOH разбавлением 1N раствора NaOH.
Дано:  (NaOH)=1N (NaOH)=1N  (NaOH)=0,025N V2(NaOH)=50 мл (NaOH)=0,025N V2(NaOH)=50 мл | Решение 1. Определяем объем исходного 1N раствора NaOH по формуле  тогда тогда 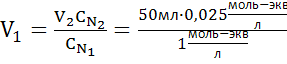 = 1,25мл = 1,25мл |
| Найти: V1(NaOH)= ? |
Ответ: Для того, что бы приготовить 50 мл 0,025N раствор NaOH из 1N, нужно с помощью пипетки отобрать 1,25мл 1N раствора NaOH, перенести в мерную колбу объемом 50 мл и довести до метки водой.
Тесты для самоконтроля
Тест № 1
1. Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О,
б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О,
г) 5 моль СаС12 растворено в 100 г Н2О
2. Эквивалентная масса меди в соединении СuSO4 равна:
3. Укажите истинный раствор:
б) вода + поваренная соль,
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды,
б) сколько моль растворенного вещества содержится в 1 л раствора,
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора,
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
5. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
Тест № 2
1. Нормальная концентрация – это количество моль вещества, растворенного в:
б) 1 л растворителя,
в) 100 г растворителя,
г) 100 г раствора.
2. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора,
г) моль вещества содержится в 1 мл раствора
3. Приведите основную формулу для определения концентраций в объемном анализе.
в) 

г) 

4. Масса хлорида натрия количеством вещества 0,8 моль равна:
5. Массовая доля показывает количество:
б) г растворенного вещества на 100 г воды,
в) 1 моль вещества в 1 л раствора,
г) г растворенного вещества в 100 г раствора.
Тест № 3
1. Титр показывает сколько:
а) г вещества содержится в 1000 мл раствора,
б) г вещества содержится в 1 мл раствора,
в) г вещества содержится в 100 г раствора,
г) моль вещества содержится в 1 мл раствора
2. Эквивалентная масса меди в соединении СuSO4 равна:
3. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды,
б) сколько моль растворенного вещества содержится в 1 л раствора,
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора,
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
4. Приведите основную формулу для определения концентраций в объемном анализе.
в) 

г) 

5. Методом приблизительной навески можно приготовить раствор:
Тест № 4
1. Массовая доля показывает количество:
б) г растворенного вещества на 100 г воды;
в) 1 моль вещества в 1 л раствора;
г) г растворенного вещества в 100 г раствора.
2. Масса хлорида натрия количеством вещества 0,8 моль равна:
3. Эквивалентую массу щавелевой кислоты, вступающей в реакцию c гидроксидом натрия, рассчитывают по следующей формуле:
4. Молярная концентрация показывает:
а) сколько г растворенного вещества содержится в 100 г воды,
б) сколько моль растворенного вещества содержится в 1 л раствора,
в) сколько моль-экв растворенного вещества содержится в 100 мл раствора,
г) сколько мл растворенного вещества содержится в 1000 мл раствора.
а) 188 г/моль; б) 171 г/моль; в) 94 г/моль; г) 114 г/моль.
Тест № 5
1. Приведите основную формулу для определения концентраций в объемном анализе.
в) 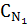

г) 

2. Выражение ω (СаС12)= 5% означает:
а) 5 г СаС12 растворено в 95 г Н2О,
б) 5 г СаС12 растворено в 100 г Н2О,
в) 5 г СаС12 растворено в 1000 г Н2О,
г) 5 моль СаС12 растворено в 100 г Н2О
3. Массовая доля метилового спирта в растворе, содержащем 60 г спирта и 40 г воды равна:
4. При полной нейтрализации Н3РО4 её эквивалент равен:
5. Методом точной навески можно приготовить раствор:
Ответы к тестам для самоконтроля
| № теста | Номер вопроса | |||
| а | а | б | б | б |
| а | б | б | б | г |
| г | а | б | б | г |
| г | б | б | б | в |
| б | а | б | б | а |
Занятие 3. Коллигативные свойства растворов
Цель занятия:
Изучение коллигативных свойств растворов
Студент должен знать:
Коллигативные свойства разбавленных растворов неэлектролитов. Законы Рауля и следствия из них. Осмос. Роль осмоса в жизнедеятельности живых организмов. Осмотическое давление: закон Вант-Гоффа.
Студент должен уметь:
решать задачи, определять осмотическое давление раствора
Изменения термодинамических свойств растворов относительно свойств растворителя зависят от: понижения давления пара, повышения температуры кипения, понижения температуры замерзания и осмотического давления. Поскольку такие свойства обусловлены коллективным влиянием растворённых частиц, их принято называть коллигативными – от латинского colligatus, что означает собирать.
Разберем этот вопрос подробнее.
При внесении в растворитель некоторого вещества меняются термодинамические свойства не только растворяемого вещества, но и свойства растворителя. Эти изменения связаны с характером взаимодействия молекул вещества и растворителя, а также с уменьшением концентрации молекул растворителя и пропорциональны числу растворенных частиц. Поэтому для свойств растворителя удобно использовать понятие идеального раствора.
Идеальным раствором называется раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом (∆Нсмеш. = 0).
Французский ученый Ф. М. Рауль первый сформулировал законы, описывающие влияние растворенного вещества на физические свойства растворителя. Эти законы выведены на основе второго начала термодинамики из условия термодинамического равновесия ∆ G = 0 для физических процессов.
Например, если в замкнутый сосуд поместить чистый растворитель, можно воду, то в этой системе будут протекать два процесса: испарение молекул воды с поверхности жидкости и обратный процесс – конденсация молекул из газовой фазы на поверхности жидкости. Через некоторое время в системе установится динамическое равновесие ∆ G = 0, т.е. такое состояние системы, когда число частиц, испаряющихся с поверхности жидкости за единицу времени, равно числу частиц, переходящих в жидкость из газовой фазы.
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара р 0 называют давлением или упругостью насыщенного пара чистого растворителя.
При данной температуре давление насыщенного пара чистого растворителя – величина постоянная и является термодинамической характеристикой растворителя. При повышении температуры р 0 над растворителем возрастает в соответствии с принципом Ле Шателье, так как испарение – процесс эндотермический. (∆Ниспар. => 0).
Если в летучий растворитель (спирт, вода и т. д.) внести нелетучее растворимое вещество, например сахарозу или хлористый натрий, то концентрация растворителя в образовавшемся растворе уменьшится, а следовательно, уменьшится число частиц растворителя, переходящих в газовую фазу, соответственно уменьшится химический потенциал растворителя. При этом давление насыщенного пара над раствором нелетучего вещества станет меньше, чем над чистым растворителем, следовательно, чем более концентрированный раствор, тем ниже давление пара растворителя над раствором. Эти эксперименты позволили Раулю в 1886 г. сформулировать первый закон:
Источник