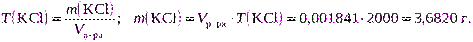Способы приготовления растворов



Способы приготовления стандартных растворов.
Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартнымиилирабочими. Это некоторые растворы кислот, щелочей, солей.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
— вещество должно быть чистым (без примесей)
— иметь постоянный состав (соответствовать определённой химической формуле)
— быть устойчивым как на воздухе, так и в растворе
— иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7·10H2O), дихромат калия (K2Cr2O7). Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
2. Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
3. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
4. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известным количеством эквивалентов. концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
Источник
Приготовление по точно взятой навеске.
Приготовление точных растворов кислот из фиксаналов.
Для приготовления точных растворов различных кислот удобно пользоваться так называемыми фиксаналами, представляющими собой запаянные стеклянные ампулы с точными навесками реактивов. Каждая ампула имеет надпись, показывающая, какое вещество и в каком количестве находится в ампуле. Из фиксаналов можно готовить также растворы солей и щелочей.
Необходимо помнить, что фиксаналы, содержащие щелочь, пригодны в течение определенного срока. Перед тем как использовать фиксанал щелочи, следует внимательно осмотреть содержимое ампулы. Раствор должен быть абсолютно прозрачным.
Из фиксаналов можно готовить точные растворы таких солей, которые не удовлетворяют требованиям, предъявляемым веществам, из которых можно готовить точные растворы по точно взятой навеске, например KMn04, Na2S04 и др. Однако нужно учитывать, что некоторые
растворы, например растворы щелочи, при стоянии довольно быстро меняют свою концентрацию.
Для приготовления раствора из фиксанала поступают следующим образом.В чисто вымытую мерную колбу вставляют воронку, тщательно вымытую и сполоснутую дистиллированной водой; если в ампуле содержится не раствор, а сухое вещество, то воронка должна быть сухой. Затем в воронку вставляют специальный стеклянный боек (обычно прилагается к коробке с фиксаналами), также сполоснутый дистиллированной водой. Ампулу протирают спиртом, чтобы удалить надпись, и обмывают дистиллированной водой. Затем ее вставляют в воронку так, чтобы она своим тонким, втянутым внутрь дном касалась бойка, приподнимают ее и слегка ударяют о конец бойка. Содержимое ампулы попадает через воронку в колбу.Сбоку в ампуле имеется углубление, в котором пробивают отверстие стеклянной палочкой с заостренным концом. Через это отверстие многократно обмывают дистиллированной водой из промывалки стенки ампулы маленькими порциями. После этого споласкивают стенки ампулы снаружи и ампулу выбрасывают.Ополаскивают воронку и боек, затем поднимают воронку и обмывают наружную часть трубки воронки. Обмывают верхнюю часть шейки мерной колбы.
Производя все эти операции по промыванию, следят, чтобы количество воды в мерной колбе к концу всех операций не превысило 2/3 объема колбы. Осторожно вращательным движением перемешивают содержимое колбы.
Дистиллированной водой доводят содержимое колбы до метки так, как это было описано выше, и перемешивают содержимое колбы 12-15 раз.
Приготовление точного раствора кислоты из концентрированной кислоты
Как было указано выше, точные растворы кислот готовят из фиксаналов. Однако в случае отсутствия фиксанала можно рекомендовать следующий способ приготовления точного раствора кислоты. Измерив, плотность концентрированной кислоты, по таблице определяют ее концентрацию и производят расчет. Сухую бюретку со стеклянным краном споласкивают 2 раза концентрированной кислотой и заполняют. В мерную колбу наливают около 1/2 объема дистиллированной воды и осторожно выпускают из бюретки концентрированную кислоту с точностью до сотых долей миллилитра. 11еремешивают раствор, дают ему остыть и доводят водой содержимое колбы до метки.
Расчёты при приготовлении точных растворов.
Пример 1. Требуется приготовить 2 л 0,5 М раствора Na2C03. Молярная масса Na2C03равна 106. Следовательно, 1 л 0,5 М раствора содержит 106 х 0,5 = 53 г Na2C03. Для приготовления 2 л необходимо взять 53 х 2 = 106 г Na2C03. Это количество соли будет содержаться в 2 л раствора.
Пример 2. Требуется приготовить 500 мл О,1 н раствора Na2S04. 1 л 0,1 н раствора содержит 0,1 эквивалента:
1000 мл — 0,1 эквивалента
Х=500*0,1 =0.05 эквивалентов
Подсчитывают эквивалентную массу соли:
1 эквивалент — 71,02 г 0,05 — // — — х г
х = 71,02 • 0,05 = 3,5510 г
Следовательно, для приготовления требуемого раствора необходимо взять 3,5510 г Na2S04и приготовить раствор в мерной колбе вместимостью 500 мл.
Пример 3. Требуется приготовить 1 л 0,1 н раствора H2S04. Эквивалент H2S04равен М : 2 = 98,07 : 2 = 49,035. Следовательно, в 1 л 0,1 н раствора содержится 49,035 х 0,1 = 4,9035 г H2S04. Рассчитывают, какой объём концентрированной серной кислоты нужно взять для приготовления этого раствора. Серная кислота с плотностью 1,84 содержит 95,64% серной кислоты. Следовательно:
100 г — 95,64 г хг — 4,9035 г
Если перевести массу в объём, то получим 5,13 : 1,84 = 2,74 мл, т.е. надо взять 2,74 мл концентрированной серной кислоты (рd = 1,84) для приготовления 1 л 0,1 н раствора.
Приготовление по точно взятой навеске.
Таким способом готовят растворы многих солей, некоторых твердых кристаллических кислот, например щавелевой и борной. Растворы щелочей, большинства кислот и некоторых солей готовить таким способом нельзя. Вещество, используемое для приготовления точного раствора, должно отвечать следующим требованиям: быть чистым (практически не содержать примесей); точно соответствовать формуле; не обладать гигроскопичностью или способностью быстро терять на воздухе кристаллизационную воду; быть устойчивым в водном растворе. Если вещество не удовлетворяет этим требованиям, то приготовить из него раствор точно заданной концентрации по точно взятой навеске невозможно.Для приготовления раствора поступают следующим образом. Мерную колбу тщательно моют хромовой смесью, много раз споласкивают водой из-под крана и затем 3-4 раза дистиллированной водой. На аналитических весах берут на часовом стекле или в бюксе рассчитанную навеску вещества, подлежащего растворению, и высыпают ее в мерную колбу через сухую воронку. Пересыпать следует очень аккуратно, чтобы не пересыпать мимо колбы ни одной крупинки. Остатки с часового стекла или бюкса очень тщательно смывают из промывалки в воронку дистиллированной водой. Затем обмывают внутренние стенки воронки и наружную часть трубки, слегка приподняв ее.
Надо следить за тем, чтобы общее количество воды, использованное для обмывания часового стекла или бюкса, а также воронки, занимало не более половины колбы.Колбу закрывают пробкой и осторожно вращательным движением (не переворачивая колбу!) перемешивают содержимое до тех пор, пока навеска полностью не растворится. После этого наливают из промывалки воду, уровень которой примерно на 1 см должен быть ниже метки. Установив колбу так, чтобы метка находилась на уровне глаз, осторожно по каплям добавляют воду до тех пор, пока нижняя часть мениска не будет касаться метки на шейке колбы. Тщательно закрывают колбу пробкой и перемешивают раствор 12-15 раз.
Не всегда необходимо отвешивать количество вещества, точно равное рассчитанному. Можно взять навеску, близкую к расчетной, расходящуюся с ней в третьем и четвертом десятичных знаках, и взвесить ее с точностью до четвертого знака. Далее раствор готовят так, как было описано выше. Таким образом получают раствор с известной точной концентрацией, потому что, зная массу и объем раствора, легко вычислить его концентрацию.
Пример.Требуется приготовить 100 мл 0,1 н раствора хлорида натрия. Рассчитано, что навеска для приготовления этого раствора должна быть равна 0,5845 г.
Масса бюкса с навеской — 10,7080 г Масса бюкса — 10,1218 г
Навеска — 0,5862 г
0,5845 — 0,1 н раствор 0,5862 — х
Следовательно, растворив взятую навеску в мерной колбе вместимостью 100 мл, мы получим раствор, точная концентрация которого будет равна 0,1003
Источник
Способы приготовления растворов
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
1.
По точной навескеготовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом. Основные этапы работы:
- рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г по одной из формул:
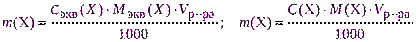
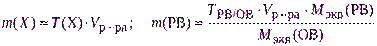
где Vр-ра – объем раствора, см 3 ;
- взвешивают точную навеску на аналитических весах;
- взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
- если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают, используя указанные выше формулы, например:
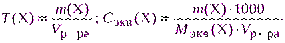
где Vр-ра – объем раствора, см 3 ; m(Х) – практическая навеска, г.
2.
По приблизительной навескеготовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Сэкв 1·V1 = Cэкв 2·V2 (2.16)
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
3.
Из фиксанала (норма-дозы, стандарт-титра)готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество nэкв вещества в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу (2.6).
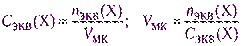
4.
Разбавлением концентрированных растворовготовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации, все расчеты ведут с точностью не более чем до 0,01, точную концентрацию устанавливают титрованием и рассчитывают по формуле (2.16).
Пример.Сколько грамм хлорида калия KCl потребуется для приготовления 2 дм 3 раствора:
а) с массовой долей, равной 30% и плотностью 1,110 г/см 3 ;
б) с титром, равным 0,001841 г/см 3 ;
в) с молярной концентрацией эквивалента, равной 0,2000 моль/дм 3 .
Решение.
| Дано: ω(KCl) = 30% | а) Массу хлорида калия рассчитаем, используя формулу (2.11): |
| Vр-ра= 2 дм 3 = 2000 см 3 ρ р-ра = 1,110 г/см 3 | 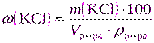 |
| Сэкв(KCl) = 0,2000 моль/дм 3 T(KCl) = 0,001841 г/см 3 |  |
| m(KCl) = ? |
б) Для расчета используем формулу (2.12):
в) Для расчета можно использовать формулу (2.7):
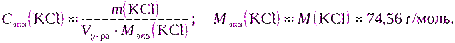
m(KCl) = Cэкв(KCl) · Vр-ра · Mэкв(KCl) = 0,2000·2·74,56 = 29,8240 г.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник